精索静脉曲张(varicocele, VC)是指男性蔓状静脉和精索内静脉异常扩张、伸长和迂曲的病理现象,多见于青壮年,以左侧多见,发病率约为15%,在男性不育症的病因中居首位[1]。VC所致男性不育机制,可能通过睾丸微循环、血管活性物质、氧化应激、一氧化氮、缺氧、免疫及凋亡等多种途径共同作用[2]。精索静脉高位结扎术(Varicocelectomy)是目前临床上最常见且有效的治疗,在精液参数的恢复和增加怀孕率等方面起着重要作用。细胞凋亡是一种正常的生理现象,在维持机体稳态过程中发挥重要的作用[3]。正常生精过程中约25%-75%的生精细胞凋亡,通过凋亡信号转导通路的调节,维持生精细胞与支持细胞的正常比例,以保证正常的生育功能。本研究中,我们主要探讨精索静脉高位结扎术对精索静脉曲张生精细胞凋亡机制的保护作用。
1 材料与方法 1.1 实验动物60只成年雄性Wistar大鼠,体重200-250 g,由湖北省疾病预防控制中心提供。所有动物饲养在恒定的温度[(22±2)℃], 自由进食、进水。所有实验均获武汉大学动物实验伦理委员会批准。
1.2 实验分组和模型的建立60只大鼠随机分为四组:对照组、假手术组、EV组(模型组)、Varicocelectomy组(治疗组),每组15只。手术采用2%戊巴比妥钠(50 mg/kg)腹腔麻醉, 常规消毒铺单,腹正中切口。① 对照组:本组大鼠未行手术治疗。② 假手术组:左肾静脉暴露后,仅分离而不结扎,4-0丝线缝合切口。③ EV组(模型组):仔细分离肾上腺静脉和精索静脉内侧的左肾静脉段,在左肾静脉上平行放置一直径约为0.5 mm光滑的金属杆,4-0丝线一并结扎,使左肾静脉直径缩窄为原来的一半, 然后将金属杆拉出,使左肾静脉复通。4周后,左精索静脉异常扩张,同时左肾无明显病理性萎缩,为EV模型成功建立的标准[4]。④ Varicocelectomy组(治疗组):在模型组大鼠建立成功的基础上,行左精索静脉高位结扎术。
1.3 标本采集精索静脉高位结扎术后6周,取各组大鼠左侧睾丸,仔细剪除附着的脂肪组织和筋膜,生理盐水冲洗后以滤纸拭干, 纵向将其切成两半,一半组织用于组织学检查,另一半组织放置液氮中冷冻后放置-80 ℃冰箱保存。
1.4 HE染色睾丸组织固定于4%多聚甲醛24 h后,常规石蜡包埋。5 μm厚切片,脱蜡, 水化后,用苏木精和伊红(HE)染色后封片。
1.5 TUNEL采用末端脱氧核苷酸转移酶介导的dUTP缺口末端标记(TUNEL)法检测生精细胞凋亡,细胞核染成棕色者为TUNEL阳性细胞,光镜下(×200) 每张切片选取10个视野,计数500个细胞,计算生精细胞中的凋亡细胞所占百分率,作为生精细胞的凋亡指数(AI)。
1.6 免疫组化Bcl-2、Bax和Caspase-3的表达采用免疫组化染色分析。试剂均为加拿大圣克鲁斯公司产品:Bax一抗,批号:sc-493;Bcl-2一抗,批号:sc-7382;Caspase-3一抗,批号:sc-7148。所有的步骤按说明书指示进行,显微镜下棕褐色为阳性染色。每张切片随机选定5个视野,设定基线标准染色强度的判定标准后,测定5个视野下的平均光密度值,将每例5个视野平均光密度的平均值作为该例的测量值,其值越大,染色越深,反映细胞内蛋白表达量越高。
1.7 逆转录聚合酶链反应(RT-PCR)从100 mg睾丸组织样本采用Trizol试剂提取总RNA,逆转录合成cDNA。应用ABI 7900实时PCR系统(应用生物系统,福斯特城,加拿大,美国)和SYBER Green mix扩增试剂盒(应用生物系统公司,福斯特城,加拿大,美国), 采用一步法进行RT-PCR反应,反应方案依据试剂盒操作步骤。反应条件为:逆转录50 ℃ 15 min,95 ℃ 40 s;循环条件为: 95 ℃ 30 s、56 ℃ 15 s、72 ℃ 45 s,40个循环。引物序列:Caspase-3正义链:5′-TGGACTGCGGTATTGAGACA-3′,反义链:5′-GCGCAAAGTGACTGGATGAA-3′,PCR产物160 bp;Bax正义链:5′-TGGACTGCGGTATTGAGACA-3′、反义链:5′-GCGCAAAGTGACTGGATGAA-3′,PCR产物160 bp;Bcl-2正义链:5′-CAAGAAGAGCGGTTCCTGGT -3′、反义链:5-CAGAAACAGCATTGGCGACC-3′,PCR产物110 bp;GAPDH正义链:5′-ACAGCAACAGGGTGGTGGA-3′,反义链:5′-TTTGAGGGTGCAGCGAACTT-3′,PCR产物253 bp。软件分析各组的循环阈值(Ct),最终数据以2-△△Ct进行分析,得出各组基因的表达量。
1.8 统计学分析所有数据均以x±s表示,采用SPSS 17.0统计软件进行方差分析,P < 0.05为差异有统计学意义。
2 结果 2.1 HE染色对照组、假手术组可见曲精小管内各级生精细胞排列有序,管腔有大量精子;模型组可见生精上皮排列紊乱,生精细胞广泛脱落,管腔间隙增大;治疗后生精细胞排列正常或轻度紊乱,少数腔内可见脱落的生精细胞(见图 1)。

|
图 1 各实验组大鼠睾丸组织显微结构(HE×200) A:对照组; B:假手术组; C:模型组; D:治疗组 |
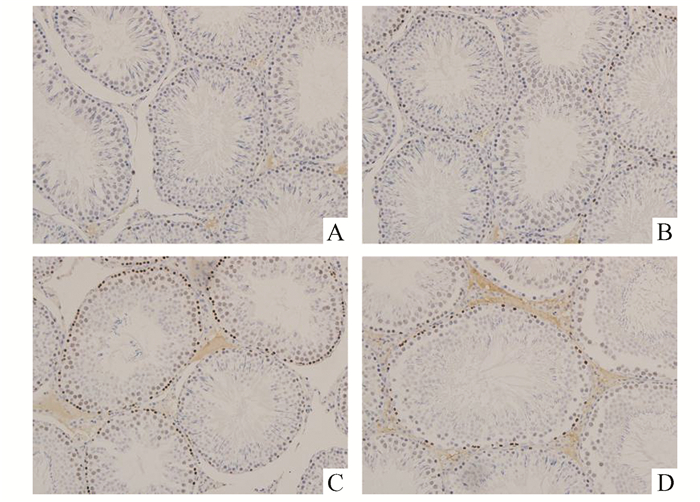
对照组和假手术组可见较少的、散在的生精细胞凋亡;模型组中凋亡细胞显著增加,染色的阳性细胞主要分布在各级生精细胞;治疗后,生精细胞凋亡明显减少(见图 2、表 1)。
|
图 2 各实验组大鼠睾丸组织生精细胞凋亡(TUNEL×200) A:对照组;B:假手术组;C:模型组;D:治疗组 |
| 表 1 各实验组左侧睾丸组织生精细胞凋亡的影响(%, x±s) |
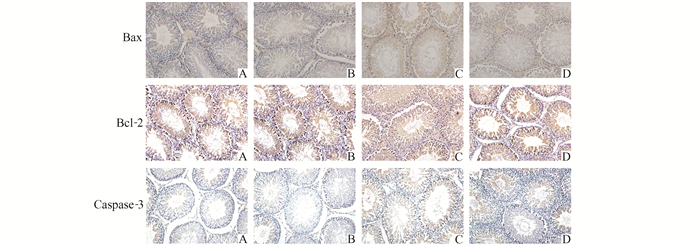
Bax, Caspase-3在对照组、假手术组中仅可见生精细胞细胞质和细胞核中散在的阳性表达;模型组中,其阳性表达明显增多,表现为细胞质和细胞核呈现为黄色或棕黄色;治疗后,阳性表达减少。Bcl-2在对照组、假手术组中可见生精细胞细胞质中大量表达;模型组和治疗组中,其阳性表达明显减少(见图 3)。
|
图 3 各实验组大鼠睾丸组织免疫组化结果(免疫组化×200) A:对照组; B:假手术组; C:模型组; D:治疗组 |
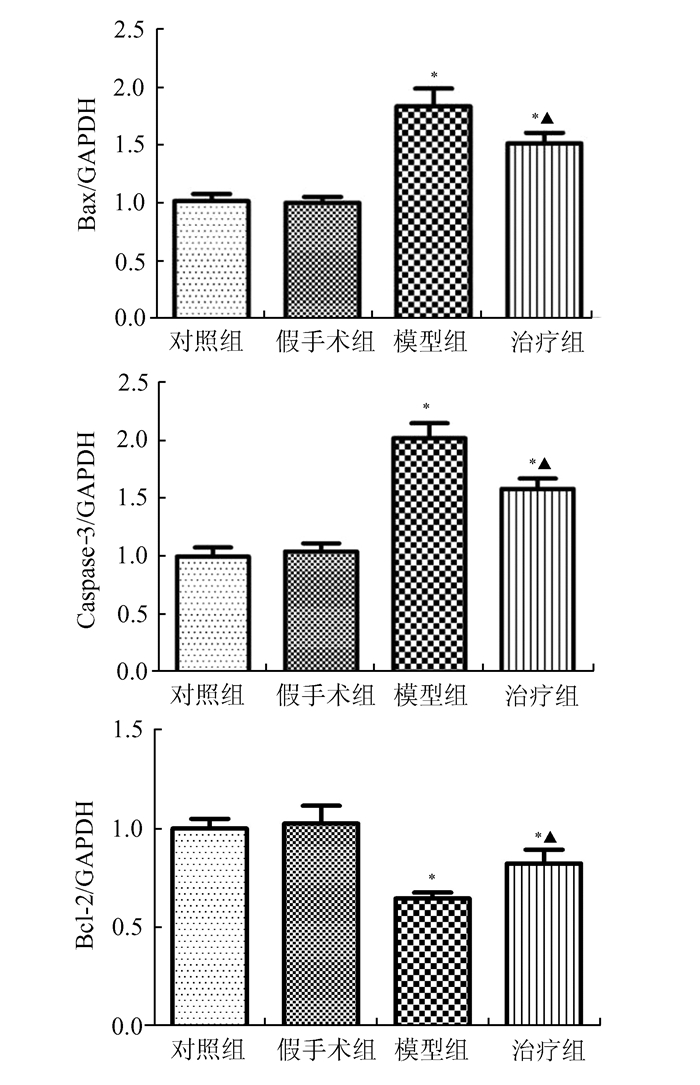
Bax、Caspase-3在模型组中的mRNA表达水平,与对照组和假手术组比较,显著增加,治疗后其mRNA表达水平降低;Bcl-2在治疗组中mRNA表达水平明显高于模型组(见图 4)。
|
图 4 各实验组左侧睾丸组织RT-PCR结果 与对照组、假手术组比较,*P<0.05;与模型组比较,▲P<0.05 |
细胞凋亡是生精过程中一个关键的调节因子,在正常精子发生过程中起着至关重要的作用[5],凋亡过程的改变会使生精细胞发生异常凋亡,从而引起不育。Fazlioglu等[6]在大鼠精索静脉曲张模型中发现,术后第14天双侧睾丸生精细胞较术前,凋亡明显增加;术后第28天生精细胞凋亡达到最高值,说明精索静脉曲张对生精细胞凋亡的影响。Barqawi等[7]也研究发现,精索静脉曲张可增加生精细胞凋亡,从而引起睾丸功能受损致男性不育。在本实验中, 我们通过TUNEL法和HE染色实验发现, 对照组、假手术组大鼠睾丸生精细胞仅存在散在的凋亡, 曲精小管内各级生精细胞排列有序,管腔有大量精子;模型组凋亡细胞显著增加,出现生精上皮排列紊乱,生精细胞广泛脱落等表现;治疗后生精细胞凋亡明显减少,生精细胞排列基本正常,生精功能明显好转, 证实了精索静脉曲张结扎术在睾丸生精细胞凋亡中的保护作用。
细胞凋亡过程是受基因的精确调控而完成的,其具体的过程机制尚不明确。关于细胞凋亡的主要信号通路, 目前认为主要有两条:即内在(线粒体)和外在(死亡受体)信号转导通路[8]。其中,线粒体信号转导通路是20世纪90年代后期所提出[9], 包括Bcl-2(抗凋亡蛋白)、线粒体外膜渗透和Caspase-9[10]。研究表明大多数情况下来自于细胞外的凋亡刺激因素使线粒体膜的通透性转换孔(permeability transition pore, PTP)打开, 进而促使线粒体释放凋亡启动因子(Cyto-C、AIF、Apaf-1) 等和procaspase-3入胞质,上述因子可通过下述多种机制导致细胞凋亡。Bcl-2是一组家族蛋白,其中包含促凋亡因子(如Bax)和抗凋亡因子(如Bcl-2)[11],它们是近年来发现的一对关系密切的凋亡基因,作为生精细胞凋亡的调节器,在凋亡的调控过程中发挥重要的作用[12]。Bcl-2是一种细胞膜蛋白,主要存在于线粒体膜、内质网和核膜上[13],它主要通过稳定线粒体外膜,干扰Cyto-C / Apaf-1激活(凋亡)途径,抑制细胞凋亡[14]。研究发现,精索静脉曲张中,低氧条件下可激活内皮细胞分泌生长因子,激发平滑肌细胞大量增殖,从而引起不同细胞中Bcl-2表达增加,从而发挥抗凋亡作用[15]。而Bax、Bak可与Bcl-2结合,阻止其对Cyto-C释放孔道的抑制作用,从而促进Cyto-C从线粒体释放,引起凋亡[16]。Bcl-2过表达时,有利于延长细胞生存期,抑制细胞凋亡。而Bax过表达时则促进细胞凋亡[17]。在本实验治疗组中, Bax表达比模型组显著降低, 而Bcl-2表达增高,其生精细胞凋亡指数显著降低,表明Bcl-2、Bax表达通过线粒体信号转导通路,睾丸生精细胞中Bcl-2和Bax表达的变化对决定细胞的命运起到关键作用。
在人类凋亡通路级联反应中,半胱氨酸天冬氨酸蛋白酶(Caspase)是细胞凋亡机制中必不可少的组成部分,并参与多种发病机制,如睾丸生精障碍,降低精子活力和精子DNA水平等[18]。其中,Caspase-3是细胞凋亡的重要效应酶,也是关键的执行者,它不仅存在于细胞质中,生精细胞的核周也有分布[19]。正常情况下,Caspase-3以酶原的形式存在,无活性,当细胞接受凋亡刺激时,其被激活后通过信号转导引起细胞底物的降解而诱导凋亡,这些影响包括细胞固缩、碎裂,染色质凝聚和DNA片段化;有研究显示,通过建立睾丸内雄激素缺乏模型,发现睾丸组织中生精细胞凋亡引起睾酮的降低是Caspase-3依赖性的,表明Caspase-3激活参与并诱导生精细胞凋亡[20]。本实验中,模型组中Caspase-3表达明显增加,治疗后表达减少,这与TUNEL研究结果一致,提示Caspase-3在精索静脉曲张所致生精细胞凋亡过程中发挥了重要作用。
本研究结果表明,精索静脉高位结扎术可抑制睾丸生精细胞凋亡,且Bcl-2、Bax和Caspase-3通过线粒体信号转导通路参与并调控生精细胞凋亡过程。我们相信,随着精索静脉曲张致睾丸生精凋亡机制的研究不断深入,对于精索静脉曲张不育患者更好的治疗以及预防复发,会有更广阔的前景。
| [1] | Vazquez-Levin MH, Friedmann P, Goldberg SI, et al. Response of routine semen analysis and critical assessment of sperm morphology by Kruger classification to therapeutic varicocelectomy[J]. J Urol, 1997, 158(5): 1 804-1 807. DOI: 10.1016/S0022-5347(01)64134-X. |
| [2] | Abdel AM, Mostafa T, Atta H, et al. Heme oxygenase enzyme activity in seminal plasma of oligoasthenoteratozoospermic males with varicocele[J]. Andrologia, 2010, 42(4): 236-241. DOI: 10.1111/and.2010.42.issue-4. |
| [3] | Lee JD, Lu LY, Cheng WH, et al. Dysregulated apoptosis through the intrinsic pathway in the internal spermatic vein of patients with varicocele[J]. J Formos Med Assoc, 2009, 108(8): 612-618. DOI: 10.1016/S0929-6646(09)60381-8. |
| [4] | Lee JD, Lee TH, Cheng WH, et al. Involved intrinsic apoptotic pathway of testicular tissues in varicocele-induced rats[J]. World J Urol, 2009, 27(4): 527-532. DOI: 10.1007/s00345-008-0367-8. |
| [5] | Tanaka H, Fujisawa M, Tanaka H, et al. Apoptosis-related proteins in the testes of infertile men with varicocele[J]. BJU Int, 2002, 89(9): 905-909. DOI: 10.1046/j.1464-410X.2002.02746.x. |
| [6] | Fazlioglu A, Yilmaz I, Mete O, et al. The effect of varicocele repair on experimental varicocele-induced testicular germ cell apoptosis[J]. J Androl, 2008, 29(1): 29-34. DOI: 10.2164/jandrol.107.002717. |
| [7] | Barqawi A, Caruso A, Meacham RB. Experimental varicocele induces testicular germ cell apoptosis in the rat[J]. J Urol, 2004, 171(1): 501-503. DOI: 10.1097/01.ju.0000088775.69010.61. |
| [8] | Rincheval V, Bergeaud M, Mathieu L, et al. Differential effects of Bcl-2 and caspases on mitochondrial permeabilization during endogenous or exogenous reactive oxygen species-induced cell death: a comparative study of H(2) O(2), paraquat, t-BHP, etoposide and TNF-alpha-induced cell death[J]. Cell Biol Toxicol, 2012, 28(4): 239-253. DOI: 10.1007/s10565-012-9219-9. |
| [9] | Vega-Naredo I, Cunha-Oliveira T, Serafim TL, et al. Analysis of pro-apoptotic protein trafficking to and from mitochondria[J]. Methods Mol Biol, 2015, 1 241: 163-180. |
| [10] | Hopps CV, Lemer ML, Schlegel PN, et al. Intraoperative varicocele anatomy: a microscopic study of the inguinal versus subinguinal approach[J]. J Urol, 2003, 170(6 Pt 1): 2 366-2 370. |
| [11] | Cerella C, Gaigneaux A, Mazumder A, et al. Bcl-2 protein family expression pattern determines synergistic pro-apoptotic effects of BH3 mimetics with hemisynthetic cardiac glycoside UNBS1450 in acute myeloid leukemia[J]. Leukemia, 2017, 31(3): 755-759. DOI: 10.1038/leu.2016.341. |
| [12] | Mohammadi A, Yaghoobi MM, Gholamhoseyniannajar A, et al. HSP90 inhibitor enhances anti-proliferative and apoptotic effects of celecoxib on HT-29 colorectal cancer cells via increasing BAX/BCL-2 ratio[J]. Cell Mol Biol (Noisy-le-grand), 2016, 62(12): 62-67. |
| [13] | Blumer CG, Fariello RM, Restelli AE, et al. Sperm nuclear DNA fragmentation and mitochondrial activity in men with varicocele[J]. Fertil Steril, 2008, 90(5): 1 716-1 722. DOI: 10.1016/j.fertnstert.2007.09.007. |
| [14] | Nair R, Shaha C. Diethylstilbestrol induces rat spermatogenic cell apoptosis in vivo through increased expression of spermatogenic cell Fas/FasL system[J]. J Biol Chem, 2003, 278(8): 6 470-6 481. DOI: 10.1074/jbc.M209319200. |
| [15] | Kilinc F, Kayaselcuk F, Aygun C, et al. Experimental varicocele induces hypoxia inducible factor-1alpha, vascular endothelial growth factor expression and angiogenesis in the rat testis[J]. J Urol, 2004, 172(3): 1 188-1 191. DOI: 10.1097/01.ju.0000135455.97627.15. |
| [16] | Pu H, Wang X, Su L, et al. Heroin activates ATF3 and CytC via c-Jun N-terminal kinase pathways to mediate neuronal apoptosis[J]. Med Sci Monit Basic Res, 2015, 21: 53-62. DOI: 10.12659/MSMBR.893827. |
| [17] | Kuerban M, Naito M, Hirai S, et al. Involvement of Fas/Fas-L and Bax/Bcl-2 systems in germ cell death following immunization with syngeneic testicular germ cells in mice[J]. J Androl, 2012, 33(5): 824-831. DOI: 10.2164/jandrol.111.015529. |
| [18] | Said TM, Paasch U, Glander HJ, et al. Role of caspases in male infertility[J]. Hum Reprod Update, 2004, 10(1): 39-51. DOI: 10.1093/humupd/dmh003. |
| [19] | Paasch U, Grunewald S, Wuendrich K, et al. Immunomagnetic removal of cryo-damaged human spermatozoa[J]. Asian J Androl, 2005, 7(1): 61-69. DOI: 10.1111/j.1745-7262.2005.00009.x. |
| [20] | Kim JM, Ghosh SR, Weil AC, et al. Caspase-3 and caspase-activated deoxyribonuclease are associated with testicular germ cell apoptosis resulting from reduced intratesticular testosterone[J]. Endocrinology, 2001, 142(9): 3 809-3 816. DOI: 10.1210/endo.142.9.8375. |
 2017, Vol. 38
2017, Vol. 38

 ,
,