2. 中国科学院深圳先进技术研究院 广东 深圳 518055;
3. 东北大学中荷生物医学工程与信息学院 辽宁 沈阳 110169
2. Shenzhen Institutes of Advanced Technology, Chinese Academy of Sciences, Shenzhen 518055, Guangdong, China;
3. Northeastern University, School of SINO-DUTCH Biomedical and Information Engineering, Shenyang 110169, China
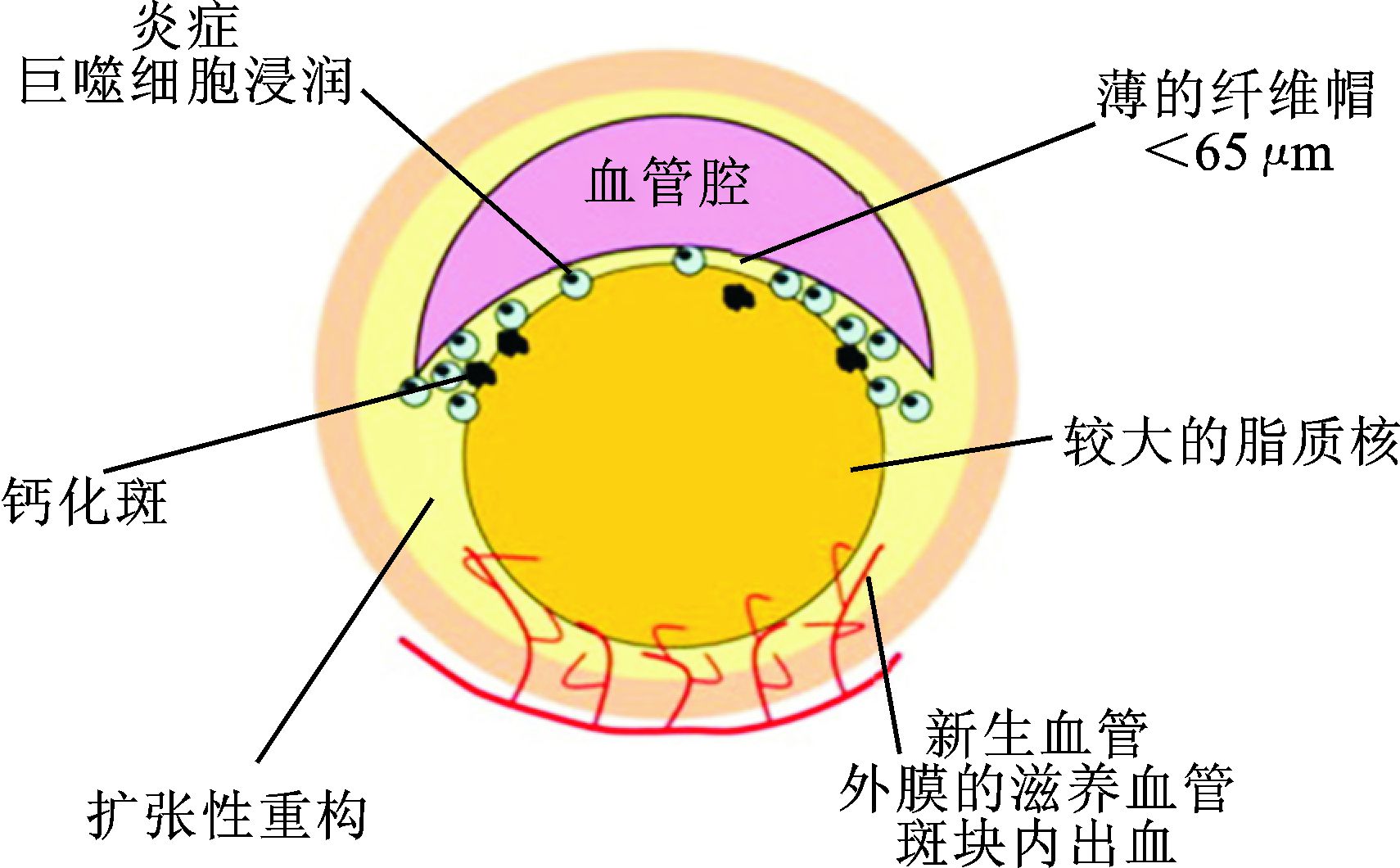
通过对尸检的心脏标本、冠状造影图像等的研究发现,不是所有的动脉粥样硬化都会形成血栓。我们把不会形成血栓的动脉粥样硬化斑块称为稳定斑块。相对比于稳定斑块,还有一种有破裂倾向的粥样硬化斑块,这种斑块被称为易损斑块 (vulnerable plaque)。研究[1]发现薄纤维帽、广泛的巨噬细胞浸润、平滑肌细胞缺乏和大脂核是易损斑块最普通的特征,如图 1。虽然动脉粥样硬化是目前所知导致冠状动脉心脏病、颈动脉疾病和外周动脉疾病最常见的原因,但是单纯的动脉粥样硬化很少致病。只有在易损斑块破裂的基础上形成的叠层血栓才会发生致命的临床事件,比如急性冠脉综合征 (acute coronary syndrome,ACS)、脑卒中 (cerebral stroke) 等,因此对动脉粥样硬化的研究重点是对易损斑块进行研究。作用于斑块上的外力主要有血液流动产生的剪切应力 (wall shear stress,WSS)、脉动的血流与血压产生的周向应力 (circumferential strain,CS) 和血压与周围组织产生的纵向张应力[2, 3],斑块组织在各种力的作用下产生的形变和参数共振是导致其破裂的直接原因,而血流速度的改变是导致这些机械应力产生变化的主要原因,因此研究斑块的血流速度分布具有重要意义。
|
图 1 易损斑块的组成部分 |
粒子图像测速技术 (particle image velocimetry,PIV) 是基于互相关算法提出的一种实时、动态的二维流场测速方法。已有相关研究指出[4],应用PIV技术可以准确计算旋转流场、血管仿体、大鼠动脉和静脉的血流速度。计算流体力学[5](computational fluid dynamics,CFD) 是利用计算机进行数值模拟来实现血流动力学的研究,已有许多研究者建立人体真实动脉模型[6-8],使用计算流体力学从不同方面研究个体实例动脉的血流动力学,具有很大的临床意义。
本文建立3组不同狭窄程度的血管仿体,分别使用PIV和CFD方法计算3组仿体斑块附近的血流速度分布。为了对这两种方法测量的实验结果进行比较,PIV实验的进出口端参数作为CFD的初始边界条件使用。并将两种方法的对比结果用Origin 85软件进行处理,为临床使用这两种方法提供参考。
1 材料与方法 1.1 PIV测速系统PIV图像测速技术是利用造影微泡对超声的强烈反射,记录通过造影区域前后两帧超声图像,对这两帧图像进行互相关算法处理得到造影微泡的位移,进而获得流场的速度分布。本次实验的PIV测速是在由高频超声系统、造影微泡、血管仿体等组成的PIV实验测速平台完成的。
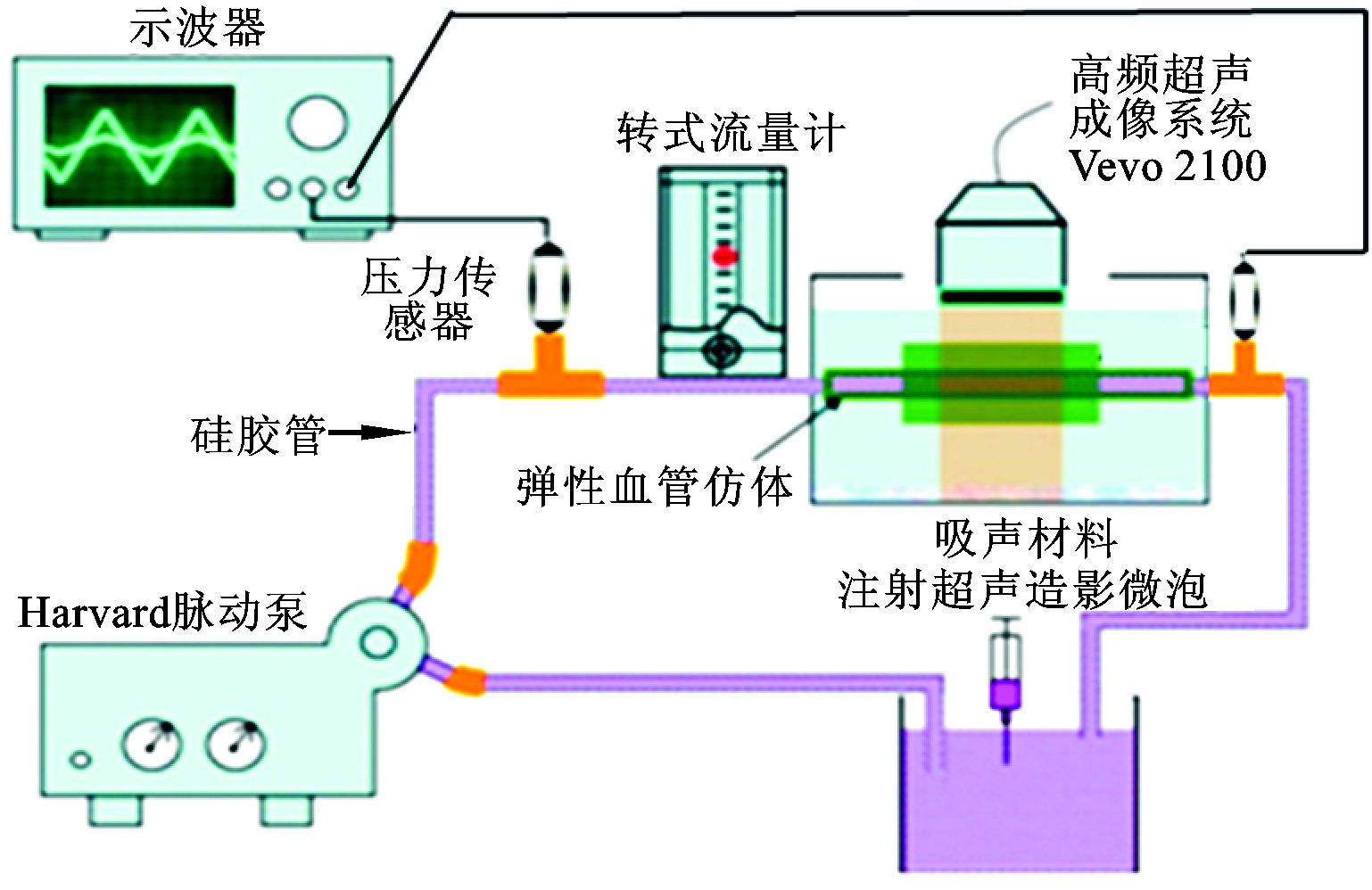
1.1.1 PIV测速平台本次实验的测速平台如图 2所示,该系统可以用来模拟人体血液流动的心血管系统。由脉动血泵产生脉动流,经过储液池、传输管道流经血管仿体,并形成循环回路,流进仿体的水流为脉动流。通过对脉动泵频率、每搏输出量、收缩期/舒张期时间比等参数的调控,使弹性血管仿体产生模拟人体血管的运动特征。适当浓度的超声造影微泡 (造影剂) 作为示踪剂添加到流体中。在仿体入口段需要预留长度满足的入口段长度,保证流体的运动达到稳定状态,本次实验预留的长度为0.58 m。在弹性血管仿体的入口端和出口端分别放置压力传感器,并将压力传感器连接至示波器,从示波器读取的入口端和出口端压力波形作为CFD模拟的初始边界条件。转式流量计记录通过仿体的流体流量,流体流量也作为CFD模拟的初始条件。经过上述步骤保证了PIV实验和CFD模拟是在同一条件下完成的。
|
图 2 PIV实验装置 |
超声系统采用加拿大VisualSonics公司生产的Vevo2100超声实时分子影像系统,该系统具有高达30 μm的空间分辨率和大于1 000帧/s的时间分辨率。测量探头使用的探头型号为MS250,该型号的探头可以以垂直的角度探测待测仿体,并且得到矩形图像。实验超声系统参数是:帧频 (Frame rate) 为154帧/s,成像深度 (Depth) 为10 mm,成像宽度 (Width) 为16 mm,增益 (Gain) 为30 dB。
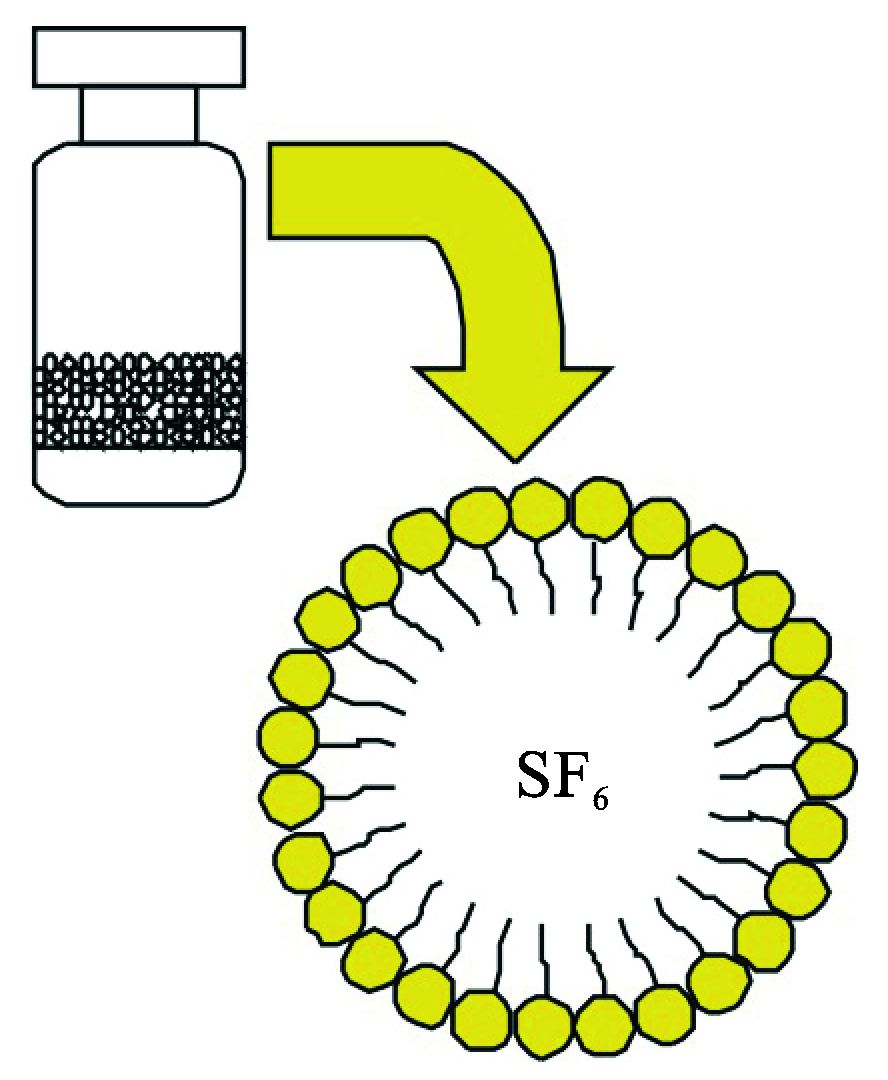
1.1.3 造影微泡和血管仿体实验采用的微泡是由外壳材料包裹气体制成的,外壳材料是二硬脂酸磷脂酰胆碱和聚乙二醇化二硬脂酸磷脂酰乙醇胺,气体是六氟化硫。制备好的微泡如图 3所示。
|
图 3 制备好的微泡 |
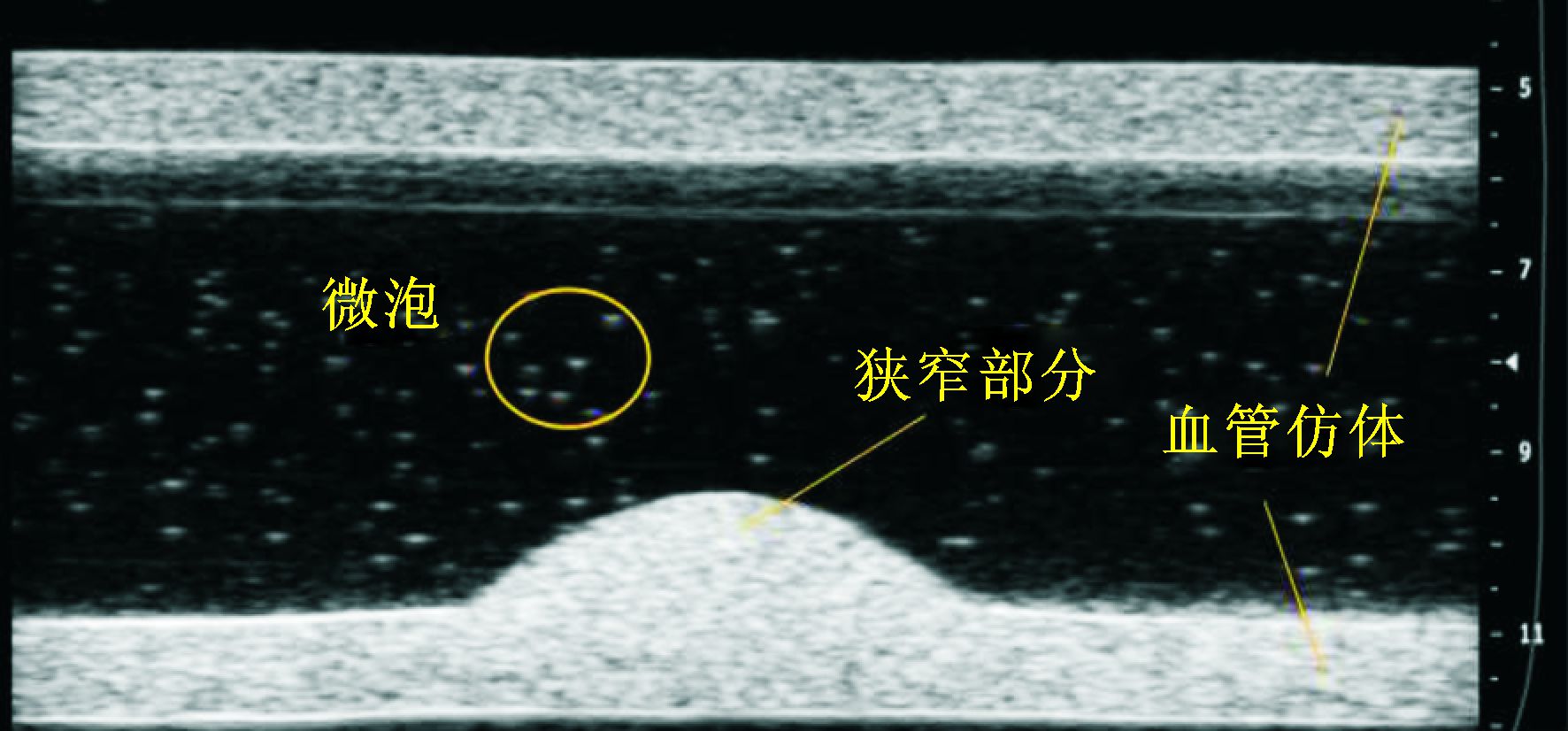
为了模拟人体血管弹性,实验材料选用SIGMA-ALDRICH公司生产的聚乙烯醇 (polyvinyl alcohol cryogel,PVA),使用冷冻解冻法来制备仿体血管,并在仿体制备过程中添加了SIGMA-ALDRICH公司的Sigmacell Cellulose,用以增强仿体对于超声的反射。本次实验共制备了3组仿体,仿体形态参数如表 1所示。超声系统下微泡和血管仿体图像如图 4所示。
| 表 1 斑块形态参数 |
|
图 4 超声系统下的微泡和血管仿体 |
实验所采用的测速算法过程如图 5所示,包括图像互相关计算、亚像素处理、滤波插值算法和速度矢量修正这几个主要部分。具体过程是连续输入两帧图像,并设置迭代次数M,经过互相关计算和亚像素处理得到位移矢量,经滤波插值后得到第一次迭代的结果。若迭代没有完成,则根据前一次迭代结果进行询问窗口变形,再重复上述迭代过程,最后将得到的结果进行速度矢量修正,至此完成图像算法整个过程。
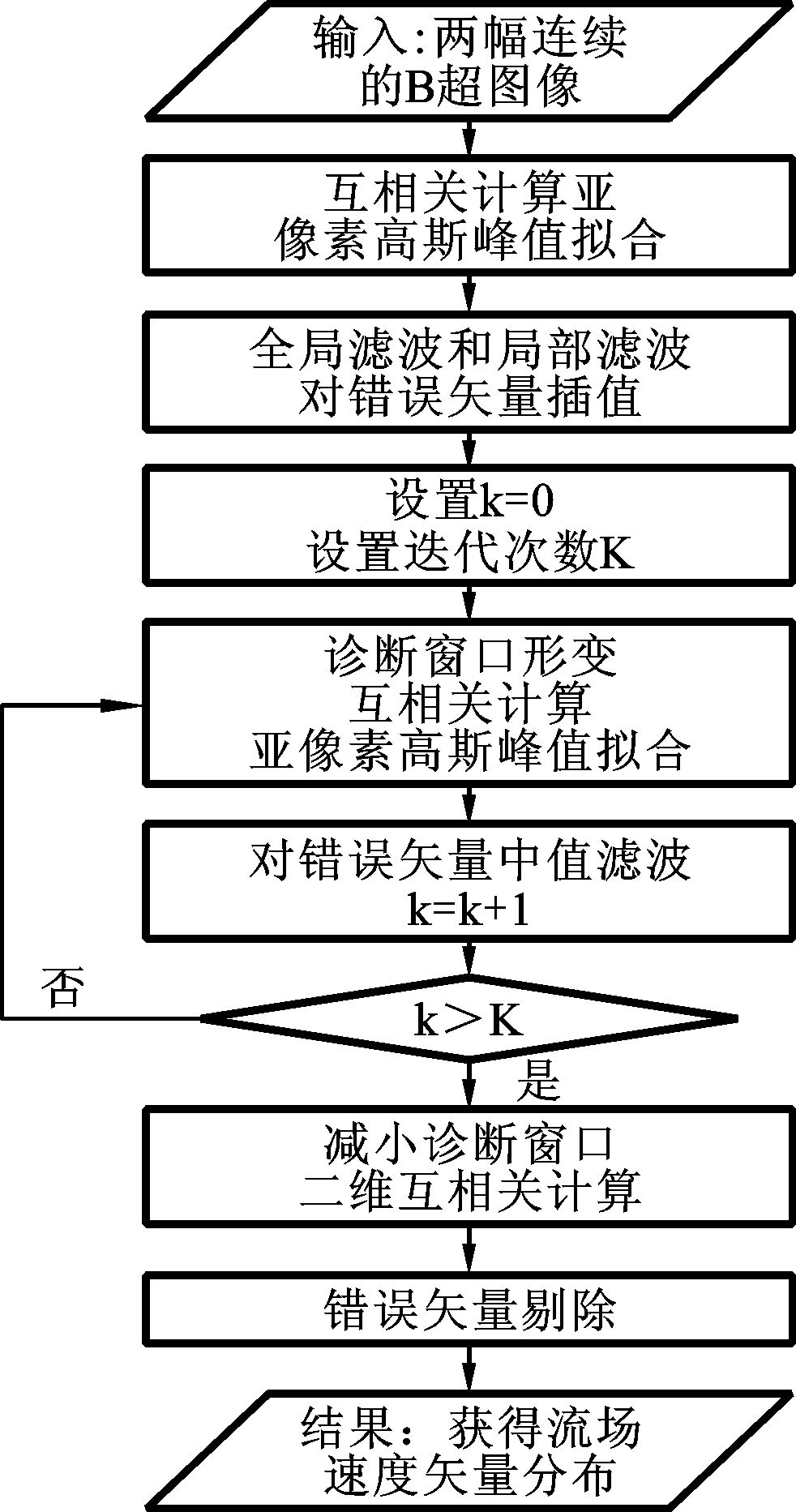
|
图 5 二维Echo PIV图像处理主程序流程图 |
CFD数值模拟采用了ANSYS公司的Workbench分析软件,Workbench功能完整可以实现建立模型、网格划分、边界条件设置、求解、后处理功能。CFD的初始条件为入口流量20 L/h,进出口段压力通过UDF加载到边界条件设置中。
2 结果在上述实验条件下分别得到了3组不同狭窄程度仿体的CFD和PIV实验结果, 选取的比较位置如图 6所示。
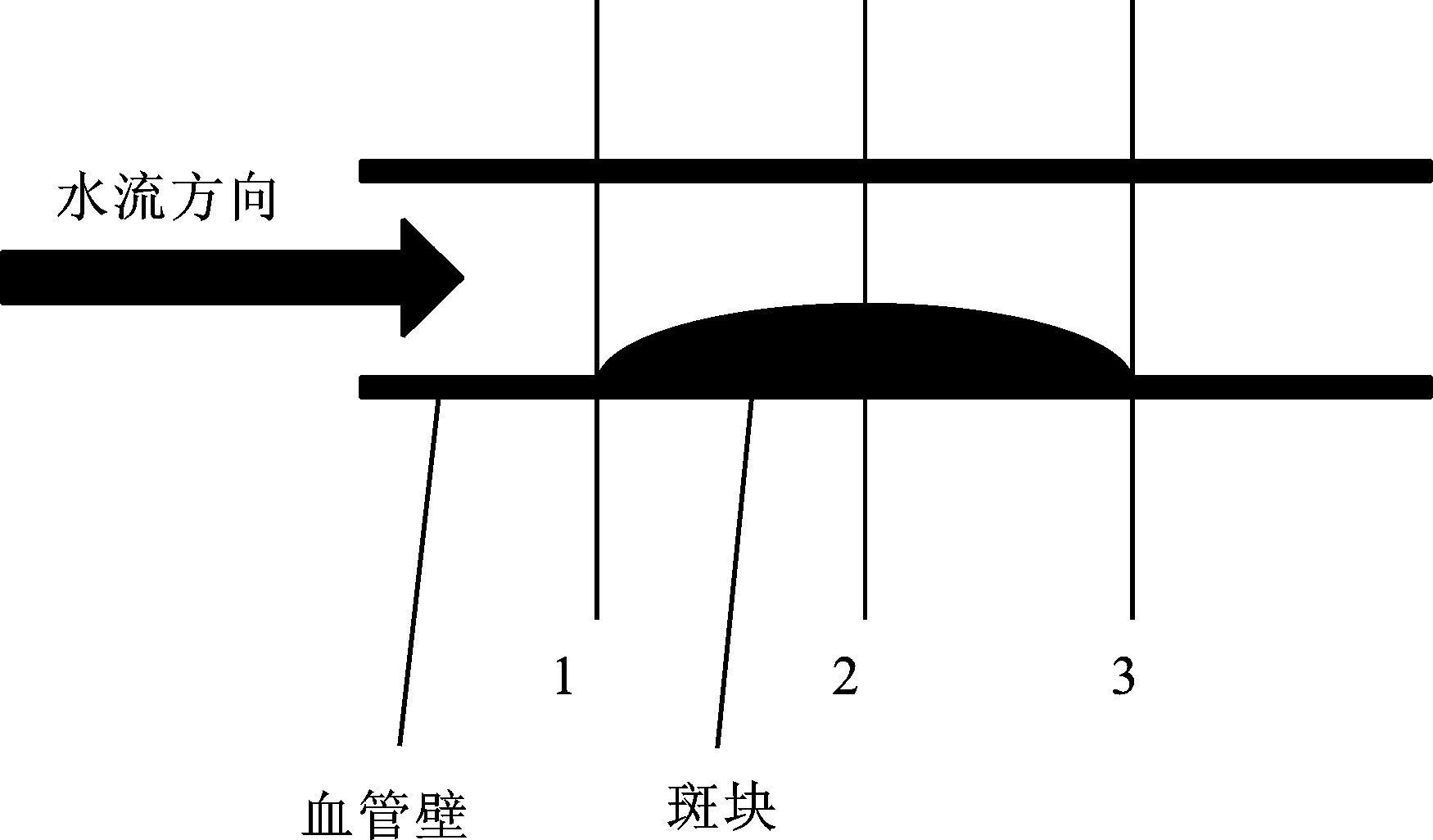
|
图 6 PIV与CFD结果对比位置 |
见图 7。
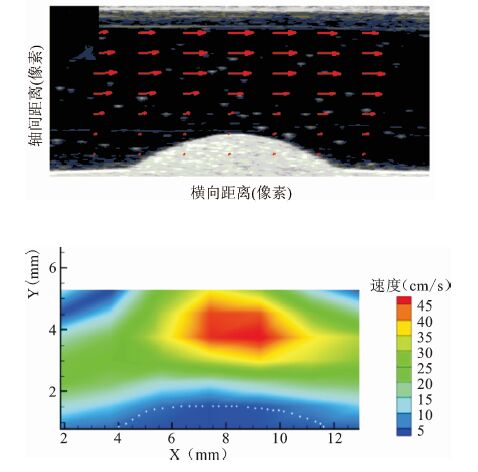
|
图 7 30%狭窄仿体实验结果 上.流场分布;下.速度分布彩图 |
见图 8。
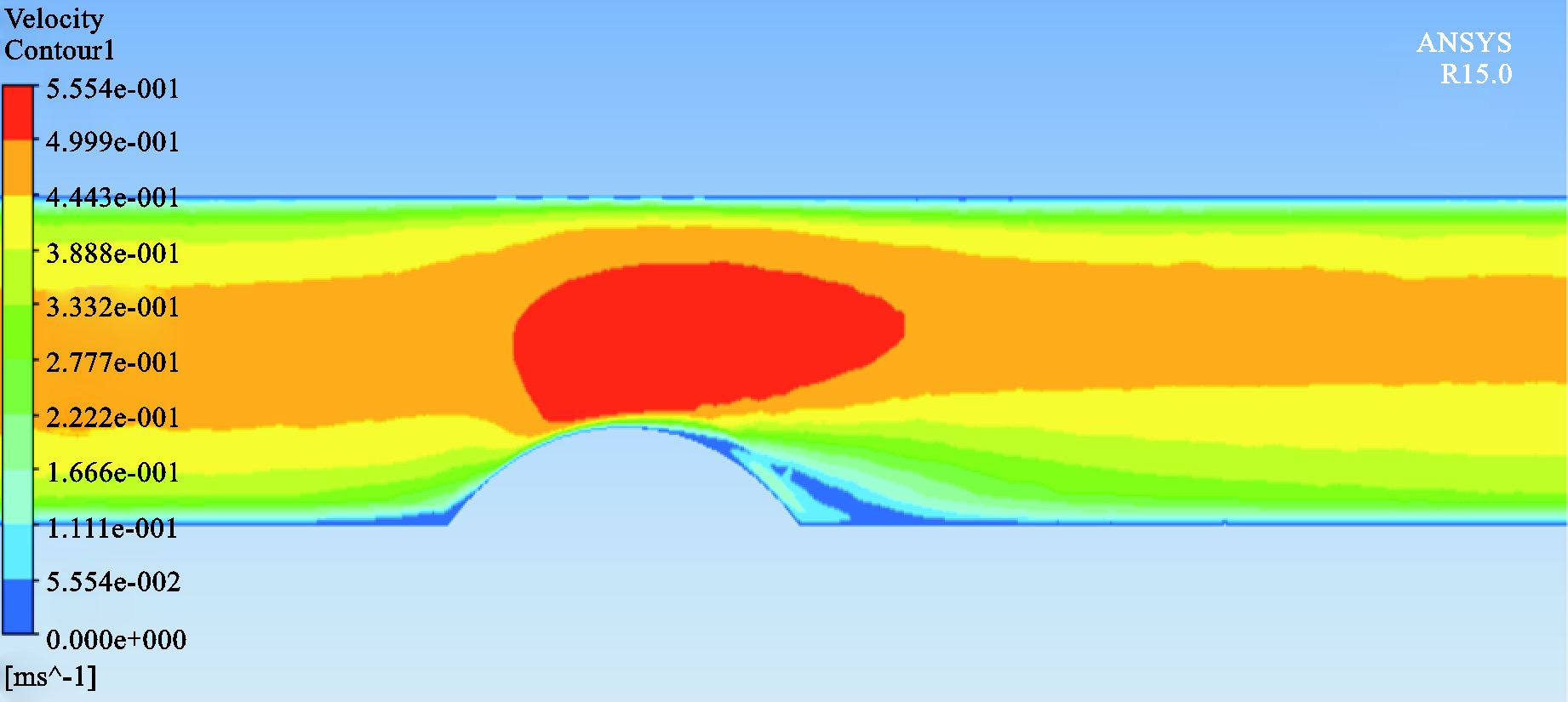
|
图 8 30%狭窄CFD结果 |
见图 9。
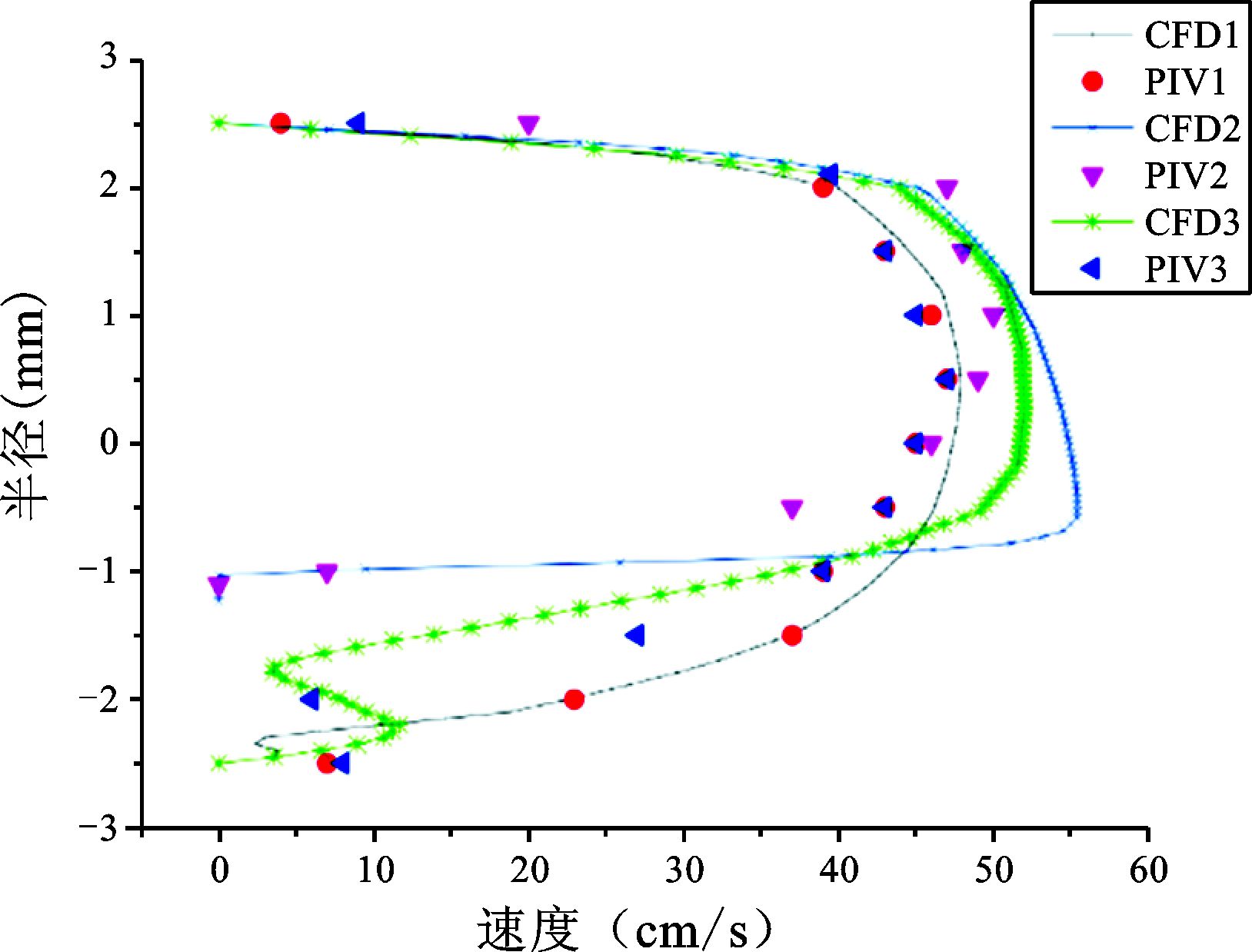
|
图 9 30%狭窄程度仿体CFD和PIV结果对比 |
见图 10。
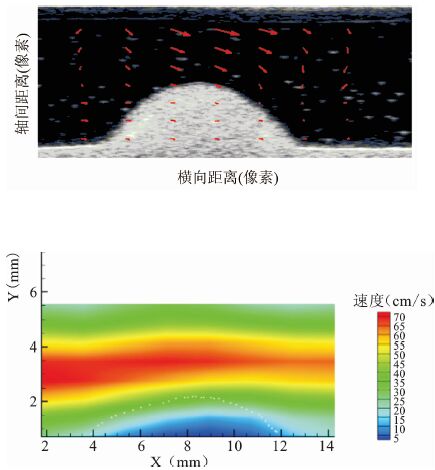
|
图 10 50%狭窄仿体实验结果 上.流场分布;下.速度分布彩图 |
见图 11。
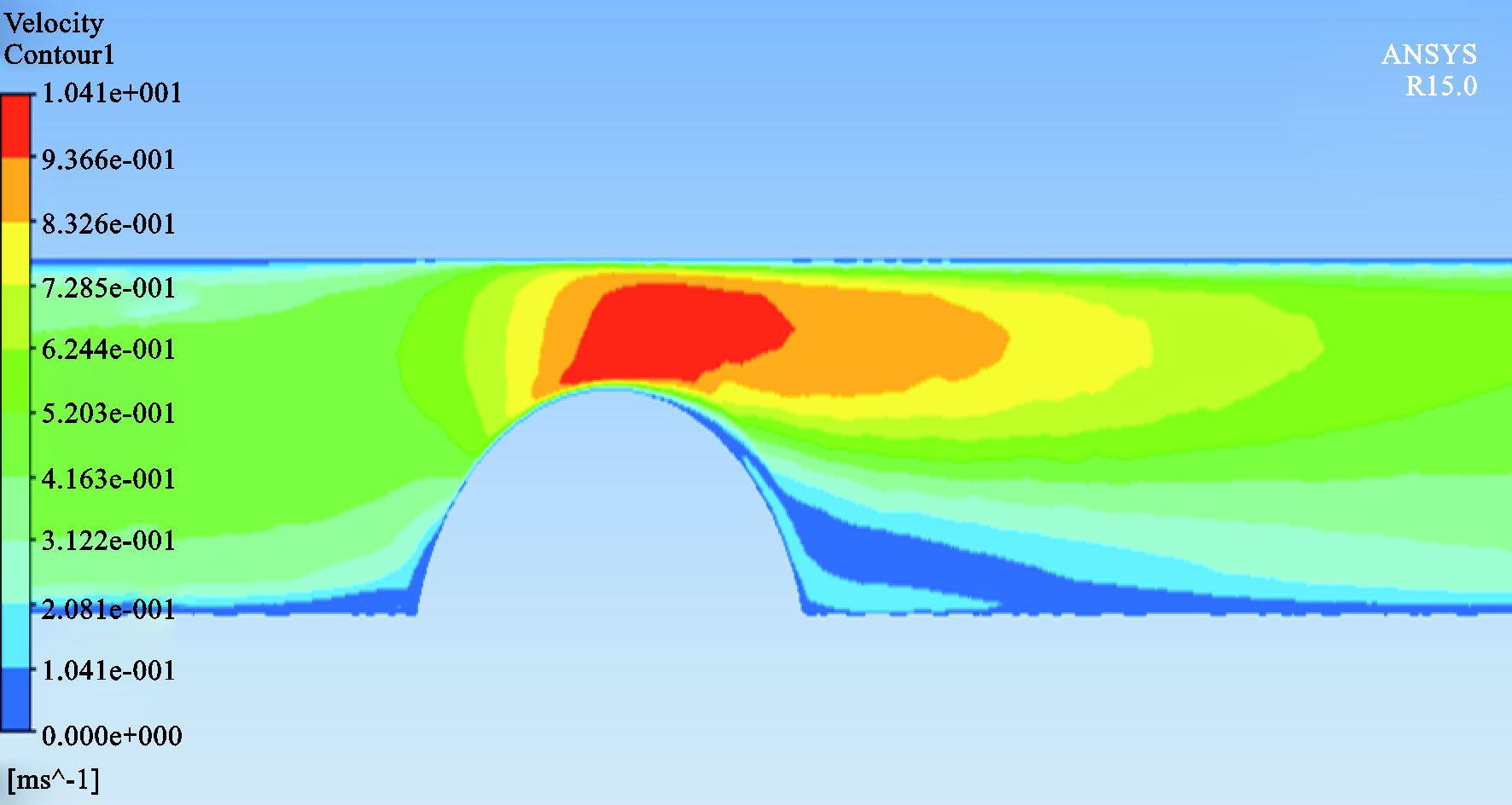
|
图 11 50%狭窄CFD结果 |
见图 12。
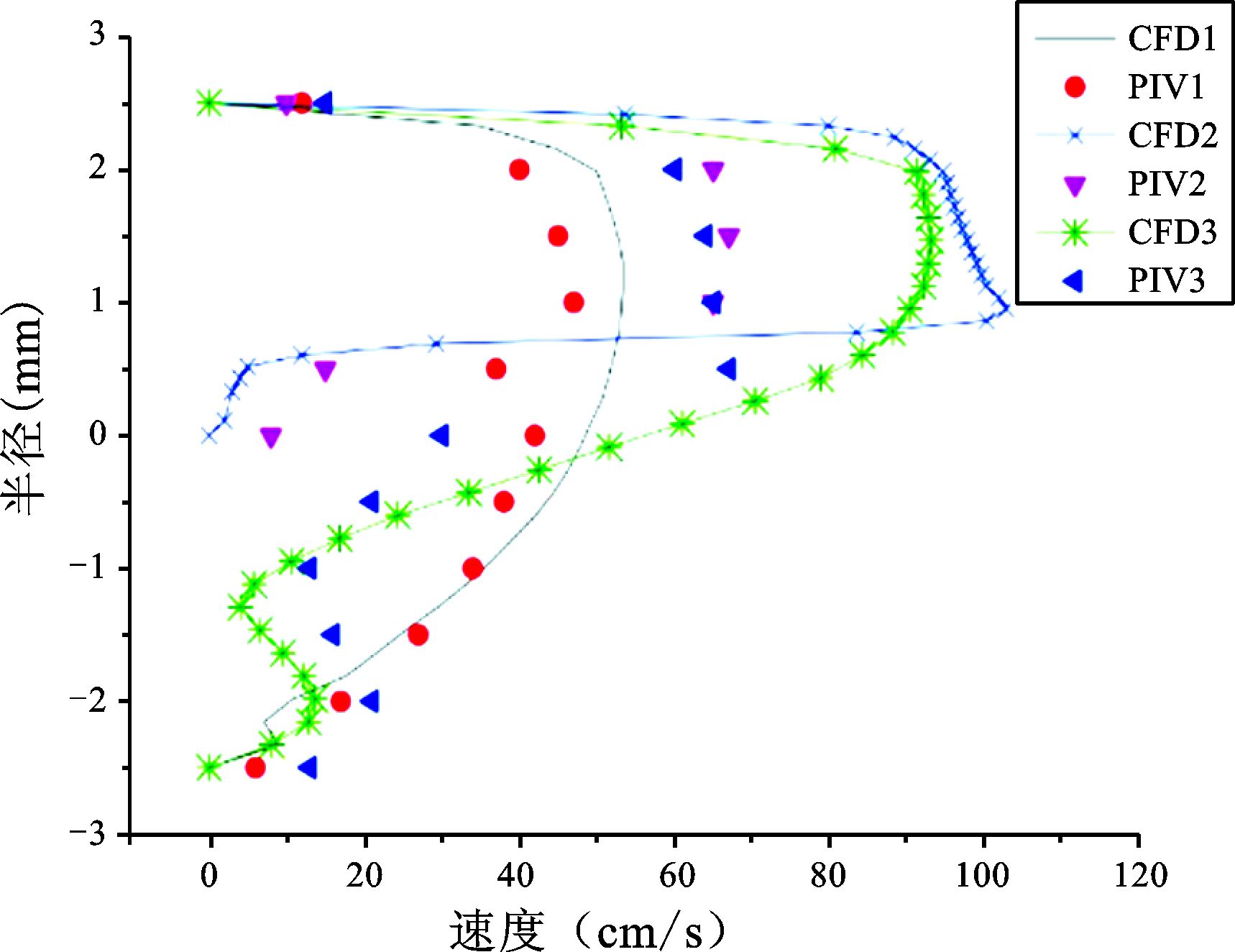
|
图 12 50%狭窄程度仿体CFD和PIV结果对比 |
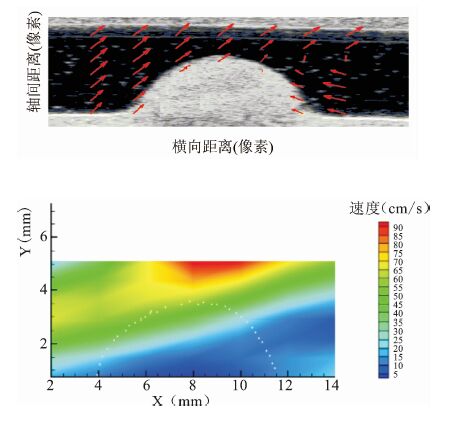
见图 13。
|
图 13 70%狭窄仿体实验结果 上.流场分布;下.速度分布彩图 |
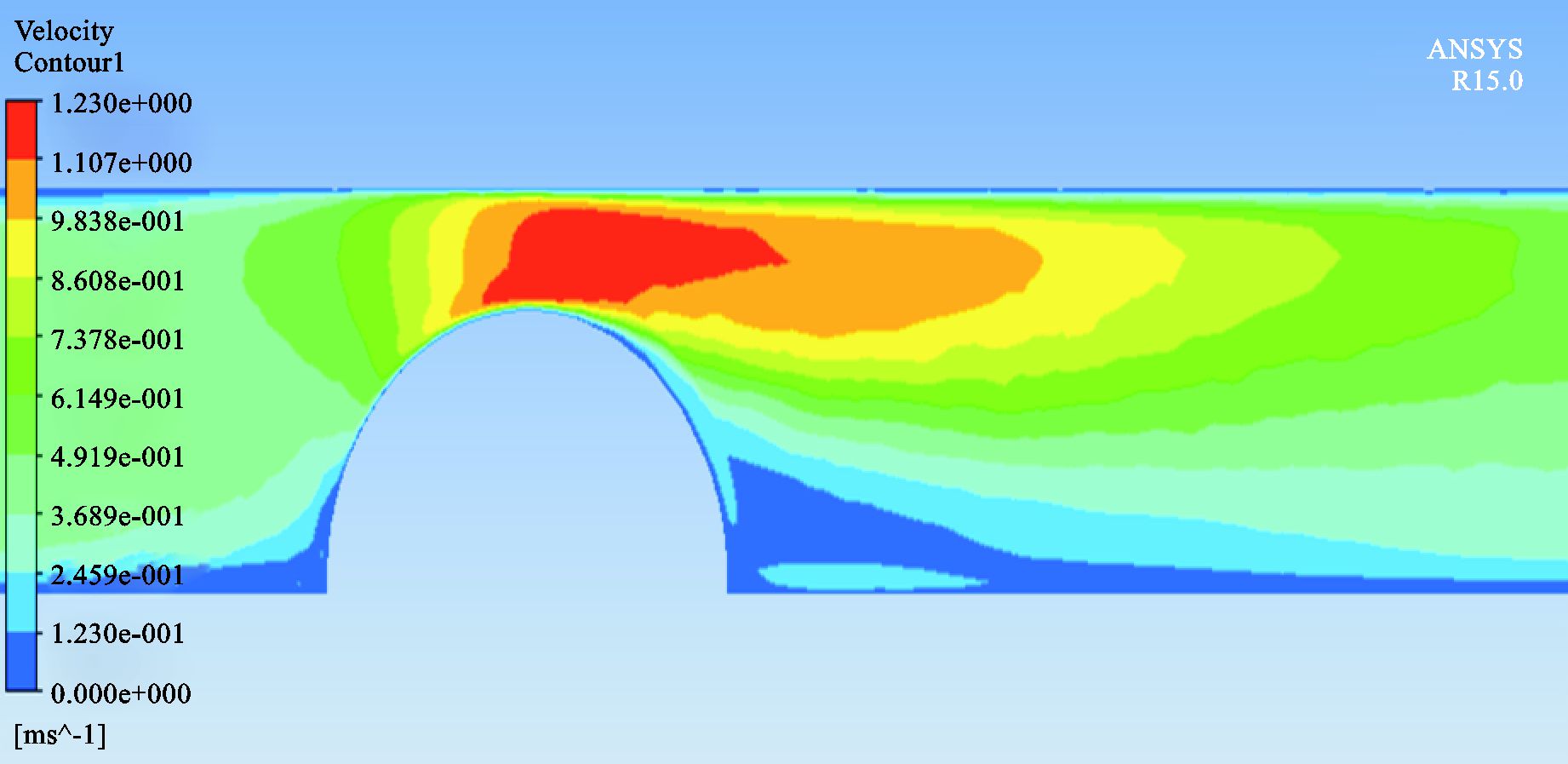
见图 14。
|
图 14 70%狭窄CFD结果 |
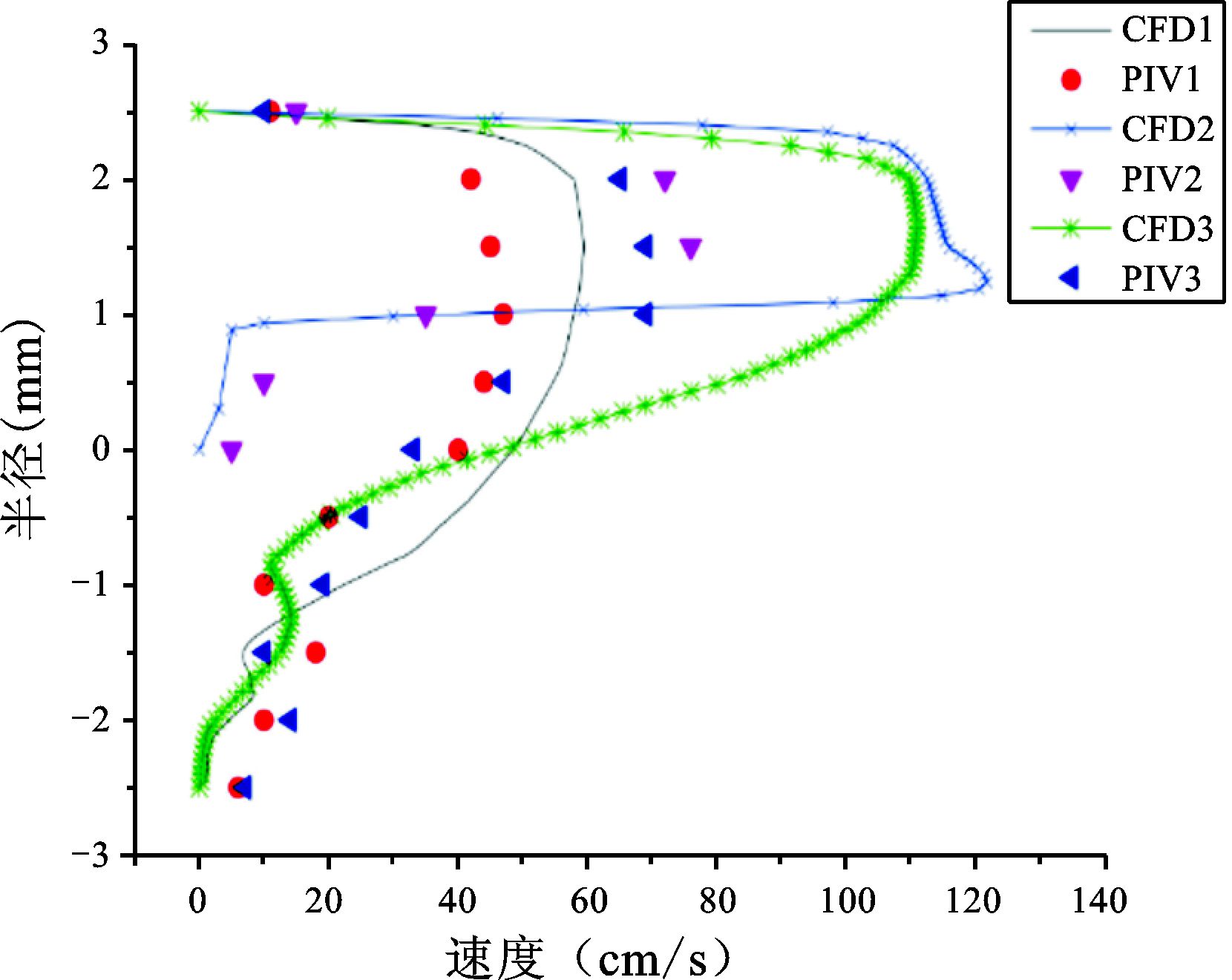
见图 15。
|
图 15 70%狭窄程度仿体CFD和PIV结果对比 |
为了直观,现在每组实验结果的平均速度列于表 2。
| 表 2 各组仿体CPD模拟和PIV测速的平均速度对比 |
3组仿体的结果表明这两种方法作为常用的测量二维血流分布的方法,在3组实验中都能得到较好的实验结果,都能准确捕捉到斑块前后血流变化较明显的信息:即随着仿体狭窄程度的增加,斑块前部分的速度增加,斑块后部分回流面积增加。但是两种方法所得到的速度并非完全一致,在30%狭窄程度的仿体中,这两种实验方法所得的结果更接近。而50%和70%狭窄程度的仿体中,这两种实验方法所得的结果有差异。
3 讨论通过对血管血流速度的研究可以评估斑块发生破裂的风险,从而采取有效预防措施,降低斑块破裂的几率。CFD作为一种可以预测血管内血流速度的分布的方法,已经广泛应用于血管瘤破裂研究、冠状动脉搭桥手术等领域。PIV方法作为一个非侵入的超声测速技术,能提供高空间分辨率的二维血流速度场分布。既然PIV和CFD都可以作为测量血流速度分布的方法,那么我们就想知道这两种方法在测量结果上的异同,为临床应用提供更多有价值的参考。本次实验设置了不同狭窄程度的3组仿体,对于每组仿体都完成了CFD和PIV的测量,具体过程是:通过搭建PIV测速系统测量血管仿体的流体速度分布,同时在PIV测速期间记录下进口端血流速度分布,及进出口段压力分布,并将这些条件作为边界条件加载到CFD模拟中。因为PIV测速和边界条件时同时进行的,这就保证了CFD的模拟条件与PIV测速条件是完全一样,从而可以比较两种方法的测量结果。
3组仿体实验的结果都表明:在一个心动周期的收缩期,也就是速度最大时刻,PIV实验方法和CFD模拟方法测量的血流分布的趋势是相同的。但在血流速度较低的情况下,这两种方法所能得到的结果更接近。在血流速度较高的情况下,两种方法所得的结果存在明显差异。造成这种差异的主要原因有:CFD方法是在假定管壁为刚性的前提下进行流体速度的计算,而PIV实验采用弹性仿体。另外PIV实验中微泡的浓度、超声设备帧频的限值也会影响PIV实验结果。
流体的速度分布不仅受斑块狭窄程度的影响,还受到斑块长度的影响。在斑块狭窄程度相同的情况下,斑块长度越短,斑块后部的回流越明显。回流区域大小又与震荡切应力相关,震荡切应力越大,所以研究不同形状的斑块的流场分布对于预测斑块易损性有重要意义。人体斑块形状复杂,斑块狭窄程度和斑块长度都存在差别,不同斑块所处流场区别较大,所以如果能对动脉粥样硬化患者进行个体化研究将意义重大。
| [1] | Naghavi M, Libby P, Falk E, et al. From vulnerable plaque to vulnerable patient a call for new definitions and risk assessment strategies: part Ⅰ[J]. Circulation, 2003, 108(14): 1664-1672. DOI: 10.1161/01.CIR.0000087480.94275.97. |
| [2] | Cardoso L, Weinbaum S. Changing views of the biomechanics of vulnerable plaque rupture: a review[J]. Ann Biomed Eng, 2014, 42(2): 415-431. DOI: 10.1007/s10439-013-0855-x. |
| [3] | Chatzizisis YS, Antoniadis AP, Wentzel JJ, et al. Vulnerable plaque: The biomechanics of matter[J]. Atherosclerosis, 2014, 236(2): 351-352. DOI: 10.1016/j.atherosclerosis.2014.07.032. |
| [4] | Niu L, Qian M, Wan K, et al. Ultrasonic particle image velocimetry for improved flow gradient imaging: algorithms, methodology and validation[J]. Physics in Medicine and Biology, 2010, 55(7): 2103. DOI: 10.1088/0031-9155/55/7/020. |
| [5] | Chung TJ. Computational fluid dynamics[M]. Cambridge: Cambridge University Press, 2010: 24-29. |
| [6] | Viswanath N, Rodkiewicz CM, Zajac S. On the abdominal aortic aneurysms: pulsatile state considerations[J]. Med Eng Phys, 1997, 19(4): 343-351. DOI: 10.1016/S1350-4533(96)00064-1. |
| [7] | Hoganson DM, Hinkel CJ, Chen X, et al. Validation of computational fluid dynamics-based analysis to evaluate hemodynamic significance of access stenosis[J]. J Vasc Access, 2014, 15(5): 409-414. DOI: 10.5301/jva.5000226. |
| [8] | Tsang ACO, Lai SSM, Chung WC, et al. Blood flow in intracranial aneurysms treated with Pipeline embolization devices: computational simulation and verification with Doppler ultrasonography on phantom models[J]. Ultrasonography, 2015, 34(2): 98. DOI: 10.14366/usg.14063. |
 2017, Vol. 38
2017, Vol. 38

