迄今为止,子痫前期仍是造成孕产妇和围产儿死亡的三种主要因素之一[1]。据世界卫生组织统计,世界各地的子痫前期发生率为0.51%-18.4%[2]。子痫前期分为早发型(< 34周)和晚发型(≥34周),其中晚发型占主要部分[3]。子痫前期的具体发生机制至今尚未完全阐明。Guerby等认为氧化应激在子痫前期的病理生理学发病机制中起重要作用[4]。有证据显示子痫前期患者超氧化物形成增加、过氧化脂质产生增加,并且蛋白质和DNA氧化增加[5]。谷胱甘肽过氧化物酶(glutathione peroxidase, GPx)作为一个内源性抗氧化剂,通过防止脂质过氧化作用和氧化损伤,在氧化应激有毒产物的新陈代谢中起着重要作用[6]。高水平GPx在子痫前期可能作为防止过度氧化应激的补偿机制[7]。硒是GPx的酶活性中心的构成部分,其含量改变可通过改变GPx的酶活性而影响机体氧化应激状态[7]。关于硒和GPx在重度子痫前期中作用的研究并不多,而且研究结果存在差异。本研究的目的是进一步探讨晚发型重度子痫前期孕妇血液中硒和GPx含量变化情况,确定其水平与疾病的关系。
1 对象与方法 1.1 研究对象选取2016年1月-2017年9月间于南方医科大学深圳医院收治的妊娠时间≥34周的孕妇作为研究对象。重度子痫前期孕妇诊断依据为《妊娠期高血压疾病诊断指南(2015)》[3],具体为:高血压≥160/110 mmHg和蛋白尿≥300 mg/dl共计收集73例,定义为观察组。同时收集2016年1月-2017年9月间于南方医科大学深圳医院73例正常孕检的妊娠时间≥34周的孕妇为对照组。两组排除标准:①胎膜早破的孕产妇;②溶血肝酶升高低血小板(hemolysis elevated liver enzyme low platelet, HELLP)综合征的孕产妇;③惊厥孕产妇;④有吸烟史的孕产妇。本研究经医院伦理委员会批准,所有受试者由本人或监护人员在研究开始前签署知情同意书。
1.2 方法 1.2.1 样本采集所有研究对象孕检当天清晨抽取外周静脉血2 ml,促凝后4 ℃、3 000 r/min,离心半径5.5 cm,离心10 min,分离血清并-80 ℃保存,待行血清学检测。
1.2.2 临床资料收集对所有研究对象进行体格检查。收集所有研究对象详细人口学资料,包括年龄、孕期体重变化情况、身体质量指数(body mass index, BMI)、孕次、既往病史和近期并发症等。
1.2.3 血清学检测血清中硒含量的检测使用北京东西电子技术公司AA7003型原子吸收光谱仪进行检测,检测方法为火焰原子吸收法。血清中GPx含量的检测使用罗氏Cobas Mira光谱仪进行检测,检测方法为分光光度法。
1.3 统计学分析采用SPSS 17.0统计软件进行数据分析。符合正态分布的计量资料以均数±标准差表示,组间比较采用t检验;非正态分布的计量资料以中位数(极小值-极大值)表示,组间比较采用Mann-Whitney检验。计数资料以百分比表示,组间比较采用χ2检验。使用受试者工作特征曲线(receiver operating characteristic curve, ROC曲线)判定硒和GPx水平在区分正常孕产妇和重度子痫前期孕产妇中的截断值。以P<0.05为差异有统计学意义。
2 结果 2.1 一般资料本研究共选择73例重度子痫前期孕妇和73例正常妊娠孕妇。观察组年龄为33(18-39)岁,对照组为31(19-37)岁,观察组年龄高于对照组,但差异无统计学意义(P=0.21)。重度子痫前期孕妇在怀孕期间体重增加情况与正常妊娠组相似。观察组BMI为24.2(23-28) kg/m2,稍高于对照组22.9(22-26) kg/m2,P=0.08。重度子痫前期组血红蛋白(Hb)水平与正常妊娠组相似,晚发性重度子痫前期患者部分终止孕周偏早,但两组妊娠周期无显著性差异。两组之间孕次明显不同,具体结果见表 1。
| 表 1 两组研究对象基本情况 |
进一步分析两组孕妇血清中硒和GPx水平,检测结果观察组硒水平为21.6(11.3-105.2) μg/L,显著低于正常孕妇96.2(19.7-155.6) μg/L (P<0.001);观察组GPx含量为6.11(0.13-335.72) mU/ml,与对照组[303.81(8.65-591.80) mU/ml]相比显著降低(P<0.001)。
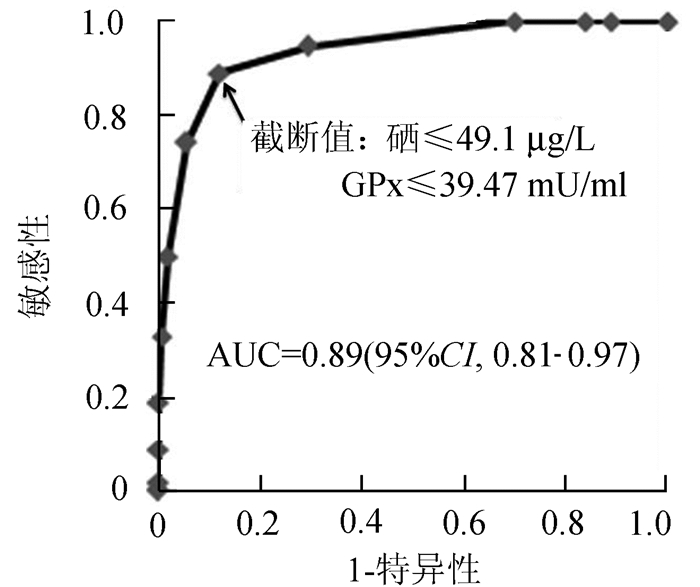
ROC曲线分析结果(图 1)显示以硒≤49.1 μg/L、GPx≤39.47 mU/ml为截断值判定孕妇发生晚发型重度子痫前期的敏感性为77.8%,特异性为91.7%,准确性为84.7%,阳性预测值90.3%,阴性预测值为80.5%,曲线下面积(area under curve, AUC)达0.89(95%CI,0.81-0.97)。表 2显示了约83.6%重度子痫前期患者硒≤49.1 μg/L、GPx≤39.47 mU/ml,而约94.5%正常妊娠组硒>49.1 μg/L、GPx>39.47 mU/ml。
|
图 1 两组研究对象血清硒和GPx含量ROC分析结果 |
| 表 2 两组研究对象血清硒和GPx截断值对比结果 |
子痫前期是妊娠期特有的病因不明的严重并发症,导致孕产妇和围产儿死亡率升高[1, 2]。孕周是决定子痫前期患者母婴预后的主要因素,晚发型预后比早发型较好。目前的研究显示重度子痫前期可能与某些遗传因素和凝血因素有关,早发型和晚发型重度子痫前期病因与发病机制有区别。目前认为子痫前期的可能发病机制为多种因素引起的滋养层细胞侵袭能力差致使胎盘着床浅,造成胎盘缺血缺氧,出现氧化应激状态,引发脂质过氧化,毒性物质释放增加,最终造成血管内皮细胞损伤或激活而出现多种临床症状[8]。许多研究报告评价孕妇年龄和孕次对子痫前期的影响。本研究结果显示晚发型重度子痫前期孕妇平均年龄高于正常孕妇,且患有晚发型重度子痫前期的孕妇多为经产妇(P=0.03)。Jasovic-Siveska等研究表示重度子痫前期的发生率呈双峰分布:小于20岁的初孕妇重度子痫前期发病率较高,另外大于35岁的再产孕妇重度子痫前期发病率较高[9]。本研究中,重度子痫前期组BMI略高于正常孕妇(P=0.03)。高BMI参与胰岛素抵抗,也是的重度子痫前期的一个主要风险因素[10]。
GPx是机体抗氧化防御系统的主要组成部分,硒则是GPx的活性中心。GPx通过还原脂质过氧化物,参与防止体内脂质过氧化作用及自由基对细胞的破坏,以保持生物膜完整性[4]。本研究结果显示晚发型重度子痫前期孕妇血清GPx水平显著低于正常怀孕,这与之前的研究一致[11]。妊娠期氧化应激底物增加,抗氧化剂和抗氧化系统也增加,是对氧压升高及再灌注氧化应激的保护性反应,子痫前期发生时此平衡状态被打破,胎盘来源的循环因子导致氧化应激发生,脂质过氧化和抗氧化失衡导致的GPx水平降低增加自由基释放,进而引起内皮功能障碍和细胞损伤。此状态可能导致孕产妇炎症反应过度,发生血栓性闭塞,导致慢性缺氧和孕期胎盘再氧化缺乏,引发严重的并发症[12, 13]。本研究结果观察组硒含量显著低于对照组[21.6(11.3-105.2) μg/L vs 96.2(19.7-155.6) μg/L, P<0.001],显著低于正常孕妇(P<0.001);妊娠时血容量增加,同时机体内硒重新分布,会使硒浓度降低,另一方面子痫前期孕产妇体内脂类过氧化物产生升高,也会导致硒含量降低[7]。本研究结果还显示GPx含量显著低于对照组[6.11(0.13-335.72) mU/ml vs 303.81(8.65-591.80) mU/ml, P<0.001]。ROC曲线分析结果显示以硒≤49.1 μg/L、GPx≤39.47 mU/ml为截断值判定孕妇发生晚发型重度子痫前期的敏感性、特异性、准确性、阳/阴性预测值和AUC均达到较高水平,提示产妇血清GPx水平可作为判断重度子痫前期的潜在生物学标志物,有助于疾病的辅助诊断。
本研究选择的对象以预后较好的晚发型重度子痫前期孕妇为研究对象,尚不清楚这些发现是否适用于其他类型重度子痫前期及临床上其他妊娠综合征。后续研究还需进一步评估低水平GPx在子痫前期中的诊断价值,并分析妊娠早期检测血清中GPx含量是否能有效监测和预防重度子痫前期的发生。
| [1] | Dhariwal NK, Lynde GC. Update in the management of patients with preeclampsia[J]. Anesthesiology Clinics, 2017, 35(1): 95-106. DOI: 10.1016/j.anclin.2016.09.009. |
| [2] | Hofmeyr R, Matjila M, Dyer R. Preeclampsia in 2017: obstetric and anaesthesia management[J]. Best Practice & Research Clinical Anaesthesiology, 2016, 31(1): 125-138. |
| [3] |
中华医学会妇产科学分会妊娠期高血压疾病学组. 妊娠期高血压疾病诊治指南(2015)[J].
中华产科急救电子杂志, 2015, 4(4): 206-213.
The group of Chinese medical association branch of obstetrics and gynaecology gestational hypertension disease. The diagnosis and treatment guidelines of gestational hypertension disease[J]. Chin J Obstet Emerg(Electronic Edition), 2015, 4(4): 206-213. |
| [4] | Guerby P, Vidal F, Garobysalom S, et al. Oxidative stress and preeclampsia: A review[J]. Gynecologie Obstetrique & Fertilite, 2015, 43(11): 751-756. |
| [5] | Hansson SR, Nääv Å, Erlandsson L. Oxidative stress in preeclampsia and the role of free fetal hemoglobin[J]. Frontiers in Physiology, 2015, 5: 516. |
| [6] |
马森. 谷胱甘肽过氧化物酶和谷胱甘肽转硫酶研究进展[J].
动物医学进展, 2008, 29(10): 53-56.
Ma S. Review of glutathione peroxidase and glutathione turn sulfur enzyme[J]. Progress in Veterinary Medicine, 2008, 29(10): 53-56. DOI: 10.3969/j.issn.1007-5038.2008.10.015. |
| [7] |
吴春春, 胡继芬. 硒与谷胱甘肽过氧化物酶的关系及其在子痫前期中的作用[J].
医学综述, 2008, 14(2): 280-282.
Wu CC, Hu JF. The relationship between selenium concentration and glutathione peroxidase in preeclampsia[J]. Medical Recapitulate, 2008, 14(2): 280-282. DOI: 10.3969/j.issn.1006-2084.2008.02.051. |
| [8] |
钱卫, 周倩, 刘憬兰, 等. 早发型与晚发型重度子痫前期的临床表现及母婴结局的对比分析[J].
现代生物医学进展, 2011, 11(13): 2 461-2 463.
Qian W, Zhou Q, Liu JL, et al. Comparative analysis of clinical manifestations and maternal and neonatal outcomes of pregnant women with early- and late-onset severe pre-eclampsia[J]. Progress in Modern Biomedicine, 2011, 11(13): 2 461-2 463. |
| [9] | Jasovic-Siveska E, Jasovic V, Stoilova S. Previous pregnancy history, parity, maternal age and risk of pregnancy induced hypertension[J]. Bratislavské Lekárske Listy, 2011, 112(4): 188-191. |
| [10] | Anderson NH, Mccowan L, Fyfe EM, et al. The impact of maternal body mass index on the phenotype of pre-eclampsia: a prospective cohort study[J]. BJOG, 2012, 119(5): 589-595. DOI: 10.1111/j.1471-0528.2012.03278.x. |
| [11] | Peng X, Lin Y, Li J, et al. Evaluation of glutathione peroxidase 4 role in preeclampsia[J]. Scientific Reports, 2016, 6: 33 300. DOI: 10.1038/srep33300. |
| [12] | Mistry HD, Wilson V, Ramsay MM, et al. Reduced selenium concentrations and glutathione peroxidase activity in preeclamptic pregnancies[J]. Hypertension, 2008, 52(5): 881-888. DOI: 10.1161/HYPERTENSIONAHA.108.116103. |
| [13] | Sánchez-Aranguren LC, Prada CE, Riaño-Medina CE, et al. Endothelial dysfunction and preeclampsia: role of oxidative stress[J]. Front Physiol, 2014, 5: 372. |
 2018, Vol. 39
2018, Vol. 39

