2. 中南大学湘雅三医院/卫生部移植医学工程技术研究中心 湖南 长沙 410013
2. The 3rd Xiangya Hospital of Central South University, & Research Center of National Health Ministry on Transplantation Medicine Engineering and Technology, Changsha 410013, China
肝移植已成为治疗终末期肝病的唯一有效手段,供体的缺乏制约了肝移植的发展。从2015年1月1日起,我国全面停止使用死囚器官作为移植供体来源,公民逝世后自愿器官捐献(Chinese donation after citizen’s death, CDCD)已成为器官移植使用的主要来源[1]。目前,国际上死亡供体主要分为脑死亡后器官捐献(donation after brain death, DBD)供体及心脏死亡后器官捐献(donation after cardiac death, DCD)供体两类,脑死亡供体是指各种原因导致的包括脑干在内全脑功能完全不可逆损伤的死亡供体;心脏死亡是指各种原因导致的不可逆性心脏停跳后的死亡供体。国内外均已有多项研究证实,DBD供体器官移植的近期及远期预后均要优于DCD供体[2, 3],然而与活体供体器官移植相比,DBD供体器官移植预后明显不佳,移植器官生存率较低,术后并发症发生率较高[4, 5]。关于脑死亡时器官功能损伤的因素目前并未十分清楚,机体处于脑死亡状态时,会出现广泛的病理生理改变及激素水平变化,对器官功能造成损伤,并最终影响到移植预后。为此,我们采用颅骨钻孔置管颅内加压的方式建立了大鼠脑死亡动物模型,取脑死亡后6 h的肝脏标本通过TUNEL检测了肝细胞的凋亡情况,同时通过检测内质网应激及蛋白磷酸酯酶2A(protein phosphatase 2A, PP2A)的活化情况,初步探讨了脑死亡时内质网应激对供肝质量的影响及其机制。
1 材料与方法 1.1 实验材料 1.1.1 实验动物SPF级SD雄性大鼠,体重(300±20) g,购于湖北省实验动物中心,于武汉大学实验动物中心/ABSL-Ⅲ实验室适应性喂养1周,12 h昼夜交替光照,自由摄取食水。研究人员取得湖北省实验动物专业技术考试合格证,实验动物的饲养及管理严格遵循《湖北省实验动物管理条例》及相关规定。动物的管理及人文关怀均按照1998年中华人民共和国国家科学技术委员会颁布的《实验动物管理条例》及1996年美国国家科学院制定的《实验动物关怀及应用指南》执行。
1.1.2 仪器及试剂牙钻(齿科器械厂)、Fogarty3F球囊导管(美国爱德华公司)、PE50导管(美国爱德华公司)、微电脑输液泵(浙江大学医学仪器厂)、显微外科手术器械(宁波医用缝针有限公司)、BL-420生物机能监测系统、肛温监测仪及加热板、大鼠用气管插管、小动物呼吸机均购自成都泰盟生物科技有限公司。内质网应激标志蛋白抗体(Grp78、ATF6) 购自Abcam公司;蛋白磷酸酯酶2A (PP2A)抗体购自Abcam公司;动物组织总蛋白提取试剂盒(RIPA裂解液)、蛋白浓度测定试剂盒[二喹啉甲酸(BCA)]及十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)配制试剂盒购自碧云天公司。
1.2 实验分组及模型制备采用随机数字表法将30只野生型健康雄性SD大鼠随机分为3组(n=10):假手术组(S组)、脑死亡组(BD组)及内质网应激抑制剂组(PBA组)。所有大鼠在模型制备前禁食水12 h。S组大鼠麻醉后仅行颅骨钻孔置管、股动脉及股静脉穿刺置管、气管插管,但不行颅内加压,维持麻醉6 h后取肝脏标本作为对照组;BD组大鼠于麻醉后行颅骨钻孔置管、股动脉及股静脉穿刺置管、气管插管后采用渐进式颅内加压法制备脑死亡大鼠模型,根据2003年卫生部脑死亡判定组起草制定的《脑死亡判定标准》和《脑死亡判定技术规范》,拟定脑死亡大鼠判定标准为:① 脑电图消失;② 深昏迷;③ 瞳孔对光反射及角膜反射消失;④ 自主呼吸停止;⑤ 维持30 min以上无变化;在脑死亡维持期间借助小动物呼吸机辅助呼吸,采用肛温探测器及加热板维持体温,保持脑死亡状态6 h后取肝脏标本;PBA组大鼠在脑死亡模型建立的同时采用腹腔注射的方式给予内质网应激抑制剂4-PBA,在维持脑死亡6 h后取肝脏标本。
1.3 TUNEL检测分别取各组肝脏甲醛固定标本制作石蜡切片,按试剂盒说明书充分脱蜡并洗去二甲苯及酒精后,滴加20 μg/ml的蛋白酶K工作液于室温下孵育20 min进行酶修复,之后用破膜工作液室温孵育20 min,用PBS漂洗干净后滴加TUNEL试剂盒中试剂1(TdT)及试剂2(dUTP)适量按1:29比例混合配置成TUNEL工作混合液,室温下避光孵育60 min,漂洗后滴加DAPI热色剂室温避光孵育10 min,于荧光显微镜下观察,绿色荧光为凋亡阳性结果。
1.4 Western Blot检测分别取各组家兔肝脏冻存标本,按说明书配制预冷的蛋白裂解液,将肝脏组织置于匀浆器中充分匀浆,12 000 r/min,4 ℃离心15 min,取上清。按说明书操作以BCA法测定蛋白浓度。按说明书使用SDS-PAGE试剂盒配制10%分离胶及5%浓缩胶,蛋白样品与上样缓冲液充分混合煮沸变性后上样电泳,采用120 V恒压电泳至溴酚蓝接近凝胶底部后取出凝胶,按蛋白Marker条带标记切除目的蛋白分子量的胶块,制作转膜三明治,以276 mA恒流转膜90 min至聚偏二氟乙烯膜(PVDF)膜上,Tris-HCl缓冲液(TBST)漂洗后5%脱脂牛奶室温封闭2 h;TBST漂洗后4 ℃一抗孵育过夜;次日TBST漂洗后以辣根过氧化物酶标记的二抗孵育2 h,增强型化学发光试剂(ECL)显色。每次实验均以β-actin为内参,重复3次校正。
1.5 PP2A活性检测取各组肝脏冻存标本500 mg,用GENMED清理液(Reagent A)振荡清洗后迅速研磨成粉末状,研磨完毕后加入预冷的GENMED裂解液(Reagent B)500 μl,混匀后用移液器将组织混悬液转移至1.5 ml EP管中,涡旋震荡孵育后于低温高速离心机中采用4 ℃,16 000 g离心5 min,取10 μl上清液测定各组蛋白浓度,剩余上清液保存于-80 ℃中备用。按说明书测定绘制磷浓度测定标准曲线,取出待测蛋白样品加入比色皿中,加入100 μl GENMED缓冲液(Reagent C)于比色皿中,向缓冲液中分别各加入每组待测蛋白样品20 μl,向各比色皿中分别加入20 μl GENMED反应液(Reagent E),30 ℃下孵育20 min,30 ℃下孵育20 min,之后向各组中分别加入60 μl GENMED阴性液(Reagent D)及200 μl GENMED显色液(Reagent F),轻柔震荡混匀后室温下避光孵育10 min,孵育完毕后将各组比色皿置于分光光度计,在30 ℃,660 nm条件下测定各组吸光度值,根据标准曲线计算获得各组样品总活性对应的磷浓度。
1.6 统计学分析所有实验数据均采用GraphPad Prism 6.0统计学软件进行数据分析,符合正态分布的计量资料均采用均数±标准差表示,多组间的比较采用单因素方差分析(One-way ANNOVA),两两均数比较采用q检验。P<0.05表示差异,具有统计学意义。
2 结果 2.1 肝脏标本凋亡染色三组肝脏采用TUNEL方法检测细胞凋亡率,结果如表 1,三组间差异均有统计学意义(P<0.05), 提示脑死亡促进了大鼠细胞的凋亡,而4-PBA的应用改善了肝细胞凋亡情况。
| 表 1 肝脏细胞凋亡情况检测结果(x±s, %) |
|
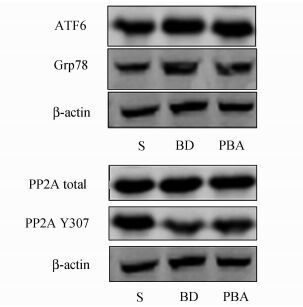
图 1 内质网应激标志蛋白及PP2A表达情况 |
采用Western Blot检测三组大鼠肝脏标本内质网应激标志蛋白活化程度(表 2)及PP2A表达情况(表 3),结果如下。分析结果显示,与对照组(S组)相比,脑死亡时(BD组)内质网应激标志蛋白Grp78及ATF6表达明显升高,4-PBA的应用明显(PBA组)抑制了内质网应激的活化,三组之间的差异均有统计学意义(P<0.05)。同时,PP2A的表达量检测显示三组大鼠肝脏中PP2A的总表达量无明显变化,而磷酸化的PP2A(PP2A Y307) 在脑死亡时明显降低,抑制内质网应激在一定程度上改善了磷酸化PP2A的表达程度。
| 表 2 内质网应激活化水平检测 |
| 表 3 PP2A总量及磷酸化形式表达程度检测 |
采用活性比色法检测各组大鼠肝脏PP2A总活性。结果如表 2,分析显示脑死亡时PP2A活性均较假手术组明显升高,而抑制内质网应激后其活性下降,S组、BD组、PBA组PP2A活性分别为1.92±0.35,4.11±0.48,2.76±0.24 nmol /(mg·min),三组之间的差异均有统计学意义(P<0.05)。
3 讨论肝移植是治疗终末期肝病的唯一有效手段,供体的缺乏促使了脑死亡供体的广泛应用,然而与活体供肝相比,脑死亡供肝预后欠佳,其机制未明。为了探讨脑死亡供肝质量欠佳的原因,我们建立了大鼠脑死亡模型,取供肝标本进行相关检测,初步揭示了脑死亡时供肝损伤可能与内质网应激活化有关。
内质网是细胞中非常重要的细胞器,在细胞中蛋白质的正确折叠及合成过程中起到重要作用,细胞内大约三分之一的蛋白质是在内质网内合成的。许多病理条件会影响内质网功能,导致未折叠蛋白或错误折叠蛋白在内质网内堆积,损伤内质网正常结构,产生内质网应激。
葡萄糖调节蛋白78(glucose regulated protein 78, Grp 78) 又称为免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein, Bip),属于HSP70家族成员蛋白之一[6]。Grp78主要存在于内质网内,在多种生理过程中起作用,在生理条件下可作为分子伴侣的一种与多种蛋白质分子或内质网内钙离子结合,参与正常蛋白质的折叠和运输;同时Grp78也是一种应激蛋白,在内质网应激发生时介导多种病理过程,是内质网应激的一种标志蛋白[7]。同时,目前有许多关于ATF6的研究发现ATF6通路在内质网应激过程中主要起到调节细胞对外界刺激适应性的功能。ATF6在细胞内的存在形式是内质网膜上一种跨膜蛋白,当外部因素引起错误折叠蛋白在内质网内堆积,超过内质网本身的蛋白质处理能力时,ATF6识别到错误蛋白的堆积就会转位至高尔基体,高尔基体酶可将ATF6分子剪切为50 kU分子质量的片段,释放到细胞质内,细胞质内的50 kU分子质量的ATF6蛋白分子片段转移至细胞核内与细胞核内的ATF6应答基因结合从而发挥作用,因此ATF6是内质网应激的一种标志性蛋白。在非内质网应激状态时,Grp78分子与细胞内ATP结合,以非活性形式存在,而当外部因素诱发内质网应激时,可激活ATF6,活化的ATF6从细胞膜水解下来,进入细胞核内,核型的ATF6和XBP1可靶向激活Grp78的基因转录过程,上调Grp78的表达[8]。
PP2A是真核细胞中一种重要的丝/苏氨酸蛋白磷酸酯酶,占细胞蛋白总量的1%。研究发现,PP2A经典的磷酸化位点酪氨酸307位点及亮氨酸309位点均位于催化亚基C上,PP2A的抑制剂冈田酸(OA)能使PP2A上的酪氨酸307位点(PP2A-Yp307) 的磷酸化增强,使得PP2A活性明显降低,可见磷酸化位点是PP2A的失活位点。
目前已有许多研究发现了在多种病理生理条件下内质网应激与PP2A的活化在致细胞损伤过程中的相互作用[9-11],有研究显示在某些病理状态下氧化应激和内质网应激会同时发生,且两者间可能存在某些联系[12, 13]。研究发现氧化应激可通过抑制内质网膜上的Ca2+-ATP酶[14]、内质网内Ca2+储量的耗竭诱发内质网应激[15],或通过扰乱内质网内蛋白折叠酶及分子伴侣的功能导致错误折叠蛋白在内质网内堆积导致内质网应激的发生[16]。有研究发现在肝细胞处于氧化应激状态时,内质网应激的活化会使神经酰胺表达增加[17],在酒精性肝纤维化的动物模型中同样检测到了内质网应激的活化及神经酰胺表达量的升高同时伴有PP2A的活化[18]。
为了探究脑死亡状态时内质网应激的活化及PP2A的活性升高在供肝细胞损伤中的作用关系,本实验通过查阅文献,利用健康成年雄性SD大鼠成功建立了大鼠脑死亡模型,于脑死亡6 h时获取供肝组织标本进行检测。研究结果显示,脑死亡大鼠供肝组织中PP2A的活性明显升高,说明脑死亡状态时供肝细胞凋亡可能与PP2A的活化有关。后续Western Blot检测发现脑死亡时大鼠肝脏组织内内质网应激活化程度明显增强,因此我们猜测,脑死亡会导致供肝细胞内质网应激的活化,进而通过某种方式活化PP2A,Western Blot检测显示PP2A的总表达量并未明显增加,而脑死亡时PP2A的磷酸化形式PP2A Y307表达量明显受到抑制,PP2A的磷酸化形式是一种失活形式,因此PP2A活性会明显上升,导致供肝细胞凋亡,影响肝脏功能,并最终影响移植预后。为了进一步证明猜想,本实验在后续工作中应用了内质网应激抑制剂4-PBA来抑制脑死亡时大鼠肝脏组织内的内质网应激活化程度,应用后再次获取肝脏标本检测内质网应激标志蛋白及PP2A的活化情况,研究发现PBA的应用能明显降低肝脏细胞凋亡率,且脑死亡大鼠肝脏组织内质网应激活化程度明显降低,同时相比脑死亡组,PBA组PP2A磷酸化程度升高,而与假手术组相比,PBA的应用仍造成了明显的细胞凋亡,且内质网应激的活化增强仍有统计学意义,PP2A的磷酸化水平仍出现了明显降低,结果说明脑死亡时内质网应激活化后会通过抑制PP2A磷酸化水平提高PP2A的活性,造成肝脏细胞的凋亡,而内质网应激抑制剂PBA的应用虽然可以抑制内质网应激的活化,对供肝起到一定的保护作用,而并不能逆转脑死亡造成的肝脏损伤。
| [1] | Huang J, Millis JM, Mao Y, et al. Voluntary organ donation system adapted to Chinese cultural values and social reality[J]. Liver Transpl, 2014, 21(4): 419-422. |
| [2] | Monbaliu D, Pirenne J, Talbot D. Liver transplantation using donation after cardiac death donors[J]. J Hepatol, 2015, 56(2): 474-485. |
| [3] | Levesque E, Hoti E, Khalfallah M, et al. Impact of reversible cardiac arrest in the brain-dead organ donor on the outcome of adult liver transplantation[J]. Liver Transpl, 2011, 17(10): 1159-1166. DOI: 10.1002/lt.v17.10. |
| [4] | Weiss S, Kotsch K, Francuski M, et al. Brain death activates donor organs and is associated with a worse I/R injury after liver transplantation[J]. Am J Transplant, 2007, 7(6): 1584-1593. DOI: 10.1111/ajt.2007.7.issue-6. |
| [5] | Lu TF, Hua XW, Cui XL, et al. Liver transplantation for hepatocellular carcinoma: recent advances in China[J]. J Dig Dis, 2014, 15(2): 51-53. DOI: 10.1111/cdd.2014.15.issue-2. |
| [6] | Rose MD, Misra LM, Vogel JP. KAR2, a karyogamy gene, is the yeast homolog of the mammalian Bip/Grp78 gene[J]. Cell, 1989, 57(7): 1211-1221. DOI: 10.1016/0092-8674(89)90058-5. |
| [7] | Zhang Y, Liu R, Ni M, et al. Cell surface relocalization of the endoplasmic reticulum chaperone and unfolded protein response regulator Grp78/Bip[J]. J Biol Chem, 2010, 285(20): 15065-15075. DOI: 10.1074/jbc.M109.087445. |
| [8] | Shuda M, Kondoh N, Imazeki N, et al. Activation of the ATF6, XBP1 and Grp78 genes in human hepatocellular carcinoma: a possible involvement of the ER stress pathway in hepatocarcinogenesis[J]. Hepatology, 2003, 38(5): 604-614. |
| [9] | Naing C, Mak JW, Wai N, et al. Diabetes and infections-hepatitis C: is there type 2 diabetes excess in hepatitis C infection[J]. Curr Diab Rep, 2013, 13(3): 428-434. DOI: 10.1007/s11892-013-0370-3. |
| [10] | Tersey SA, Nishiki Y, Templin AT, et al. Islet β-cell endoplasmic reticulum stress precedes the onset of type 1 diabetes in the nonobese diabetic mouse model[J]. Diabetes, 2012, 61(4): 818-827. DOI: 10.2337/db11-1293. |
| [11] | Lenin R, Sankaramoorthy A, Mohan V, et al. Altered immunometabolism at the interface of increased endoplasmic reticulum (ER) stress in patients with type 2 diabetes[J]. J Leukoc Biol, 2015, 98(4): 615-622. DOI: 10.1189/jlb.3A1214-609R. |
| [12] | Yokouchi M, Hiramatsu N, Hayakawa K, et al. Involvement of selective reactive oxygen species up stream of proapoptotic branches of unfolded protein response[J]. J Biol Chem, 2008, 283(7): 4252-4260. DOI: 10.1074/jbc.M705951200. |
| [13] | Tagawa Y, Hiramatsu N, Kasai A, et al. Induction of apoptosis by cigarette smoke via ROS-dependent endoplasmic reticulum stress and CCAAT/enhancer-binding protein-homologous protein(CHOP)[J]. Free Radic Biol Med, 2008, 45(1): 50-59. DOI: 10.1016/j.freeradbiomed.2008.03.003. |
| [14] | Kaplan P, Babusikova E, Lehotsky J, et al. Free radical-induced protein modification and inhibition of Ca2+-ATPase of cardiac sarcoplasmic reticulum[J]. Mol Cell Biochem, 2003, 248(1-2): 41-47. |
| [15] | Viner RI, Hühmer AF, Bigelow DJ, et al. The oxidative inactivation of sarcoplasmic reticulum Ca2+-ATPase by peroxynitrite[J]. Free Radic Res, 1996, 24(4): 243-259. DOI: 10.3109/10715769609088022. |
| [16] | Brunet S, Thibault L, Lepage G, et al. Modulation of endoplasmic reticulum-bound cholesterol regulatory enzymes by iron/ascorbate-mediated lipid peroxidation[J]. Free Radic Biol Med, 2000, 28(1): 46-54. DOI: 10.1016/S0891-5849(99)00197-5. |
| [17] | Heinrich M, Wickel M, Schneider-Brachert W, et al. Cathepsin D targeted by acid sphingomyelinase-derived ceramide[J]. EMBO J, 1999, 18(19): 5252-5263. DOI: 10.1093/emboj/18.19.5252. |
| [18] | Yang L, Jin GH, Zhou JY. The role of ceramide in the pathogenesis of alcoholic liver disease[J]. Alcohol Alcohol, 2015, pii:agv119. |
 2017, Vol. 38
2017, Vol. 38


