2. 郑州大学第一附属医院心内科 河南 郑州 450052
2. Dept. of Cardiology, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China
蒽环类药物是目前临床上最常用的抗癌药之一,临床疗效确切,但心脏毒性是蒽环类药物最显著、最常见的副反应,可使患者发生心脏并发症。蒽环类药物可从多环节引起心脏损伤,阿霉素是蒽环类药物之一,临床上广泛用于恶性肿瘤、白血病等疾病治疗,但是由于其心脏毒副作用限制了其在临床领域中应用。通过应用有效心脏保护剂、有效监测心脏毒性,可减轻心脏毒性。右丙亚胺是目前临床上认可的唯一用于预防蒽环类药心脏毒性的药物,其可用作蒽环类药物治疗所致的心脏毒性的保护剂,可减少阿霉素引起的心脏毒性的发生率和严重程度,但其作用机制有待于进一步研究。虽然右丙亚胺具有心脏保护功能,但其不能消除蒽环类药物产生心脏毒性的潜力,因此必须密切监护心脏功能。本研究通过建立阿霉素致心脏毒性动物模型,观察右丙亚胺对于心脏毒性动物模型的保护作用,并探讨其对心脏的保护作用机制。
1 材料与方法 1.1 实验材料 1.1.1 实验动物SPF级Wistar大鼠,雌性,体重185.0-215.0 g,适龄、健康,共50只,购自北京维通利华实验动物技术有限公司。
1.1.2 实验药物注射用右丙亚胺(DEX)(购自江苏奥赛康药业有限公司),阿霉素(购自江苏奥赛康药业有限公司),丙二醛(MDA)、总超氧化物歧化酶(T-SOD)试剂盒均购自南京建成生物工程研究所,肌钙蛋白I (cTnI)试剂盒(购自上海源叶生物科技有限公司);HE染色试剂盒(购自北京益利精细化学品有限公司);其他试剂均为国内分析纯产品。
1.2 实验方法 1.2.1 实验动物分组及给药所有实验大鼠均给以常规饮食,在饲养1周后开始试验。按体重随机分为5组,每组10只,按每组5只饲养,每天观察大鼠的生长状态并随时记录。分组为:正常对照组:根据体重给予等量的生理盐水尾静脉注射。模型组:给予阿霉素2.5 mg/kg尾静脉注射,每周1次,连续6周,累积剂量为15 mg/kg。右丙亚胺低、中、高剂量组:均给予阿霉素2.5 mg/kg尾静脉注射,每周1次,连续6周,累积剂量为15 mg/kg,注射阿霉素前30 min尾静脉注射右丙亚胺,低、中、高剂量组分别为12.5 mg/kg,25 mg/kg,37.5 mg/kg。
1.2.2 血清MDA、SOD、cTnI水平的测定在实验进入第6周末各组处死动物,心腔取血,3 500 r/min离心15 min,取上清。按照ELISA试剂盒步骤测定MDA、SOD、cTnI水平。
1.2.3 大鼠心肌组织病理学检查在实验进入第6周末各组处死动物,采用颈椎脱臼法处死大鼠,迅速开胸取出心脏,PBS洗净血液后称重,然后置于4%甲醛溶液中固定。病理标本充分固定后,经脱水、常规石蜡包埋、病理切片(切片厚4 μm)、经苏木精-伊红(HE)染色,在高分辨率的光镜下观察大鼠左室壁心肌组织病变情况,并按照Billinghanl半定量标准,根据肌纤维缺失和空泡化形成的心肌细胞所占比例和严重程度评分(0-3分),如表 1。
| 表 1 大鼠左室壁心肌组织病变情况评分依据 |
采用SPSS 18.0统计软件进行分析,符合正态分布的计量资料用均数±标准差(x±s)表示,单因素方差分析,以P<0.05为差异有统计学意义。
2 结果 2.1 右丙亚胺对蒽环类药物引起的心脏毒性模型大鼠血清SOD水平的影响模型组在给药后逐渐出现精神变差,毛发轻度脱落、不光滑,饮食减少、活动缓慢,但无死亡出现,右丙亚胺各剂量组均有不同程度改善。由表 2可知,与正常对照组比较,模型组SOD水平显著降低,呈现显著性差异;与模型组比较,右丙亚胺各剂量组均有不同程度改善,SOD水平升高,其中右丙亚胺中、高剂量组具有统计学意义。
| 表 2 对蒽环类药物引起的心脏毒性模型大鼠血清(SOD)的影响(x±s) |
由表 3可知,与正常对照组比较,模型组大鼠的MDA水平显著增加,具有统计学意义;与模型组比较,右丙亚胺各剂量组大鼠的MDA值均有不同程度降低,其中右丙亚胺中、高剂量组具有统计学意义。
| 表 3 对蒽环类药物引起的心脏毒性模型大鼠血清MDA的影响(x±s) |
各组大鼠在给药6周后,取血清检测cTnI含量,与正常对照组比较,各组大鼠cTnI含量均不同程度增加,其中模型组大鼠与右丙亚胺低剂量组的cTnI表达呈现显著性差异;与模型组比较,右丙亚胺各剂量组大鼠的cTnI水平均出现不同程度降低,其中右丙亚胺中、高剂量组具有统计学意义。见表 4。
| 表 4 对蒽环类药物引起的心脏毒性模型大鼠血清cTnI的影响(x±s) |
于给药6周后,处死各组大鼠,取大鼠心脏置于4%甲醛溶液中固定,石蜡包埋后切片,HE染色,然后置于光镜下观察,模型组大多数心肌细胞出现不同程度的空泡变性与水肿,细胞间隙明显增宽,大量炎性细胞浸润;受累较重的心肌细胞溶解消失,呈片状坏死,可见继发性间质纤维化。右丙亚胺各剂量组可见灶性心肌细胞溶解,有不同程度的空泡变性与水肿,伴炎性细胞浸润,但病变程度较模型组明显减轻。具体见图 1。
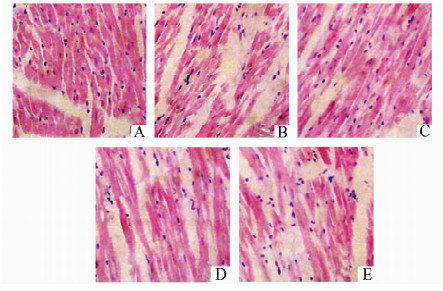
|
图 1 对蒽环类药物引起的心脏毒性模型大鼠心肌病理组织学改变的影响(HE×400) A:正常对照组,B:模型组,C:右丙亚胺低剂量组,D:右丙亚胺中剂量组,E:右丙亚胺高剂量组 |
阿霉素是一种抗肿瘤抗生素,可抑制RNA和DNA的合成,对RNA的抑制作用最强,抗瘤谱较广,对多种肿瘤均有作用,属周期非特异性药物[1-3]。阿霉素已广泛应用于治疗各种肿瘤,但其具有剂量依赖性心脏毒性。阿霉素的急性副作用包括恶心、呕吐和心律失常。当阿霉素的累积剂量达到550 mg/m2,副作用包括充血性心衰竭(CHF)、扩张型心肌病,甚至死亡的发生风险都显著提高。阿霉素心脏毒性的特点在于线粒体氧化磷酸化导致的剂量依存性下降,阿霉素和铁的相互作用产生的活性氧,可以破坏心肌,造成肌原纤维的损失和细胞质的液泡化[4, 5]。阿霉素导致的心肌损伤机制与其氧化应激以及细胞凋亡有关,右丙亚胺的水解产物可通过螯合铁,阻止ADM生成ROS,在临床已用于防治蒽环类心脏毒性。因此本研究通过建立阿霉素致心脏损伤大鼠模型,观察使用右丙亚胺治疗对于阿霉素致心肌损伤的保护作用及其作用机制。
超氧化物歧化酶(SOD)对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能清除超氧阴离子自由基,保护细胞免受损伤。机体通过酶系统与非酶系统产生氧自由基,后者能攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,并因此形成脂质过氧化物。脂质过氧化作用不仅把活性氧转化为活性化学剂,且通过链式或链式支链反应,放大活性氧的作用。氧自由基不但通过生物膜中多不饱和脂肪酸的过氧化作用引起细胞损伤,且能通过脂氢过氧化物的分解产物引起细胞损伤,测定丙二醛(MDA)可反映机体内脂质过氧化的程度,间接地反映出细胞损伤程度[6, 7]。SOD活力的高低间接反映了机体清除自由基的能力,MDA的高低间接反映了机体细胞受自由基攻击的严重程度,通过测定SOD和MDA的结果分析,有助于观察右丙亚胺对阿霉素所致心脏损伤的保护作用。研究结果表明,右丙亚胺通过升高血清SOD活性,降低MDA水平,抑制脂质过氧化作用,右丙亚胺可通过抗脂质过氧化损伤到达保护心脏作用。心肌肌钙蛋白I (cTnI)在心肌组织中表达,在胎儿、健康人或疾病状态的成人骨骼肌中不表达,因而对心肌具有高度特异性。由于cTnI对心肌梗死的敏感性及检测的高敏感性,使其在心脏疾病诊断与鉴别诊断中的作用越来越受到人们的重视[8, 9],本研究通过对cTnI的检测发现,阿霉素可使大鼠体内水平升高,应用右丙亚胺后大鼠血清cTnI水平有所降低。
病理组织学检查发现,模型组大多数心肌细胞出现不同程度的空泡变性与水肿,细胞间隙明显增宽,大量炎性细胞浸润;受累较重的心肌细胞溶解消失,呈片状坏死,可见继发性间质纤维化。右丙亚胺各剂量组可见灶性心肌细胞溶解,有不同程度的空泡变性与水肿,伴炎性细胞浸润,但病变程度较模型组明显减轻,右丙亚胺可在一定程度上减轻心肌细胞损伤。
本研究表明,右丙亚胺可减少氧自由基的产生,提高超氧化物歧化酶的活性,降低丙二醛水平,增强机体清除氧自由基能力,有效减轻阿霉素对于心脏的毒性作用。综上所述,右丙亚胺对蒽环类药物所致心脏毒性有一定的保护作用,其作用机制可能与降低脂质过氧化与减轻对于心肌细胞损伤有关。
| [1] | Broyl A, Jongen JL, Sonneveld P. General aspects and mechanisms of peripheral neuropathy associated with bortezomib in patients with newly diagnosed multiple myeloma[J]. Seminars in Hematology, 2012, 43(3): 249-257. |
| [2] |
赖仁纯, 王旭东, 罗广裕, 等. cTnT早期诊断蒽环类药物心脏毒性的实验研究[J].
中华肿瘤防治杂志, 2011, 18 (14): 55.
Lai RC, Wang XD, Luo GY, et al. cTnT as a marker for early detection for anthracycline-induced cardiotoxicity[J]. Chinese Journal of Cancer Prevention and Treatment, 2011, 18(14): 55. |
| [3] | Richardson PG, Delforge M, Beksac M, et al. Management of treatment-emergent peripheral neuropathy in multiple myeloma[J]. Leukemia, 2012, 26(4): 595-608. DOI: 10.1038/leu.2011.346. |
| [4] |
庞缨, 陈军初, 谢玮, 等. 右丙亚胺对柔红霉素所致心脏毒性的防治作用[J].
广东医学, 2011, 32 (6): 1606-1607.
Pang Y, Chen JC, Xie W, et al. Protective effect of dexrazoxane on daunorubicin cardiotoxicity[J]. Guangdong Medical Jorurnal, 2011, 32(6): 1606-1607. |
| [5] |
姜龙, 龙浩. 蒽环类抗肿瘤药物的心脏毒性及保护剂的研究进展[J].
中国肿瘤临床, 2011, 38 (16): 987-990.
Jiang L, Long H. Hot Issues in the Clinical Application of Protective Agents against Cardiac Toxicity Caused by Anthracyclines[J]. Chinese Journal of Clinical Oncology, 2011, 38(16): 987-990. |
| [6] |
杨鸿雁, 彭艳玲, 刘兴德. 维生素C对心肌缺血/再灌注家兔心功能和SOD、MDA的影响[J].
贵阳医学院学报, 2010, 35 (6): 555-557.
Yang HY, Peng YL, Liu XD. Effects of Vitamin C on Superoxide Dismutase and Malondialdehyde in Myocardium and Cardiac Function of Rabbits during Ischemia/Reperfusion[J]. Journal of Guiyang Medical College, 2010, 35(6): 555-557. |
| [7] |
车菲菲, 刘瑜, 徐才刚. 右丙亚胺对阿霉素引起的心脏毒性防治效果及其机制研究[J].
四川大学学报:医学版, 2010, 41 (1): 24-28.
Che FF, Liu Y, Xu CG. Schisandrin B Prevents Doxorubicin-induced Cardiotoxicity in Rabbits[J]. Journal of Sichuan University: Medical Science Edition, 2010, 41(1): 24-28. |
| [8] |
宁博, 杨朝群. 心肌肌钙蛋白T在放射性心肌损伤监测中的价值[J].
医学综述, 2011, 17 (5): 655-658.
Ning B, Yang ZC. The value of cardiac troponin T in the radiation monitoring of myocardial injury[J]. Medical Recapitulate, 2011, 17(5): 655-658. |
| [9] |
庄艳, 刘先领. 蒽环类药物心脏毒性及其预防措施[J].
肿瘤药学, 2011, 1 (4): 322-326.
Zhuang Y, Liu XL. Anthracycline cardiotoxicity and its preventive measures[J]. Anti-Tumor Pharmacy, 2011, 1(4): 322-326. |
 2016, Vol. 37
2016, Vol. 37

