阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA)是发病率较高的一类疾病。它严重威胁着公众的健康,增加了心血管疾病的发病率及死亡率。OSA导致心血管疾病的主要机制是慢性间断性缺氧(chronic intermittent hypoxia,CIH),即慢性间歇性的缺氧复氧 。CIH在心血管疾病的发生发展中起着关键作用。红景天苷具有抗辐射、抗缺氧、抗疲劳、抗衰老的功效,对缺血再灌注的心脏具有一定的保护作用。研究者发现,红景天苷能够抑制缺血再灌注下血管内皮细的凋亡[3]。那么,红景天苷对慢性间断性缺氧心肌细胞的凋亡是否具有抑制作用,其机制如何?还不清楚。
1 材料与方法 1.1 大鼠缺血再灌注模型的制备及分组SD大鼠(200-250 g,8周龄,雌雄不限)均来自武汉大学动物实验中心。 将SD大鼠分别放入慢性间断性缺氧动物仓中。动物仓内气体浓度由单片机程序控制,交换循环给予氮气和空气(21% O2),亦即将仓内充入氮气40 s,仓内的氧 浓度逐渐下降,至下降为4%-5%后则充入空气,仓内氧浓度又迅速恢复到21%,仓内氧气浓度由与计算机相连的氧浓度探测仪进行实时监控。依此循环,每天循环8 h(8∶00至16∶00),其余时间置大鼠于笼中饲养,正常室温、空气和饮食。连续间断缺氧4周或8周。为了标准化环境信号对动物的整合作用,实验前,大鼠置于反时相的人工光照(6∶00至18∶00时黑暗,18∶00至6∶00时光照)下饲养3 d,昼夜节律颠倒。实验中尽量保证大鼠处于安静状态,饮食自由,尽量减少不必要的应激反应。
将实验大鼠随机分为以下几组:①正常对照组(n=10):每日在相同的时间放置入相同规格的动物仓内,输入空气,无缺氧; ②NaCl组(CIH+ NaCl,n=10):慢性间断性缺氧8周,间隔(每周2次)腹腔注射0.9% NaCl 溶液。③红景天苷组(CIH+红景天苷,n=10):慢性间断性缺氧4或8周,间隔(每周2次)腹腔注射红景天苷 溶液。
1.2 大鼠心腔大小、心功能的测定检测大鼠的心功能:心脏超声多普勒测量大鼠的各腔室内径(LAD、RAD、LVD、RVD)。于乳头肌水平短轴,M型取样,测量左室射血分数(EF)、短轴缩短率(FS)、左心室舒张末容积(EDV) 和左心室收缩末容积(ESV)。
1.3 心肌细胞凋亡的检测提取大鼠的心室肌组织,用石蜡包埋,应用原位末端标记(TUNEL)法,检测凋亡心肌细胞。根据显示阳性的凋亡心肌细胞的分布情况,计算显示为阳性细胞所占的百分比,即为凋亡细胞的阳性指数。
1.4 心肌组织Bcl-2,Bax凋亡调节蛋白及caspase-3蛋白表达的检测提取心室肌组织,将100 mg心室肌组织放入1 ml 的RIPA裂解液,在冰上充分匀浆后,4 ℃下离心(12 000 g)20 min,取离心后的上清,Lowry法测定蛋白浓度,取50 μg的总蛋白上样并电泳,根据蛋白的不同分子量配制8%的聚丙烯酰胺(PAGE)胶电泳。据预染Marker的显示结果,判断目的蛋白,充分分离后,停止电泳。取出凝胶根据Marker切下的目的条带,用蒸馏水进行冲洗,剪出与聚偏二氟乙烯(PAGE)凝胶大小相同的PVDF膜及滤纸,用甲醇浸泡PVDF膜数秒,然后和滤纸一起浸泡在电转缓冲液中。转膜完成后,将PVDF膜置入含5% 脱脂奶粉的TBST(封闭液)中浸泡,室温下、摇床封闭2 h。封闭液稀释相对应的一抗,将PVDF膜浸泡在一抗(小鼠抗大鼠Bcl-2、Bax和caspase-3抗体,Santa Cruz公司)孵育液中,于4 ℃下孵育过夜。用TBST液体充分洗涤PVDF膜,后用封闭液稀释对应的二抗(辣根过氧化物酶标记抗小鼠IgG,KPL公司),稀释比1∶50 000,将PVDF膜浸泡在二抗孵育液中,室温下摇床孵育2 h。将PVDF膜用TBST充分洗涤5到6次。在每张膜上滴加适宜的增强化学发光(ECL)底物液,室温下孵育数分钟。等待荧光带明显后,再用滤纸吸去多余的底物液,并覆上保鲜膜,X光胶片压片,然后依次放入显影液中显影、定影液中定影。BandScan分析计算胶片的灰度值,用各组心肌细胞内β-actin的含量作为标准确定X光片上Bcl-2、Bax蛋白及caspase-3蛋白的相对含量。所用封闭液、ECL试剂均来自于KPL公司生产的Western Blot试剂盒。
1.5 心肌组织caspase-3活性的检测提取心室肌组织100 mg匀浆,离心,然后加入50 μl冷caspase-3裂解缓冲液中,冰浴10 min。4 ℃下离心15 000 g×3 min。上清液转管,取出样品加入50 μl 2×反应缓冲液 中,37 ℃温浴30 min,作为平衡操作对照,其余各管置于冰上,30 min后将其加入50 μl 2×反应缓冲液(含10 mmol/L DTT);每管均加入5 μl 1 mmol/L 的 Caspase-3底物(DEVD-pNA),在37 ℃下孵育1 h;然后将各管溶液转入96孔酶标板上,酶标仪上读取405 nm处的吸光度值。根据吸光度值在标准曲线上找到相应的值,以每分钟每毫克蛋白质产生的pNA摩尔质量表示caspase-3的酶活性。
1.7 数据处理和统计学分析数据均以均数±标准差 (x±s) 来表示,SPSS 13.0统计软件统计分析,组间的比较采用t检验及方差分析,P<0.05为差异具有统计学意义。
2 结果 2.1 红景天苷对慢性间断性缺氧大鼠心功能的影响干预后8周,与NaCl组比较,红景天苷组大鼠的心功能得到明显改善,见表 1。
| 表 1 红景天苷对大鼠心功能的影响 |
干预8周后,心肌组织均可见凋亡小体,红景天苷组缺氧心肌的凋亡小体明显减少(P<0.05),见图 1。

|
图 1 红景天对慢性间断性缺氧心肌细胞凋亡的影响 A:TUNEL检测心肌细胞凋亡(×400),正常心肌细胞核呈蓝色,凋亡细胞核呈深浅不一的棕红色颗粒状;B:凋亡心肌细胞量化分析。TUNEL阳性细胞占心肌细胞百分比,与NaCl组比较,*P<0.05 |
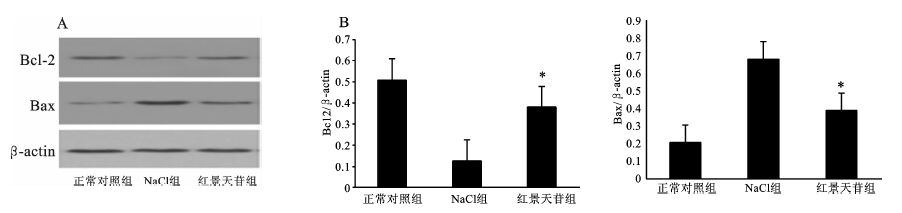
为明确红景天苷对抗心肌细胞凋亡的机制,我们分析了慢性间断性缺氧心肌细胞中调节凋亡蛋白Bcl-2及Bax的表达情况。干预8周后,NaCl组心肌组织凋亡蛋白Bcl-2的表达减少,蛋白Bax的表达增加,红景天苷组Bcl-2表达减少而Bax表达则增加,见图 2。提示红景天苷可能通过平衡Bcl-2和Bax的表达来调节细胞凋亡。
|
图 2 红景天苷对凋亡调节蛋白Bcl-2和Bax蛋白含量的影响 A: Bcl-2和Bax的Western Blot检测结果;B: Bcl-2和Bax对β-actin的相对表达量,与NaCl组比较,*P<0.05 |
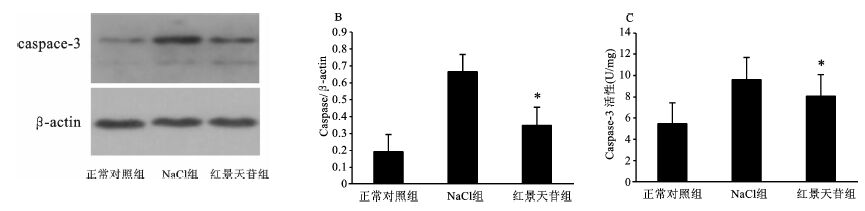
在细胞凋亡中,caspase-3激活裂解,最终致凋亡发生。为此,我们观察了CIH中心肌组织caspase-3的表达及活性情况。干预8周后,NaCl组心肌组织caspase-3的蛋白表达及活性增加,而红景天苷组caspase-3的蛋白表达及活性降低,见图 3。提示红景天苷可能通过抑制caspase-3的表达及活性来调节细胞凋亡。
|
图 3 红景天苷对caspase-3蛋白表达及活性的影响 A: caspase-3的Western Blot检测结果;B: caspase-3对β-actin的相对表达量;C:caspase-3的活性;与NaCl组比较,*P<0.05 |
阻塞性睡眠呼吸暂停(OSA)是发病率较高的一类疾病,严重威胁着公众健康。它增加了心血管疾病的发病率及死亡率。目前OSA致心血管疾病发生发展的机制仍未完全清楚,它包含许多病理生理触发机制,已有研究显示OSA导致心血管疾病的主要机制是慢性间断性缺氧(CIH)即慢性间歇性的缺氧复氧。CIH在心血管疾病的发生发展中起着关键作用 [4-6]。
红景天苷是一种类苯基丙烷糖苷,它通过抗氧化、抗氧自由基和诱导干细胞等而对各种细胞产生保护作用。已有研究显示红景天苷具有抗细胞凋亡作用[7],它的这种抗凋亡作用可能与其抗氧化、抗氧自由基以及一些还未研究清楚未知的机制有关。研究已经证实,给予脑挫伤的小鼠剂量20 mg/kg的红景天苷,能帮助减少神经元的死亡及凋亡,减轻脑水肿,进而减少脑的损伤,帮助脑功能的恢复。
我们在研究中观察到,慢性间断性缺氧4周,心肌细胞出现凋亡;间断缺氧8周,心肌细胞凋亡明显增加。所以我们选取慢性间断性缺氧8周作为观察的实验点。而给予20 mg/kg的红景天干预后,心肌细胞凋亡数目则明显减少。提示红景天可减少慢性间断性缺氧后心肌细胞的凋亡,因此,我们就其机制做了进一步研究。
Bcl-2和Bax是两种作用相反的凋亡调节基因的表达产物,它们共同作用于细胞凋亡的发生过程。Bcl-2具有抑制细胞凋亡的作用,而Bax则促进细胞凋亡 [8,9]。慢性间断性缺氧8周后,大鼠心肌细胞Bax的蛋白表达增加,Bcl的蛋白表达减少。
Caspase-3是白细胞介素-1β转换酶家族中一员。当细胞表面的死亡受体被激活时,凋亡过程启动,位于上游调控位置的caspase被激活,继而引发下游效应caspase-3水解激活,启动级联反应,最终导致细胞凋亡[10]。慢性间断性缺氧8周后,大鼠心肌组织caspase-3蛋白表达量及活性均增加,与NaCl组比较,红景天苷组caspase-3的表达减少,caspase-3的活性亦降低。
我们通过研究证实了红景天苷对慢性间断性缺氧心肌的保护作用:①慢性间断性缺氧8周后,大鼠心功能下降,红景天苷治疗则能改善心功能。②慢性间断性缺氧,大鼠心肌细胞出现凋亡,红景天苷通过调节凋亡调节蛋白的表达,抑制caspase-3 的活性而减少缺氧心肌细胞的凋亡。
综上所述,在慢性间断性缺氧即呼吸暂停动物模型中,红景天苷可改善心功能,并通过调节Bcl-2 /Bax的表达,抑制caspase-3的酶活性发挥其抗缺氧心肌细胞凋亡的作用。慢性间断性缺氧是各种心脏疾病发生的重要危险因素,红景天苷的干预,可能对睡眠呼吸暂停患者的心肌产生一定的保护作用。
| [1] | Lévy P, Ryan S, Oldenburg O, et al. Sleep apnoea and the heart[J]. Eur Respir Rev, 2013, 22(129): 333-352. DOI: 10.1183/09059180.00004513. |
| [2] | Han Q, Yeung SC, Ip MS, et al. Cellular mechanisms in intermittent hypoxia-induced cardiac damage in vivo[J]. J Physiol Biochem, 2014, 70(1): 201-213. DOI: 10.1007/s13105-013-0294-z. |
| [3] |
王小雄, 司瑞, 邵虹, 等. 红景天苷抑制缺血/再灌注诱导的心肌微血管内皮细胞凋亡[J].
中国心血管杂志, 2015, 20(1): 57-61.
Wang XX, Si R, Shao H, et al. Protective effects of Salidroside against cardiac microvascular endothelial cell injury induced by ischemia /reperfusion[J]. Chin J Cardiovasc Med, 2015, 20(1): 57-61. |
| [4] | Buja LM. The pathobiology of acute coronary syndromes:clinical implications and central role of the mitochondria[J]. Tex Heart Inst J, 2013, 40(3): 221-228. |
| [5] | Dumitrascu R, Heitmann J, Seeger W, et al. Obstructive sleep apnea, oxidative stress and cardiovascular disease: lessons from animal studies[J]. Oxid Med Cell Longev, 2013, 2013: 234631. |
| [6] | Aslan K, Deniz A, Cayli M, et al. Early left ventricular functional alterations in patients with obstructive sleep apnea syndrome[J]. Cardiol J, 2013, 20(5): 519-525. DOI: 10.5603/CJ.2013.0043. |
| [7] |
祁存芳, 张军峰, 陈新林, 等. 红景天苷通过抑制凋亡相关蛋白的表达保护缺氧对培养神经干细胞的损伤[J].
南方医科大学学报, 2013, 33(7): 962-966.
Qi CF, Zhang JF, Chen XL, et al. Salidroside protects cultured rat subventricular zone neural stem cells against hypoxia injury by inhibiting Bax,Bcl-2 and caspase-3 expressions[J]. J Southern Med Univ, 2013, 33(7): 962-966. |
| [8] | Archana M, Bastian, Yogesh TL, et al. Various methods available for detection of apoptotic cells-a review[J]. Indian J Cancer, 2013, 50(3): 274-283. DOI: 10.4103/0019-509X.118720. |
| [9] | Yamaguchi M. The anti-apoptotic effect of regucalcin is mediated through multisignaling pathways[J]. Apoptosis, 2013, 18(10): 1145-1153. DOI: 10.1007/s10495-013-0859-x. |
| [10] | Zhao M, Xia L, Chen GQ. Protein kinase cδ in apoptosis: a brief overview[J]. Arch Immunol Ther Exp (Warsz), 2012, 60(5): 361-372. DOI: 10.1007/s00005-012-0188-8. |
 2017, Vol. 38
2017, Vol. 38
