2. 中南大学湘雅三医院/卫生部移植医学工程技术研究中心 湖南 长沙 410013
2. The 3rd Xiangya Hospital of Central South University & Research Center of National Health Ministry on Transplantation Medicine Engineering and Technology, Changsha 410013, China
小肠移植的供体主要来源是脑死亡供体,对于肠功能衰竭的患者来说利用脑死亡供者提供器官进行小肠移植已成为有效治疗手段之一[1, 2]。但多项研究表明,脑死亡状态可诱发器官损伤失功[3],使供体不适合移植或肠功能失效。本课题拟建立稳定的兔脑死亡模型,研究家兔脑死亡状态下的一系列蛋白表达及检测血清中白细胞介素(interleukin, IL)-1β、IL-6和IL-8的水平变化。
1 材料与方法 1.1 材料 1.1.1 实验动物健康成年雄性家兔60只,12-15周龄,体质量(2.9±0.3) kg,购于武汉万千佳禾实验动物养殖中心,动物许可证号:SCXK(鄂)2007-0006,SPF级,饲养温度为20-25 ℃,湿度为50%-70%,标准饮食。
1.1.2 试剂与仪器HX-100E动物呼吸机、BL-420生物机能实验系统、JR-1/2智能恒温控制仪、BL-420生物机能实验系统(成都泰盟科技有限公司),多功能心电监护仪(美国惠普公司), RevertAidTM逆转录试剂盒(美国Fermentas公司),颅骨钻,Foley 18F气囊导管(美国Baxter公司),BIOER PCR扩增仪,IL-1β、IL-6和IL-8 ELISA试剂盒(R & D公司),兔抗大鼠单克隆抗体,羊抗兔二抗(美国Santa Cruz公司),全自动生化分析仪。
1.2 方法 1.2.1 实验分组及干预60只家兔随机平均分为2组。根据脑死亡时间点设计要求,再分为2, 6和8 h组(每组10只)。假手术组(n=30):行麻醉术,气管插管,股动脉插管和颅骨钻孔置管术,不进行颅内加压;脑死亡组(n=30):行麻醉术,气管插管,股动静脉插管,颅骨钻孔置管术及颅内加压脑死亡术。每小组分别在脑死亡后2, 6和8 h取小肠组织标本,根据要求不同分别进行甲醛浸泡和-80 ℃保存。
1.2.2 脑死亡判定标准参照美国神经病学会于1995年提出的脑死亡实践诊断标准,本实验的死亡标准:① 脑干反射消失,包括瞳孔对光反射、角膜反射等;② 深昏迷,排除麻醉、低体温等可逆性昏迷;③ 自主呼吸停止,依赖呼吸机维持;④ 脑电图静息,并持续30 min以上。
1.2.3 脑死亡模型的建立采用兔缓慢颅内加压法建立脑死亡模型,参照Pratschke等[4]的模型制作方法并加以改进。实验兔术前12 h禁食,自由饮水。称质量后,按500 mg/kg剂量耳缘静脉注射戊巴比妥维持全身麻醉。左侧腹股沟纵行切口,暴露出左侧股动脉、股静脉,分别行血管插管,股动脉接压力换能器,股静脉连接微量注射泵。同时,行气管切开术,连接呼吸机,行机械通气支持。完成上述步骤后,将实验兔仰卧位固定,用颅骨钻沿颅骨正中线开颅,于硬脑膜外腔置入Foley 18F气囊导管,并向气囊导管中缓慢注水加压,先按3 ml/min的速度注入生理盐水1 ml,密切观察脑电图、心率、血压变化5 min;待生命体征平稳后,再继续注水,直至成功建立兔脑死亡模型。在排除麻醉等导致可逆性昏迷的因素前提下,观察到脑电图静息30 min以上,且家兔瞳孔对光反射、角膜反射均消失,仅靠呼吸机维持呼吸,即可判定为脑死亡[5, 6]。
1.3 试验指标与方法 1.3.1 苏木精-伊红染色检查小肠损伤情况以10%的水合氯醛麻醉家兔后,小肠组织切片用甲醛溶液固定(体积分数为10%),石蜡包埋,4 μm切片。用二甲苯脱蜡后,以各级乙醇水洗梯度洗脱。分别用苏木精与伊红液霜染5 min。常规脱水、透明、中性树脂封固保存。在显微镜下观察小肠组织的损伤情况。
1.3.2 反转录酶-聚合酶链反应(RT-PCR)检测小肠组织热休克蛋白70(HSP70) 的mRNA表达以DEPC水灭菌且180 ℃高温烘烤的钵中进行小肠组织匀浆。TRIzol法提取RNA,用RevertAidTM反转录试剂盒得cDNA后进行PCR扩增。PCR扩增HSP70及GAPDH的引物序列如下:HSP70:F:5′-ATGACGCGCGACAACAAC-3′,R:5′-CCTTGCCCGTGCTCTTGT-3′;GAPDH:F:5′-TCTGGCAAAGTGGATGTTGTC-3′,R:5′-TCACGCCCATCACAAACAT-3′,由上海英骏生物公司合成。PCR产物用2%的琼脂糖凝胶电泳检测,对目的条带进行灰度扫描。HSP70 mRNA的相对表达量=该目的条带灰度值/同一标本GAPDH灰度值,并对表达量进行统计学分析。
1.3.3 免疫组化检测小肠组织HSP70的蛋白表达防脱片剂处理载玻片后,用不同级别的二甲苯及乙醇脱蜡至水。蒸馏水配置的体积分数为3%H2O2室温孵育5-10 min灭活内源性酶。用pH 6.0的0.01 mol/L枸橼酸盐缓冲液浸泡,加热沸腾又冷却,实现热源修复。pH 7.4的PBS洗涤2次后,滴加5%BSA封闭液,室温20 min,甩去多余液体。按照比例1:100稀释一抗(兔抗大鼠单克隆抗体),37 ℃孵育2 h。滴加Harris苏木精复染10 min,自来水充分冲洗5 min。用不同级别的乙醇及二甲苯脱蜡至水脱水,透明,封固。切片以HSP70表达着色,在普通显微镜下观察呈黄色。每张切片于×400镜下随机选择不同视野拍照3次。用图像分析仪分析得到相应积分吸光度数值。3次分析平均值代表切片中热休克蛋白表达量。
1.3.4 IL-1β、IL-6、IL-8水平在确定脑死亡后,收集不同时间2, 6, 8 h家兔的血液分管于无抗凝剂添加管中。在常温离心机上离心收集的家兔血液,2 000 r/min,持续5 min。在全自动生化分析仪上检测血清IL-1β、IL-6和IL-8的水平,按照ELISA试剂盒说明操作,绘制表格计算各细胞因子。
1.4 统计学方法利用SPSS 19.0统计软件进行数据分析,灰度值采用均数±标准差表示。采用ANOVA方差分析进行统计处理,P<0.05表示有统计学意义。
2 结果 2.1 模型建立前后平均动脉(MAP)和心率(HR)的变化MAP和HR伴随颅内加压呈现波动性变化的上升与下降,总体数据呈现出上升趋势。在颅内间断加压过程中MAP和HR的峰值分别为(402.50±16.42) mmHg和(260.69±24.26) 次/min,与假手术组平均动脉和心率所对应的时间点比较,其差异具有统计学意义(P<0.05)。平均动脉峰值与颅内加压前、后时间点的数据相比较,差异有统计学意义(P<0.05)。见表 1,2。
| 表 1 两组实验不同时间平均动脉压变化 |
| 表 2 两组实验不同时间心率变化 |
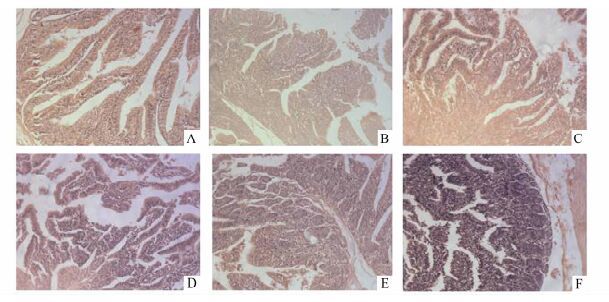
假手术组(图 1A,1B,1C)小肠绒毛排列整齐,无明显出血倾向,仅可见少量炎症浸润,毛细血管周围结构正常,基底层无明显破坏。脑死亡组(1D,1E,1F)中2 h时小肠绒毛结构破坏较轻,可见部分炎症细胞浸润,基底层肿胀充血相对不明显;6 h时小肠绒毛结构损坏呈加重趋势,部分基底层黏膜伴随脱落断裂,且有明显出血现象。在8 h时可见小肠绒毛结构损坏程度严重,红细胞成堆聚集,炎症细胞浸润严重且基底层断裂。
|
图 1 两组家兔小肠组织HE染色情况(HE×100) A,B,C示假手术组2, 6, 8 h的染色情况;D,E,F示脑死亡组2, 6, 8 h的染色情况 |
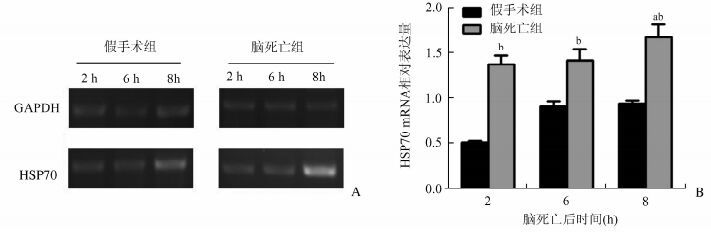
RT-PCR检测结果显示,脑死亡组的HSP70的mRNA在各阶段时间点均有表达,假手术组6 h比2 h表达显著增高,差异具有统计学意义(P<0.05)。且随着脑死亡时间的延长,HSP70的mRNA表达显著增加,在6-8 h时差异具有统计学意义(P<0.05),见图 2。
|
图 2 两组HSP70的mRNA表达量电泳结果 与之前时间点蛋白表达量相比,aP<0.05;与假手术各时间点相比,bP<0.05 |
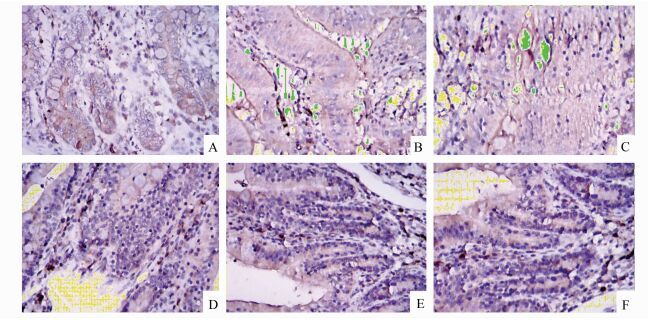
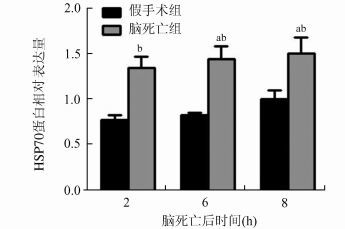
在免疫组化检测HSP70的蛋白表达中可看出,假手术组各时间点HSP70的的蛋白表达水平无显著差异(P>0.05)。脑死亡组各时间点与假手术组相比较,有明显增高趋势(P<0.05)。尤其在6-8 h时,随着脑死亡时间延长,HSP70的蛋白表达水平显著增高(P<0.05),在脑死亡后8 h时达到峰值。见图 3、图 4。
|
图 3 两组家兔小肠组织中HSP70蛋白表达情况(×400) A,B,C示假手术组2, 6, 8 h的蛋白表达情况;D,E,F示脑死亡组2, 6, 8 h的蛋白表达情况 |
|
图 4 两组HSP70的蛋白表达量对比图表 与之前时间点蛋白表达量相比,aP<0.05;与假手术各时间点相比,bP<0.05 |
不同时间点的脑死亡组动物血清IL-1β、IL-6和IL-8的差异,与假手术组相比,均由统计学意义(P<0.05)。脑死亡后各个时间点血清中的IL-1β、IL-6和IL-8的水平与前一时间点相对比,差异均有统计学意义(P<0.05),其中以IL-6和IL-8的变化更为显著(表 3)。
| 表 3 脑死亡组与假手术组动物血清中细胞因子的水平(mg/L) |
脑死亡是指包括脑干在内的全脑机能丧失的不可逆性病理状态,是目前法律上认可的供体来源,也是未来扩大供体来源的唯一方向[7]。供体需求的不断增加以及传统供体来源的减少,使供体的供求矛盾日益突出,以至于很多患者在等待过程中死亡。在西方国家中,移植器官主要来自脑死亡供者。利用脑死亡者的器官进行移植是解决供体来源短缺的有效途径之一[8]。由于目前很多研究均认为,脑死亡供体的远期/近期效果均较差,推测其可能与血流动力学改变、凝血因子消耗、炎性因子的释放和免疫状态的改变等因素有关[9, 10]。
由于脑死亡状态影响抑制效果的分子机制仍不明确,为深刻了解其机制原理,本文采用稳定颅内加压法成功建立脑死亡模型,收集脑死亡后不同时间点的小肠组织,利用蛋白质组学分析脑死亡组和假手术组2, 6, 8 h小肠组织总蛋白之间的差异;HE染色法观察小肠组织不同时间点形态差别;RT-PCR检测家兔脑死亡后HSP70 mRNA的表达量等一系列指标进行检测。为临床利用脑死亡供体进行移植提供新的实验依据。
HE染色实验中,在家兔脑死亡2 h时,小肠组织无明显损伤;脑死亡4 h后小肠组织伴轻度肿胀,但基本结构无明显损坏;脑死亡6 h及8 h后,小肠绒毛结构完整性已严重破坏,黏膜脱落严重,出现基底部断裂、肿胀出血,伴炎性细胞大量浸润等现象,而假手术组同一时间点并未见明显损伤。由此可以推测,脑死亡状态6-8 h可导致小肠结构明显损伤。
有研究表明,热休克蛋白发挥自身修复功能,可修复脑死亡状态造成的肺脏损伤,在脑死亡8 h HSP70表达量达到最高时,肺脏损伤在某种程度上得到改善,提示HSP70表达增高可能改善肺脏组织损伤[11]。但在本文实验中,发现HSP70在随脑死亡时间延长而逐渐增高的趋势中,小肠组织状态并未发现明显改善好转,提示HSP70的一定程度改善效用可能并不作用于小肠组织,原因有待于进一步进行不同的实验模型和更大量的临床病理的研究以论证。
脑死亡后2 h,血清中细胞因子IL-1β、IL-6和IL-8即开始升高,且随脑死亡时间的延长,其细胞因子的水平不断升高。脑死亡后6 h及8 h水平变化具有统计学意义。部分临床研究亦证实,脑死亡患者小肠细胞浸润、炎症介质表达明显升高。由此可以推测这种变化使移植器官的免疫原性增加,从而易发生排斥反应[12]。也有研究表明,对临床小肠移植急性排斥反应与相关细胞因子的相关性研究方面,一些个案对单个细胞因子与排斥反应的研究仍存在相反的结果[13, 14]。因此仍需要进一步开展动物实验与临床病例结合探讨。
综合本文上述研究,可认为兔脑死亡6 h之前的小肠组织没有较大损伤,而超出脑死亡6 h及8 h后的小肠组织损伤明显,这种损伤会使小肠移植的效果受到严重影响。此结果为临床合理利用脑死亡后小肠作为供体进行移植手术提供有力实验依据。日后可利用稳定稳定颅内加压法进一步研究如何在脑死亡过程中干扰或减轻损伤症状,以便于提高并改善小肠移植手术疗效。
| [1] | Koudstaal LG ′t, Hart NA, van den Berg A, et al. Brain death causes structural and inflammatory chan ges in donor intestine[J]. Transplant Proc, 2005, 37(1): 448-449. DOI: 10.1016/j.transproceed.2004.12.258. |
| [2] | Kubal CA, Mangus RS, Tector AJ. Intestine and multivisceral transplantation: current status and future directions[J]. Curr Gastroenterol Rep, 2015, 17(1): 427-428. |
| [3] | Kumar L. Brain death and care of the organ donor[J]. J Anaesthesiol Clin Pharmacol, 2016, 32(2): 146-152. DOI: 10.4103/0970-9185.168266. |
| [4] | Pratschke J, Wilhelm MJ, Kusaka M, et al. A model of gradual onset brain death for transplant-associated studies in rats[J]. Transplantation, 2000, 69(3): 427-430. DOI: 10.1097/00007890-200002150-00020. |
| [5] | Blaine EM, Tallman RD, Frolicher D, et al. Vasopressin supplementation in a porcine model of brain dead potential organdonors[J]. Transplantation, 1984, 38: 459-464. DOI: 10.1097/00007890-198411000-00003. |
| [6] | Lanza RP, Cooper DK, Novitzky D, et al. Survival after cardiac transplantation[J]. S Afr Med J, 1983, 64: 1007. |
| [7] | Sade RM. Brain death, cardiac death, and the dead donor rule[J]. J S C Med Assoc, 2011, 107: 146-149. |
| [8] | Hoogland ER, Snoeijs MG, van Heurn LW. DCD kidney transplantation; results and measures to improve outcome[J]. Curr Opin Nephrol Hypertens, 1999, 8: 317-324. DOI: 10.1097/00041552-199905000-00007. |
| [9] | Timek T, Vahl CF, Bonz A, et al. Triiodothyronine reverses depressed contractile performance after excessive catecholamine stimulation[J]. Ann Thorae Surg, 1998, 66: 1618-1625. DOI: 10.1016/S0003-4975(98)00764-4. |
| [10] | Giorgi C, Agnoletto C, Baldini C, et al. Redox control of protein kinase C: cell-and disease-specific aspects[J]. Antioxid Redox Signal, 2010, 13(7): 1051-1085. DOI: 10.1089/ars.2009.2825. |
| [11] |
李玲, 王甲甲, 范晓礼, 等. 脑死亡致肺损伤家兔热休克蛋白70的表达与作用[J].
中国工程组织研究, 2012, 16(53): 10027-10031.
Li L, Wang JJ, Fan XL, et al. Expression and effect of heat shock protein 70 following rabbit brain death induced lung injury[J]. Chinese Journal of Tissue Engineering Research, 2012, 16(53): 10027-10031. |
| [12] |
杜冰, 李玲, 钟自彪, 等. 兔脑死亡状态下肝脏质量的评估[J].
中华肝胆外科杂志, 2013, 19(12): 920-924.
Du B, Li Li, Zhong ZB, et al. The assessment of liver quality of brain death rabbits[J]. Chinese Journal of Hepatobiliary Surgery, 2013, 19(12): 920-924. DOI: 10.3760/cma.j.issn.1007-8118.2013.12.012. |
| [13] | Holan V.Sedlanckova K, Ruzickova M. Production of high levels of Th1 and Th2 cytokines in mice with acquired transplantation tolerance[J]. Cell Immunol, 1996, 174(1): 7-12. DOI: 10.1006/cimm.1996.0287. |
| [14] |
董光龙, 王为忠, 李开宗, 等. 移植物细胞因子表达与小肠移植排斥反应相关性的实验和临床病例研究[J].
免疫学杂志, 2005, 21(6): 496-499.
Dong GL, Wang WZ, Li KZ, et al. Association of the allograft cytokine expression with acute allograft rejection in small bowel transplantation[J]. Immunological Journal, 2005, 21(6): 496-499. |
 2017, Vol. 38
2017, Vol. 38


