急性肾损伤(acute kidney injury,AKI),是肾脏疾病常见的临床综合征,其发病率逐年攀升,危重患者中AKI死亡率约为35%-70%[1]。TLR4作为革兰阴性菌胞壁成分脂多糖(lipopolysaccharide,LPS)的主要受体,在AKI的发生发展中得到越来越多的重视。TLR4广泛表达于多种细胞中,在肾脏则表达于肾小管上皮细胞、血管内皮细胞、肾小球系膜细胞等[2]。近期研究发现TLR4在各种原因导致的急性肾损伤中发挥重要作用[3],但其在肾脏炎症反应信号通路中所发挥的作用尚不明确。我们研究TLR4在肾小管上皮细胞中的表达及LPS介导的MAPK信号通路的影响,探讨其在肾脏炎症反应过程中发挥作用的机制。
1 材料与方法 1.1 动物模型的制备健康雄性SD大鼠术前禁食12 h,自由饮水。4%水合氯醛1 ml腹腔注射麻醉,固定、铺无菌洞巾;采用Rittirsch的方法,腹正中切口1.5 cm,找到盲肠,在盲肠根部用3-0丝线结扎盲肠,避免结扎回肠及盲肠系膜血管,并用18 G针头对穿2次,防止针孔闭合,挤压盲肠致有粪便溢出。之后,将盲肠还纳腹腔,逐层缝合腹壁切口。术毕,立即给大鼠皮下注射0.9%氯化钠注射液2 ml/100 g抗休克。
1.2 材料大鼠肾小管上皮细胞(NRK-52E,美国ATCC),胎牛血清、DMEM培养基(美国Gibco),DAPI染色试剂盒(江苏碧云天),BCA试剂盒(美国Hyclone Picrce),TLR4抗体(美国abcam),TLR4阻断剂TAK-242(5 μmol/L,6 h,美国Invitrogen),p-38、JNK通路抑制剂SB202190(10 μmol/L,1 h,美国CST)、SP600125(25 μmol/L,30 min,美国CST),p38兔多克隆抗体、磷酸化(p)-p38兔单克隆抗体、JNK兔多克隆抗体、磷酸化(p)-JNK兔单克隆抗体(美国CST),β-actin鼠单克隆抗体(美国Santa Cruz)、辣根过氧化物酶标记的二抗(美国CST)、羊抗小鼠二抗(美国Thermo Scientific),荧光显微镜(奥林巴斯BX51),奥德赛近红外激光扫描系统Odyssey CLx Infrared Imaging System (Li-Cor公司),倒置荧光显微镜(日本Olympus IX51)。
1.3 细胞培养及分组NRK-52E细胞用含100 g/L链霉素、100 g/L青霉素及含10%胎牛血清(FBS)的DMEM培养基在37 ℃、5%CO2的培养箱中培养,细胞生长至亚融合时用1%FBS培养基同步化12 h后开始试验。按不同时间(5,15,30,60 min)分别加入脂多糖(1 μg/ml)刺激;按是否加入处理因素分为5组:正常组、LPS组、TAK-242+LPS组、SB202190+LPS组、SP600125+LPS组。
1.4 免疫荧光观察肾组织内TLR4的表达及分布5 μm厚的肾组织冰冻切片经5%牛血清白蛋白37 ℃封闭30 min,TLR4兔多克隆抗体(1:50)4 ℃过夜,FITC标记的山羊IgG (1:100)37 ℃避光孵育90 min,封片后荧光显微镜下观察、照相。
1.5 免疫荧光法检测NRK-52E细胞内TLR4的表达及分布NRK-52E细胞行细胞爬片后,4%多聚甲醛固定细胞,加入TLR4兔多克隆抗体(1:50),以PBS作为阴性对照,4 ℃避光孵育过夜,加入FITC标记的山羊IgG (1:100),37 ℃避光孵育45 min后封片,共聚焦显微镜下观察摄像。
1.6 Western Blot法检测各蛋白的表达预冷PBS轻洗细胞3次,用含有Cocktail (美国Sigma-Aldrich)的细胞裂解液裂解后,4 ℃、13 000 g离心5 min,收集上清,BCA试剂盒测定蛋白浓度。取20 μg蛋白,10%SDS-PAGE电泳,电转至硝酸纤维素膜上,5%脱脂奶粉封闭2 h,一抗4 ℃孵育过夜,一抗工作浓度分别为TLR4兔多克隆抗体(1:1 000),p38兔多克隆抗体(1:500)、磷酸化(p)-p38兔单克隆抗体(1:500)、JNK兔多克隆抗体(1:500)、磷酸化(p)-JNK兔单克隆抗体(1:500)、β-actin鼠单克隆抗体(1:1 000),TBST洗膜,辣根过氧化物酶标记的二抗(1:10 000)室温孵育1 h,TBST洗膜,Odyssey红外激光成像系统扫膜,Gel-Pro Analyzer软件分析测量条带的灰度值,以β-actin灰度值为基础,测定各组的相对比值。
1.7 统计学处理采用SPSS 17.0统计软件进行统计分析,每组实验均至少重复3次,计量数据以x±s表示,参数资料分析采用单因素方差分析,组间比较采用LSD法,P < 0.05视为差异有统计学意义。
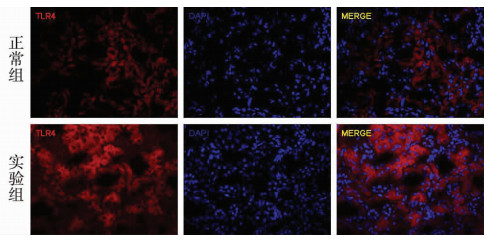
2 结果 2.1 免疫荧光观察肾小管上皮细胞内TLR4的表达及分布免疫荧光结果可见TLR4在肾小管上皮细胞胞质分布,见图 1。
|
图 1 各组大鼠肾小管TLR4的表达与分布(免疫荧光×400) 免疫荧光可见正常组及实验组均存在TLR4的表达,TLR4抗体(红色),DAPI (蓝色) |
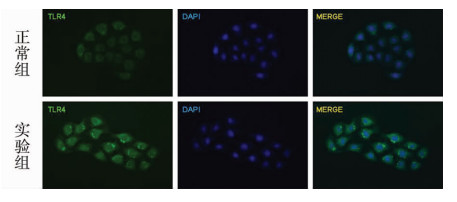
共聚焦显微镜下可见NRK-52E细胞表达TLR4蛋白(n=10),TLR4主要表达于细胞的胞质中。1 μg/ml脂多糖作用NRK-52E细胞60 min后,共聚焦显微镜下见TLR4蛋白在NRK-52E细胞中的分布无明显变化(n=10),见图 2。
|
图 2 1 μg/ml脂多糖作用后TLR4蛋白在NRK-52E细胞中的分布(免疫荧光×400) 免疫荧光可见实验组及正常组均存在TLR4的表达,TLR4抗体(绿色),DAPI (蓝色) |
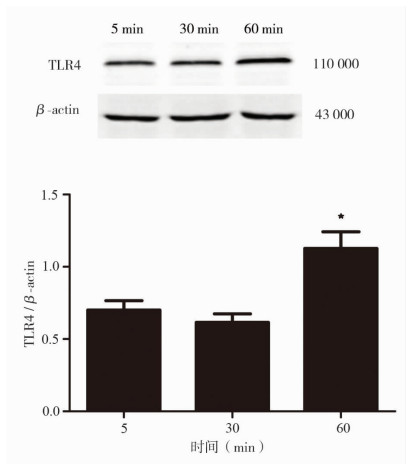
1 μg/ml脂多糖作用NRK-52E细胞5,30,60 min后,Western blot结果显示60 min组TLR4蛋白表达显著高于5,30 min组(P < 0.05),见图 3。
|
图 3 1 μg/ml脂多糖作用NRK-52E细胞不同时间(min)后TLR4蛋白的表达(Western Bolt) 与5,30 min组比较,*P < 0.05 |
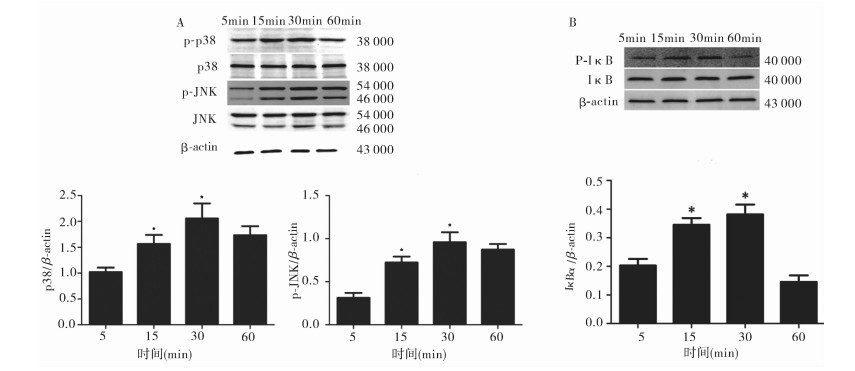
1 μg/ml脂多糖作用NRK-52E细胞5,15,30,60 min,Western Bolt结果显示,30 min组p38、JNK、Iκ-B磷酸化水平显著高于5,15,60 min组(均P < 0.05),见图 4。
|
图 4 1 μg/ml脂多糖对NRK-52E细胞MAPK信号通路相关蛋白的影响(Western blot) A:1 μg/ml脂多糖作用NRK-52E细胞不同时间(min)对MAPK信号通路相关蛋白磷酸化水平的影响(Western blot,n=3);B:1 μg/ml脂多糖作用NRK-52E细胞不同时间(min)对Iκ-B磷酸化水平的影响(Western blot,n=3);与5 min组比较,*P < 0.05 |
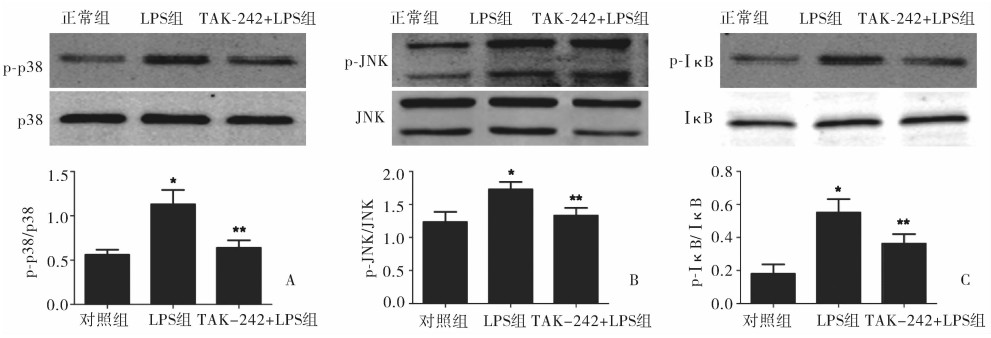
脂多糖作用NRK-52E细胞于30 min时p38、JNK、Iκ-B磷酸化水平显著上调,而TAK-242(5 μmol/L)预处理NRK-52E细胞后可使脂多糖诱导的p38、JNK、Iκ-B磷酸化显著降低(均P < 0.05),见图 5。
|
图 5 TLR4抑制剂对NRK-52E细胞MAPK信号通路相关蛋白的影响(Western blot) A.对照组;B.LPS组;C.TAK-242(5 μmol/L)+LPS组(Western blot,n=3);与正常组比较,*P < 0.05;与单独LPS刺激组比较,**P < 0.05 |
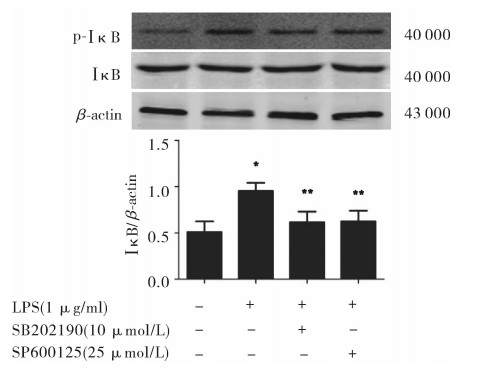
与正常NRK-52E细胞相比,脂多糖(1 μg/ml)刺激30 min可使p38、JNK、Iκ-B的磷酸化水平显著增高(P < 0.05),而SB202190以及SP600125处理后可使其磷酸化水平显著回落(P < 0.05),见图 6。
|
图 6 MAPK通路抑制剂对NRK-52E细胞Iκ-B蛋白表达的影响(Western blot) 与正常对照组比较(n=3),*P < 0.05;与单独LPS刺激组比较(n=3),**P < 0.05 |
Toll样受体(TLRs)是近年来发现的一类细胞表面信号传导跨膜受体。它广泛存在于固有性免疫系统和适应性免疫系统,提供病原体和生物相互作用界面。目前在哺乳动物体内发现至少有十种Toll样受体,其中TLR4是识别革兰阴性菌胞壁成分脂多糖(Lipopolysaccharide,LPS)的主要受体和信号转导分子,在介导LPS的病理生理效应中具有重要作用。
TLR4是Toll样受体家族中研究最为深入的成员之一。蛋白表达分析显示TLR4广泛表达于单核细胞、巨噬细胞和中性粒细胞、CD14阳性T细胞、内皮细胞、上皮细胞及CD14阴性T细胞上,在肾脏则表达于肾小管上皮细胞、血管内皮细胞、肾小球系膜细胞等[2]。既往研究表明,内毒素诱导的急性肾衰竭依赖于TLR4信号通路的参与。Haake[4]等研究发现脓毒血症导致的急性肾损伤所释放的内源性物质,主要是LPS,能激活TLR4信号通路,通过NF-κB途径,促使细胞因子、趋化因子释放,最终导致肾脏损伤。
TAK-242是TLR4选择性的抑制剂,能通过结合TLR4胞内区域抑制脂多糖诱导的炎症介质的产生, 同时应用特异性TLR4阻断剂干预可显著降低MAPK信号通路磷酸化水平,据此推测肾小管上皮细胞胞质TLR4的高表达可能参与了LPS诱导的肾小管损伤。本研究结果显示TLR4在肾小管上皮细胞胞质中高表达,且LPS作用后其表达量显著增高,并伴随MAPK信号通路的磷酸化。给予TAK-242可明显抑制LPS诱导的NRK-52E细胞MAPK信号通路磷酸化水平,提示TLR4在LPS诱导肾小管上皮细胞MAPK信号通路的激活中起重要作用。
脂多糖是革兰阴性杆菌细胞壁的主要成分,可通过介导p38、JNK MAPK信号通路的激活从而激活肾小管上皮细胞NF-κB,进而诱导多种炎性细胞因子表达增加[5]。既往研究表明,MAPK信号通路在肾脏疾病的进展中发挥重要作用[6]。丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)家族作为一类丝氨酸-苏氨酸蛋白激酶信号转导系统,是细胞内一类重要的跨膜信号转导通路,其主要有4个家族成员:细胞外信号调节的蛋白激酶(ERK)、应激活化的蛋白激酶(JNK)、p38 MAPK和ERK5通路[7]。Hou[8]等认为JNK MAPK活化后可上调TNF-α的合成,而TNF-α反过来有促进JNK MAPK的进一步活化,从而形成一个恶性循环,使其效应进一步放大。研究发现,通过采用内毒素休克大鼠模型,抑制p38 MAPK信号通路可以显著降低脓毒症的死亡率[9]。Wang[10]等建立小鼠肾动脉硬化的模型,发现抑制p38 MAPK活性可显著改善肾小管萎缩,进而减少肾纤维化的发生。
SB202190是一种特异性的p38 MAPK信号通路抑制剂,通过与p38 ATP中Thr106结合位点结合,竞争性抑制p38 MAPK与ATP结合的能力,从而使其失去活性。SP600125是一种特异性的JNK MAPK信号通路抑制剂,能通过与JNK MAPK竞争ATP结合位点,实现对JNK MAPK激酶的抑制。本研究结果表明,LPS可以提高p38、JNK MAPK的磷酸化水平,特异性抑制剂SB202190、SP600125可通过与p38、JNK MAPK特异性结合,抑制其磷酸化水平,且可以减弱LPS诱导的IκB磷酸化水平,提示p38、JNK MAPK信号转导通路在LPS诱导IκB磷酸化的表达中起着关键作用。
综上所述,本研究发现LPS刺激可诱导肾小管上皮细胞TLR4表达增加,LPS可能通过激活p38、JNK MAPK信号通路参与LPS介导肾小管上皮细胞炎症反应的过程,而TLR4选择性抑制剂TAK-242可抑制这一炎症反应,为临床急性肾损伤的防治提供了新的思路和借鉴。
| [1] | Rewa O, Bagshaw SM. Acute kidney injury-epidemiology, outcomes and economics[J]. Nat Rev Nephrol, 2014, 10(4): 193-207. DOI: 10.1038/nrneph.2013.282. |
| [2] | Vilahur G, Badimon L. Ischemia/reperfusion activates myocardial innate immune response: the key role of the toll-like receptor[J]. Front Physiol, 2014, 5: 496. |
| [3] | Smith JA, Stallons LJ, Collier JB, et al. Suppression of mitochondrial biogenesis through Toll-Like receptor 4-dependent mitogen-activated protein kinase kinase/extracellular signal-regulated kinase signaling in endotoxin-induced acute kidney injury[J]. J Pharmacol Exp Ther, 2015, 352(2): 346-357. DOI: 10.1124/jpet.114.221085. |
| [4] | Haake DA, Levett PN. Leptospirosis in humans[J]. Curr Top Microbiol Immunol, 2015, 387: 65-97. |
| [5] | Nair AR, Masson GS, Ebenezer PJ, et al. Role of TLR4 in lipopolysaccharide-induced acute kidney injury: protection by blueberry[J]. Free Radic Biol Med, 2014, 71: 16-25. DOI: 10.1016/j.freeradbiomed.2014.03.012. |
| [6] | Ding Y, Yang H, Xiang W, et al. CD200R1 agonist attenuates LPS-induced inflammatory response in human renal proximal tubular epithelial cells by regulating TLR4-MyD88-TAK1-mediated NF-kappaB and MAPK pathway[J]. Biochem Biophys Res Commun, 2015, 460(2): 287-294. DOI: 10.1016/j.bbrc.2015.03.026. |
| [7] | Gehringer M, Muth F, Koch P, et al. c-Jun N-terminal kinase inhibitors: a patent review (2010-2014)[J]. Expert Opin Ther Pat, 2015, 25(8): 849-872. DOI: 10.1517/13543776.2015.1039984. |
| [8] | Hou XL, Tong Q, Wang WQ, et al. Suppression of Inflammatory Responses by Dihydromyricetin, a Flavonoid from Ampelopsis grossedentata, via Inhibiting the Activation of NF-kappaB and MAPK Signaling Pathways[J]. J Nat Prod, 2015, 78(7): 1689-1696. DOI: 10.1021/acs.jnatprod.5b00275. |
| [9] | Morales MG, Olguin H, Di CG, et al. Endotoxin-induced skeletal muscle wasting is prevented by angiotensin-(1-7) through a p38 MAPK-dependent mechanism[J]. Clin Sci (Lond), 2015, 129(6): 461-476. DOI: 10.1042/CS20140840. |
| [10] | Wang D, Warner GM, Yin P, et al. Inhibition of p38 MAPK attenuates renal atrophy and fibrosis in a murine renal artery stenosis model[J]. Am J Physiol Renal Physiol, 2013, 304(7): F938-F947. DOI: 10.1152/ajprenal.00706.2012. |
 2016, Vol. 37
2016, Vol. 37

