2. 武汉大学中南医院/武汉大学肝胆疾病研究院/武汉大学移植医学中心/移植医学技术湖北省重点实验室 湖北 武汉 430071;
3. 中南大学湘雅三医院/卫生部移植医学工程技术研究中心 湖南 长沙 410013
2. Zhongnan Hospital of Wuhan University, Institute of Hepatobiliary Diseases of Wuhan University, Transplant Center of Wuhan University, & Hubei Key Laboratory of Medical Technology on Transplantation, Wuhan 430071, China;
3. The 3rd Xiangya Hospital of Central South University & Research Center of National Health Ministry on Transplantation Medicine Engineering and Technology, Changsha 410013, China
小肠移植是治疗肠功能衰竭的有效治疗手段,脑死亡供体已成为小肠移植的重要来源[1, 2]。但脑死亡可引起器官损伤[3],造成移植小肠慢性失功,从而严重制约小肠移植事业的发展。研究报道,细胞凋亡可能是引起脑死亡器官损伤的关键因素之一[4]。Bax和Caspase3是重要的凋亡相关基因,在细胞凋亡通路中促进凋亡的发生。另有研究证明,巴马小型猪脑死亡状态下小肠损伤重要指标蛋白激酶C(protein kinase C, PKC)表达水平明显升高[5]。本文拟建立家兔脑死亡模型,探究脑死亡状态下家兔小肠细胞中PKC及其凋亡相关基因表达的关系。
1 材料与方法 1.1 材料 1.1.1 实验动物健康成年雄性家兔60只,12-16周龄,体质量(2.9±0.3)kg,购于武汉万千佳禾实验动物养殖中心,SPF级,饲养温度:20-25 ℃,湿度:50%-70%,标准饮食,实验动物许可证号:SCXK(鄂)2007-0006。
1.1.2 试剂与仪器HX-100E动物呼吸机、JR-1/2智能恒温控制仪、BL-420生物机能实验系统均为成都泰盟科技有限公司产品,多功能心电监护仪(美国惠普公司), RevertAidTM逆转录试剂盒(美国Fermentas公司),抗PKC、NF-κB、Caspase3一抗(美国Abcam公司),辣根过氧化物酶标记的山羊抗小鼠二抗(SC-2005)(美国Santa Cruz公司)。
1.2 方法 1.2.1 实验分组及干预60只家兔随机平均分为2组。根据脑死亡时间点设计要求,再分为2, 6和8 h组(每组10只)。假手术组:行麻醉术,气管插管,股动脉插管和颅骨钻孔置管术,不进行颅内加压;脑死亡组:行麻醉术,气管插管,股动静脉插管,颅骨钻孔置管术及颅内加压脑死亡术。每小组分别在脑死亡后2, 6和8 h取小肠组织标本,根据不同实验要求分别进行甲醛浸泡和-80 ℃保存。
1.2.2 脑死亡判定标准参照美国神经病学会于1995年提出的脑死亡实践诊断标准,本实验的死亡标准:①深昏迷,排除麻醉、低体温等可逆性昏迷;②脑干反射消失,包括瞳孔对光反射、角膜反射等;③自主呼吸停止,依赖呼吸机维持;④脑电图静息,并持续30 min以上。
脑死亡模型建立:家兔术前禁食12 h,称重,戊巴比妥剂量按500 mg/kg计算,经耳缘静脉麻醉。将家兔固定,备皮,行股动脉插管,接压力换能器,同侧行股静脉插管,接微量注射泵;同时行气管插管术,待自主呼吸停止时,接微型呼吸机,给予通气支持;再行颅骨钻孔置管术,向气囊导管中缓慢注入生理盐水持续加压,密切观察脑电图,动脉压等相关指标变化。当生命体征符合本实验脑死亡标准时,即脑死亡模型建立。
1.3 试验指标与方法 1.3.1 苏木精-伊红染色观察小肠损伤情况用10%甲醛溶液固定,石蜡包埋,切片,二甲苯脱蜡,水化。分别用苏木精、伊红双染5 min,脱水,封固。在显微镜下观察小肠损伤情况。
1.3.2 免疫组化法检测Caspase3,PKC,NF-κB的蛋白表达取两组小肠组织标本进行甲醛固定,石蜡包埋,脱蜡,水化。用30 ml/L过氧化氢-甲醇溶液灭活内源性过氧化氢酶,室温孵育5 min,微波修复抗原。加一抗(1:1 000,抗PKC、NF-κB、Caspase3一抗)后4 ℃孵育过夜,加二抗(1:5 000,辣根过氧化物酶标记的山羊抗小鼠二抗)37 ℃处理1 h,TBST冲洗3次,DAB显色,苏木素脱染,脱水,封固。显微镜观察到含有黄色颗粒者是阳性细胞。计算5个高倍镜视野下阳性细胞率(阳性细胞率=阳性细胞/总细胞×100%),并求出均数作为PKC的蛋白表达量。每张切片在×400视野下随机选取3个不同视野并拍照,一起分析出相应积分吸光度值,并求出平均值作为Caspase3及NF-κB的蛋白表达量。
1.3.3 反转录酶-聚合酶链锁反应(Reverse transcription-polymerase chain reaction, RT-PCR)检测Bax的mRNA表达在研钵中将冻存组织研磨为匀浆,Trizol法提取其中的总RNA。用RevertAidTM逆转录试剂盒得cDNA后,进行PCR扩增。PCR扩增引物序列:GAPDH F:5′-TCTG-GCAAAGTGGATGTTGTC-3′ R:5′-TCACGCC CATCACAAACAT-3′;Bax F:5′-TCAGGGTTTC ATCCAGGACC-3′; R:5′-TGATGAGCTCAGGC ACCTTG-3′。2%琼脂凝胶电泳检测PCR产物,再用Image软件分别进行2种指标的灰度值计算及分析。
1.4 统计学方法利用SPSS 19.0统计软件进行数据分析,灰度值采用均数±标准差表示。采用ANOVA方差分析进行统计处理,P<0.05表示有统计学意义。
2 结果 2.1 脑死亡状态下小肠组织形态学变化(图 1)
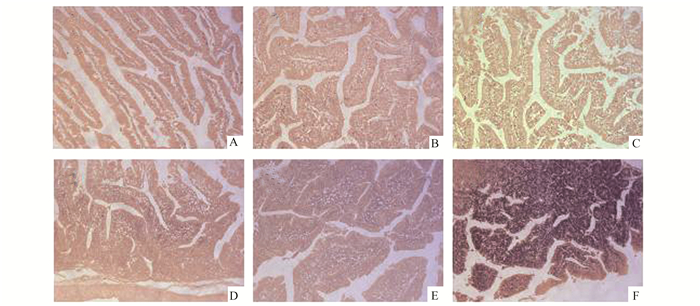
|
图 1 两组家兔小肠组织HE染色情况(HE×100) A,B,C示假手术组2, 6, 8 h的染色情况;D,E,F示脑死亡组2, 6, 8 h的染色情况 |
假手术组绒毛排列整齐,血管周围结构正常,无明显出血,基底层正常, 仅有少数炎性细胞浸润。脑死亡组2 h绒毛结构完整性破环较轻,黏膜肿胀不明显,可见炎性细胞浸润;随脑死亡时间延长,绒毛缺损程度加重,变短变细,黏膜明显肿胀充血,部分黏膜脱落,基底层断裂,并可见红细胞和炎性细胞聚集。与6 h肠组织情况相比,术后8 h小肠组织损伤更严重。
2.2 家兔小肠组织中Caspase3,PKC,NF-κB的蛋白表达假手术组小肠组织中Caspase3,PKC,NF-κB蛋白表达于胞质中,仅见少量阳性细胞,各时间点均无明显差异(P>0.05);脑死亡组与假手术组比较,各时间点小肠组织中三种蛋白表达均显著增高(P<0.05);且随脑死亡时间延长,三种蛋白表达量呈增加趋势,有明显的差异(P<0.05),8 h均达到最高量(见图 2-4)。
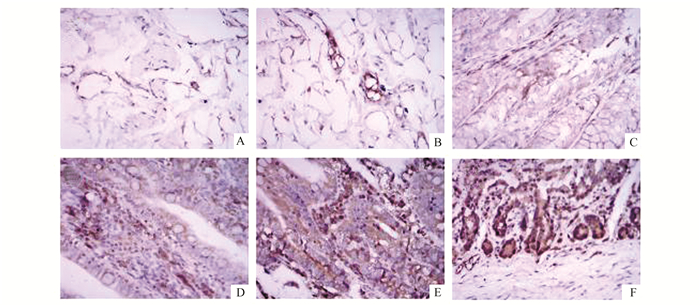
|
图 2 小肠组织Caspase3蛋白表达情况(× 400) A,B,C示假手术组2, 6, 8 h的蛋白表达情况;D,E,F示脑死亡组2, 6, 8 h的蛋白表达情况 |
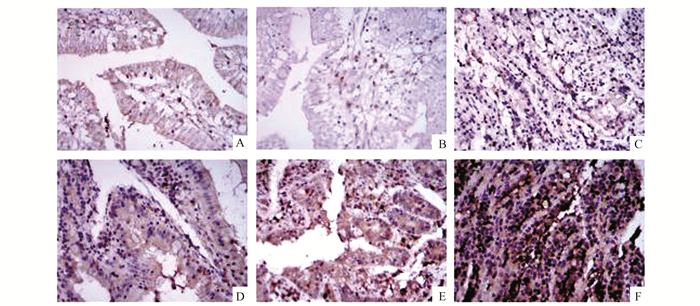
|
图 3 小肠组织PKC蛋白表达情况(× 400) A,B,C示假手术组2, 6, 8 h的蛋白表达情况;D,E,F示脑死亡组2, 6, 8 h的蛋白表达情况 |
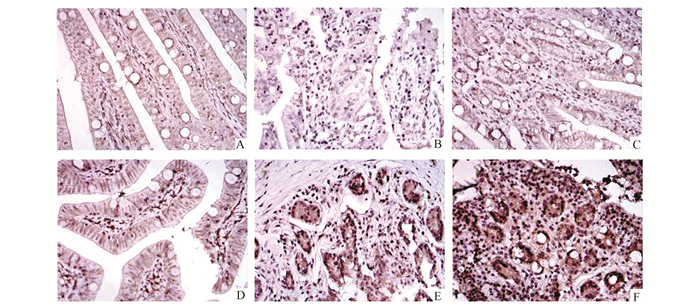
|
图 4 小肠组织NF-κB蛋白表达情况(× 400) A,B,C示假手术组2, 6, 8 h的蛋白表达情况;D,E,F示脑死亡组2, 6, 8 h的蛋白表达情况 |
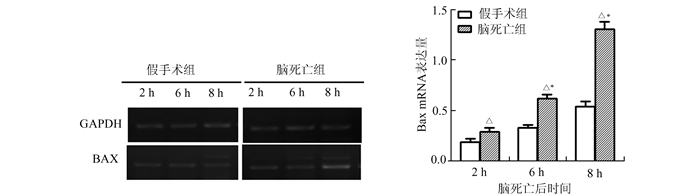
|
图 5 RT-PCR法测定Bax mRNA表达情况 与假手术组比较,△P<0.05;与同一组前一时间点比较,*P<0.05 A:假手术组和脑死亡组Bax mRNA电泳结果(GAPDH为内参); B: Bax mRNA在两组中的相对表达量 |
通过RT-PCR检测,脑死亡组的Bax mRNA在各时间点均表达,且表达水平呈增加趋势,差异具有显著性意义(P<0.05)。
3 讨论前期研究证明,脑死亡状态致血流动力学、激素、代谢和炎症等改变,严重影响器官移植质量及近远期疗效[6, 7]。本实验通过建立家兔脑死亡模型,模拟临床脑死亡供者,以此探究其具体损伤机制。
HE染色实验中,脑死亡6和8 h后,小肠绒毛结构完整性严重破坏,黏膜脱落,肿胀出血,基底部断裂,伴有炎性细胞大量浸润,但假手术组尚未见明显损伤。由此,我们可以推测,脑死亡状态6-8 h可导致小肠结构明显损伤。
PKC是磷脂依赖钙激活的蛋白丝氨酸/苏氨酸激酶,在传递细胞信号的多种通路中发挥重要作用。大量文献报道,PKC和NF-κB是反映细胞信号调控的重要指标[9, 10]。PKC常规参与细胞增殖、凋亡、肿瘤发生等过程[9]。活化PKC通过降解NF-κB与抑制因子结合的无活性分子,从而激活NF-κB,进入细胞核整合DNA并启动或抑制靶基因转录。本研究中,脑死亡组PKC和NF-κB在蛋白表达量均高于假手术组,并随着时间延长而增高,提示该两信号蛋白参与脑死亡致小肠损伤的病理过程。
细胞凋亡是一个受内在因素(如DNA损伤)或外在因素(如生长因子、类固醇激素)作用而启动的生理过程[11]。Caspase3是细胞凋亡效应的执行分子,同时还可以调节上游基因,促进细胞凋亡[11, 12]。Bax是内在凋亡通路中的主要效应物之一[13],Bax激活后,线粒体外膜寡聚化形成大量释放细胞色素的毛孔,使线粒体肿胀透化,引起细胞凋亡[14]。脑死亡组Caspase3和Bax表达量远高于假手术组,并随时间延长显著增加,且与PKC和NF-κB表达趋势一致。由此,我们认为,脑死亡致小肠损伤与肠细胞的凋亡过程相关,且可能通过PKC和NF-κB信号途径实现,该研究将为评估脑死亡供体移植小肠的质量评估提供新的实验依据。
| [1] | Koudstaal LG, 't Hart NA, van den Berg A, et al. Brain death causes structural and inflammatory changes in donor intestine[J]. Transplant Proc, 2005, 37(1): 448-449. DOI: 10.1016/j.transproceed.2004.12.258. |
| [2] | Kubal CA, Mangus RS, Tector AJ. Intestine and multivisceral transplantation: current status and future directions[J]. Curr Gastroenterol Rep, 2015, 17(1): 427-428. |
| [3] | Kumar L. Brain death and care of the organ donor[J]. J Anaesthesiol Clin Pharmacol, 2016, 32(2): 146-152. DOI: 10.4103/0970-9185.168266. |
| [4] | Puyal J, Ginet V, Clarke PG, et al. Multiple interacting cell death mechanisms in the mediation of excitotoxicity and ischemic brain damage: a challenge for neuroprotection[J]. Prog Neurobiol, 2013, 105: 24-28. DOI: 10.1016/j.pneurobio.2013.03.002. |
| [5] |
李文涛, 周闯, 宋燕, 等. 脑死亡状态对巴马小型猪胰腺及小肠组织中蛋白激酶-C的影响[J].
世界华人消化杂志, 2007, 15(2): 168-170.
Li WT, Zhou C, Song Y, et al. Effects of brain death on protein kinase C expression in pancreatic and intestinal tissues of Ba-Ma mini pigs[J]. World Chinese Journal of Digestology, 2007, 15(2): 168-170. |
| [6] | Oto T, Excell L, Griffiths AP, et al. Association between primary graft dysfunction among lung, kidney and heart recipients from the same multiorgan donor[J]. Am J Transplant, 2008, 8: 2132-2139. DOI: 10.1111/ajt.2008.8.issue-10. |
| [7] | Bos EM, Leuvenink HG, van Goor H, et al. Kidney grafts from brain dead donors: Inferior quality or opportunity for improvement?[J]. Kidney Int, 2007, 72: 797-805. DOI: 10.1038/sj.ki.5002400. |
| [8] | Abu-Elmagd KM, Kosmach-Park B, Costa G, et al. Long-term survival, nutritional autonomy, and quality of life after intestinal and multivisceral transplantation[J]. Ann Surg, 2012, 256(3): 494-508. DOI: 10.1097/SLA.0b013e318265f310. |
| [9] | Giorgi C, Agnoletto C, Baldini C, et al. Redox control of protein kinase C: cell-and disease-specific aspects[J]. Antioxid Redox Signal, 2010, 13(7): 1051-1085. DOI: 10.1089/ars.2009.2825. |
| [10] | Diaz-Meco MT, Moscat J. The atypical PKCs in inflammation: NF-κB and beyond[J]. Immunol Rev, 2012, 246(1): 154-167. DOI: 10.1111/j.1600-065X.2012.01093.x. |
| [11] | Edison N, Zuri D, Maniv I, et al. The IAP-antagonist ARTS initiates caspase activation upstream of cytochrome C and SMAC/Diablo[J]. Cell Death Differ, 2012, 19: 356-368. DOI: 10.1038/cdd.2011.112. |
| [12] | Li J, Yuan J. Caspases in apoptosis and beyond[J]. Oncogene, 2008, 27(48): 6194-6206. DOI: 10.1038/onc.2008.297. |
| [13] | Karch J, Kwong JQ, Burr AR, et al. Bax and Bak function as the outer membrane component of the mitochondrial permeability pore in regulating necrotic cell death in mice[J]. Elife, 2013, 2: e00772. |
| [14] | Tait SW, Green DR. Mitochondria and cell death: outer membrane permeabilization and beyond[J]. Nat Rev Mol Cell Bio, 2010, 11: 621-632. DOI: 10.1038/nrm2952. |
 2018, Vol. 39
2018, Vol. 39


