2. 华中科技大学同济医学院附属同济医院妇产科 湖北 武汉 430030;
3. 山东省泰安市中心医院妇产科 山东 泰安 271000
2. Dept. of Obstetrics and Gynecology, Tongji Hospital, Tongji Medical College, Huazhong University Science and Technology, Wuhan 430030, China;
3. Dept. of Obstetrics and Gynecology, Tai'an City Central Hospital, Tai'an 271000, Shandong, China
巨细胞病毒(cytomegalovirus, CMV)是最常见的宫内感染病毒之一。据调查,欧美国家的CMV宫内感染活产儿约0.64%-0.7%, 我国约6.97%的大城市孕妇属于CMV活动性感染,其中,CMV宫内感染活产儿约37.32%[1, 2]。CMV宫内感染活产儿的神经系统发育落后,并呈渐进性恶化,是人类学习记忆能力下降的第2位原因[3, 4]。但是,CMV宫内感染对子代学习记忆的影响机制仍不明确。
学习记忆能力与神经元的Tau蛋白磷酸化密切相关[5]。细胞内蛋白激酶A (protein kinase A,PKA)和蛋白磷酸酶2A (protein phosphatase 2A,PP2A)是Tau蛋白磷酸化最重要的蛋白酶[6]。为此,本文通过建立豚鼠CMV宫内感染动物模型,观察CMV宫内感染对子代海马神经元Tau蛋白磷酸化的影响,探讨CMV宫内感染的子代学习记忆能力下降的影响机制,报告如下。
1 材料与方法 1.1 材料 1.1.1 病毒与细胞豚鼠巨细胞病毒(guinea pig cytomegalovirus, GPCMV)标准株22122和豚鼠胚肺细胞株均购自美国典型培养物保藏中心(American type culture collection, ATCC),按常规方法在武汉大学中南医院医学科学研究中心培养传代,病毒半数组织培养感染量(tissue culture infectious dose, TCID50)为10-4.58。
1.1.2 实验动物及分组60只雌性及15只雄性Hartley豚鼠体重(450±25) g,月龄>6个月(湖北省医学实验动物中心提供)[许可证编号:SCXK (鄂) 2010-0008]。所有实验动物的操作及饲养均符合“The Guidelines for the Care and Use of Laboratory Animals”的规定[7]。应用PCR法筛选豚鼠外周血的GPCMV DNA阴性者列为研究对象。按4:1比例将雌雄豚鼠同笼受孕,次日晨检查雌性豚鼠阴道分泌物,发现精子之日确定为受孕0 d。随机选择孕早期(孕龄1-20 d)豚鼠分为2组:感染组25只, 每只腹腔内接种GPCMV病毒悬液(1×107 TCID50) 1 ml, 足月分娩后,应用PCR法检测子代豚鼠外周血的GPCMV DNA,DNA阳性者喂养至3月龄后脊椎脱臼法处死,无菌采集脑组织后分离出海马区,部分4%多聚甲醛固定,常规石蜡切片,剩余冻存于-80 ℃待用; 对照组25只, 每只腹腔内接种生理盐水1 ml,方法同感染组。
1.1.3 主要试剂及仪器兔抗PKA多克隆抗体; 兔抗PP2A多克隆抗体,山羊抗p-Tau (Ser404)多克隆抗体,山羊抗Tau多克隆抗体均购自Sigma Cruz公司,过氧化物酶标记兔抗山羊IgG, 过氧化物酶标记羊抗兔IgG和即用型SABC-AP试剂盒均购自武汉博士德生物工程有限公司,DAB辣根过氧化物酶显色试剂盒购于碧云天生物技术公司,其他试剂购自武汉谷歌生物科技有限公司。
1.2 方法 1.2.1 免疫组织化学检测石蜡切片常规脱蜡至水,用3% H2O2灭活内源性酶15 min, PBS洗3次,每次3 min; 将切片浸入0.02 mol/L PBS枸橼酸缓冲液中微波加热至沸腾,放置室温冷却后,依次滴加血清封闭液37 ℃孵育30 min,一抗湿盒中4 ℃孵育过夜(稀释度1:150),生物素标二抗常温孵育2 h (稀释度1:100),SABC复合物常温孵育45 min,最后DAB辣根过氧化物酶显色试剂盒显色15 min,苏木精复染10 s,梯度乙醇脱水,透明,中性树胶封片。光镜下随机选取海马CA1区5-8个视野,观察并采用Image-Pro Plus 6.0图像分析系统进行平均光密度(absorbance,OD)值检测。
1.2.2 免疫印迹检测BCA试剂盒测定提取的总蛋白浓度后,计算上样量,加入5×SDS上样缓冲液至1倍浓度,沸水中加热10 min使蛋白变性,进行SDS-聚丙烯酰胺凝胶(10%-15%分离胶)电泳分离至溴酚蓝抵达分离胶下缘; 切胶后,分离的蛋白在250 mA,冰浴条件下转膜120 min, 将目的蛋白转移到NC膜; TBST洗膜后,室温下依次置入5%脱脂奶粉封闭1 h, 一抗4 ℃孵育过夜(稀释度1:1 000),过氧化物酶标记的二抗孵育2 h (稀释度1:2 000),TBST洗涤2次,每次10 min,最后TBS洗涤1次,10 min,用ECL化学发光、显影及定影; GIS1000分析软件/图像分析系统对蛋白条带进行分析,统计并分析目的蛋白与β-actin条带光密度值的比值。
1.3 统计学处理应用SPSS 19.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,采用独立样本t检验,以P<0.05为差异具有统计学意义。
2 结果 2.1 免疫组织化学检测结果应用免疫组织化学法检测CMV宫内感染对子代豚鼠海马组织Tau、p-Tau (Ser 404)、PP2A及PKA蛋白表达的影响。由图 1可见,Tau、p-Tau (Ser 404)、PP2A及PKA蛋白棕色阳性信号主要位于细胞质。对照组神经元形态完整,轴突结构明显,而感染组神经元细胞破裂,排列疏松,着色深浅不均,结构欠完整。
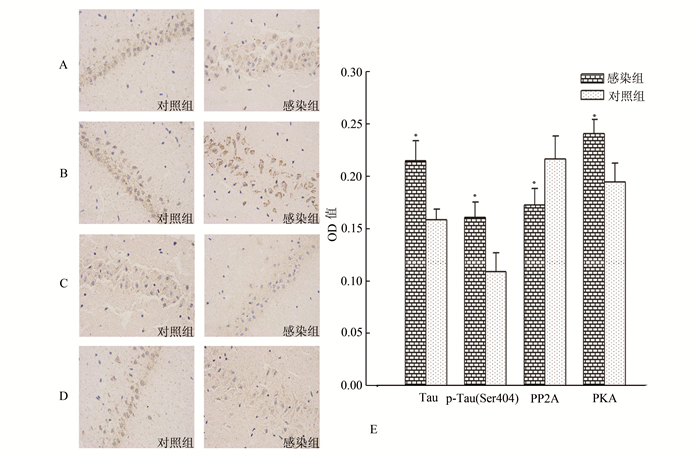
|
图 1 免疫组织化学法检测CMV宫内感染对子代豚鼠海马神经元Tau相关蛋白表达的影响(×400) A、B、C、D分别为两组子代豚鼠海马神经元Tau、p-Tau (Ser404)、PP2A及PKA蛋白的表达; E为两组子代豚鼠海马神经元Tau相关蛋白表达水平比较(与对照组相比,*P<0.01) |
应用免疫印迹法进一步检测CMV宫内感染对子代豚鼠海马组织Tau、p-Tau (Ser 404)、PP2A及PKA蛋白表达的影响,结果如图 2。CMV宫内感染导致子代豚鼠海马神经元Tau、p-Tau (Ser 404)及PKA蛋白表达水平增加,而PP2A蛋白的表达水平降低。
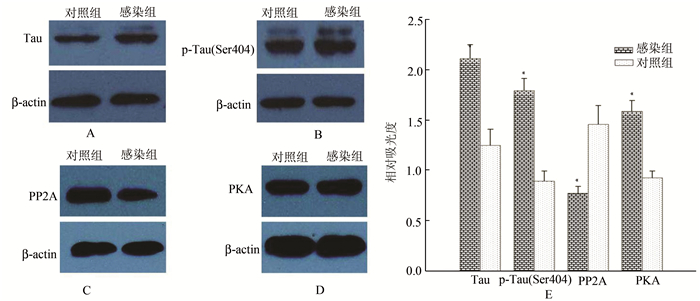
|
图 2 免疫印迹法检测CMV宫内感染对子代豚鼠海马神经元Tau相关蛋白表达的影响 A、B、C、D分别为两组子代豚鼠海马神经元Tau、p-Tau (Ser404)、PP2A及PKA蛋白的表达; E为两组子代豚鼠海马神经元Tau相关蛋白表达水平比较(与对照组相比,*P<0.01) |
CMV是一种嗜神经病毒,易感染脑组织,受感染细胞主要分布于大脑皮质和海马[8],而大脑皮质和海马的神经元是学习记忆能力最重要的结构基础。前期研究发现,CMV宫内感染导致子代海马神经元病理改变(细胞结构紊乱,出现坏死、凋亡等)和功能改变(NMDA受体,PKC蛋白,突触数目及相关蛋白等),这可能是CMV宫内感染的子代学习记忆下降的原因之一[9-11],但是,具体作用机制仍不清楚。
Tau蛋白主要位于神经元轴突,是一种含量最高的微管相关蛋白(microtubule associated proteins,MAPs),通过与微管蛋白结合形成微管,并且与形成的微管相互结合,维持微管的完整性和稳定性[12]。正常人大脑中,Tau蛋白处于一种低水平的磷酸化状态(含2-3个磷酸基)。但是,当Tau蛋白过度表达或异常磷酸化后,其与微管结合性减弱,使得微管稳定性下降,轴浆运输功能受损,神经原纤维缠结聚积,最终导致学习记忆功能受损[13]。据统计,目前已发现85种以上的Tau蛋白磷酸化位点,尤其是Ser396、Ser404、Ser199/202、Thr231和Thr 181等位点,与学习记忆能力均密切相关[14]。因此,本文应用免疫组织化学和免疫印迹法检测CMV宫内感染的子代豚鼠海马神经元Tau相关蛋白的表达水平变化,结果显示,CMV宫内感染的子代豚鼠海马神经元Tau及p-Tau (Ser404)蛋白的表达水平上升,提示CMV宫内感染的子代学习记忆能力下降,可能与上调海马神经元Tau和Tau Ser404磷酸化位点的蛋白水平相关。
Tau蛋白磷酸化水平主要取决于体内多种蛋白激酶(催化磷酸化反应)和蛋白磷酸酶(去催化去磷酸化反应)的相互作用。正常情况下,两者处于一种动态的平衡。当机体存在氧化应激、金属离子、炎症及内源性甲醛等刺激时,神经元中的蛋白激酶活性增高或/和蛋白磷酸酶活性降低,将引起Tau蛋白磷酸化水平异常增高[15, 16]。根据不同的作用部位,蛋白激酶可分为三种:脯氨酸蛋白激酶,非脯氨酸蛋白激酶及酪氨酸特异蛋白激酶。PKA属于非脯氨酸蛋白激酶,它不仅直接磷酸化Tau蛋白的多个位点,而且其对Tau蛋白的预磷酸化可使GSK-3β对Tau蛋白的磷酸化作用大大增强[17, 18]。在Tau蛋白磷酸化过程中,PP2A是活性最强的蛋白磷酸酶,可促使异常磷酸化的Tau蛋白去磷酸化、解除轴突运输障碍,恢复Tau蛋白的生物学功能[19]。研究发现,PP2A抑制剂引起大鼠海马神经元突触、树突丢失及Tau蛋白异常磷酸化,而叶酸、维生素B12及黄连素等药物增加PP2A活性,从而降低Tau蛋白磷酸化水平,改善学习记忆能力[20, 21]。本文应用免疫组织化学和免疫印迹法检测CMV宫内感染的子代豚鼠海马神经元中的蛋白酶表达水平的变化,结果显示,CMV宫内感染的子代豚鼠神经元中的PKA蛋白的表达水平上升,而PP2A蛋白的表达水平下降,提示CMV宫内感染的子代Tau及Tau Ser404磷酸化位点的蛋白表达水平增加,可能与同时上调神经元中PKA蛋白的表达和下调PP2A蛋白的表达相关。
我们推断,CMV宫内感染的子代海马神经元中PKA蛋白的表达上升和PP2A蛋白的表达下降,促使Tau及Tau Ser404磷酸化位点的蛋白表达水平增加,从而导致子代学习记忆能力下降。当然,其作用机制有待进一步研究。
| [1] | Scott GM, Chow SS, Craig ME, et al. Cytomegalovirus infection during pregnancy with maternofetal transmission induces a proinflammatory cytokine bias in placenta and amniotic fluid[J]. J Infect Dis, 2012, 205(8): 1305-1310. DOI: 10.1093/infdis/jis186. |
| [2] | Wen LZ, Xing W, Liu LQ, et al. Cytomegalovirus infection in pregnancy[J]. Int J Gynaecol Obstet, 2002, 79(2): 111-116. DOI: 10.1016/S0020-7292(02)00239-4. |
| [3] | Mccarthy FP, Giles ML, Rowlands S, et al. Antenatal interventions for preventing the transmission of cytomegalovirus (CMV) from the mother to fetus during pregnancy and adverse outcomes in the congenitally infected infant[J/OL]. Cochrane Database Syst Rev, 2011(3): D8371. https://www.uptodate.com/contents/cytomegalovirus-infection-in-pregnancy |
| [4] | Cheeran MC, Lokensgard JR, Schleiss MR. Neuropathogenesis of congenital cytomegalovirus infection: disease mechanisms and prospects for intervention[J]. Clin Microbiol Rev, 2009, 22(1): 99-126. DOI: 10.1128/CMR.00023-08. |
| [5] | Kingwell K. Alzheimer disease: BIN1 variant increases risk of Alzheimer disease through tau[J]. Nat Rev Neurol, 2013, 9(4): 184. |
| [6] | Ballatore C, Brunden KR, Huryn DM, et al. Microtubule stabilizing agents as potential treatment for Alzheimer's disease and related neurodegenerative tauopathies[J]. J Med Chem, 2012, 55(21): 8979-8996. DOI: 10.1021/jm301079z. |
| [7] | Care NRCU, Animals AUOL. Guide for the Care and Use of Laboratory Animals[M]. Washington DC: National Academies Press (US), 2011. |
| [8] | Malinger G, Lev D, Lerman-Sagie T. Imaging of fetal cytomegalovirus infection[J]. Fetal Diagn Ther, 2011, 29(2): 117-126. DOI: 10.1159/000321346. |
| [9] | 郑翠, 陈素华, 冯玲. 巨细胞病毒感染对小鼠海马的PKC表达与Ca2+浓度的影响[J]. 中国妇幼保健, 2009, 24(7): 990-992. |
| [10] | 付月玲, 陈素华, 冯玲, 等. 巨细胞病毒对乳鼠海马神经元NMDA受体NR1亚基表达水平的影响[J]. 中国实用妇科与产科杂志, 2010, 26(7): 517-520. |
| [11] | 陈娟娟.小鼠巨细胞病毒感染对乳鼠海马突触数目及突触相关蛋白的影响研究[D].武汉:华中科技大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10487-2008027109.htm |
| [12] | Song L, Lu SX, Ouyang X, et al. Analysis of tau post-translational modifications in rTg4510 mice, a model of tau pathology[J]. Mol Neurodegener, 2015, 10: 14. DOI: 10.1186/s13024-015-0011-1. |
| [13] | Jun G, Ibrahim-Verbaas CA, Vronskaya M, et al. A novel Alzheimer disease locus located near the gene encoding tau protein[J]. Mol Psychiatry, 2016, 21(1): 108-117. DOI: 10.1038/mp.2015.23. |
| [14] | Takashima A. Significance of tau in the development of Alzheimer's disease[J]. Brain Nerve, 2010, 62(7): 701-708. |
| [15] | Serrano J, Fernandez AP, Martinez-Murillo R, et al. High sensitivity to carcinogens in the brain of a mouse model of Alzheimer's disease[J]. Oncogene, 2010, 29(15): 2165-2171. DOI: 10.1038/onc.2009.503. |
| [16] | Ho YS, Yang X, Lau JC, et al. Endoplasmic reticulum stress induces tau pathology and forms a vicious cycle: implication in Alzheimer's disease pathogenesis[J]. J Alzheimers Dis, 2012, 28(4): 839-854. |
| [17] | Carlyle BC, Nairn AC, Wang M, et al. cAMP-PKA phosphorylation of tau confers risk for degeneration in aging association cortex[J]. Proc Natl Acad Sci USA, 2014, 111(13): 5036-5041. DOI: 10.1073/pnas.1322360111. |
| [18] | Sanchez-Mut JV, Aso E, Heyn H, et al. Promoter hypermethylation of the phosphatase DUSP22 mediates PKA-dependent TAU phosphorylation and CREB activation in Alzheimer's disease[J]. Hippocampus, 2014, 24(4): 363-368. DOI: 10.1002/hipo.v24.4. |
| [19] | Iqbal K, Gong CX, Liu F. Microtubule-associated protein tau as a therapeutic target in Alzheimer's disease[J]. Expert Opin Ther Targets, 2014, 18(3): 307-318. DOI: 10.1517/14728222.2014.870156. |
| [20] | Wang X, Blanchard J, Tung YC, et al. Inhibition of Protein Phosphatase-2A (PP2A) by I1PP2A Leads to Hyperphosphorylation of Tau, Neurodegeneration, and Cognitive Impairment in Rats[J]. J Alzheimers Dis, 2015, 45(2): 423-435. |
| [21] | Sontag JM, Wasek B, Taleski G, et al. Altered protein phosphatase 2A methylation and Tau phosphorylation in the young and aged brain of methylenetetrahydrofo-late reductase (MTHFR) deficient mice[J]. Front Aging Neurosci, 2014, 6: 214. |
 2016, Vol. 37
2016, Vol. 37
