近年来,超声造影技术在临床占位性疾病诊断及评价治疗效果上应用广泛,特别是在肝[1]、肾[2]、乳腺[3]占位的应用发展突出,但在宫腔占位中应用较少。该研究采用超声造影剂SonoVue通过外周静脉注入,观察了76例宫腔占位病变的微血管灌注信息,以探讨该技术对宫腔良、恶性病变的诊断价值。
1 资料与方法 1.1 病例选择选择2012年11月至2013年11月期间在本院诊治宫腔占位患者进行超声造影检查,均经诊断性刮宫或手术获得病理诊断,年龄41-73岁,平均(57.9±9.5)岁。共78例,其中良性组46例,包括子宫黏膜下肌瘤26例,内膜息肉12例,内膜增生5例,宫腔积液3例;恶性组均为子宫内膜癌,共32例。入院标准:造影前患者均未进行刮宫、宫腔镜等内膜创伤性操作史;所有患者均无放化疗史。
1.2 仪器和方法应用Philips iU22型超声诊断仪,实时低机械指数成像技术,采用1-5 MHz的C5-1探头及5-9 MHz的C9-5ec探头,超声造影剂为SonoVue (六氟化硫)。常规超声观察病灶大小、位置、彩色多普勒等情况,选择病灶区显示最佳切面,经肘静脉团注SonoVue 2.4 ml,随后5 ml生理盐水冲管,全过程以Dicom格式存盘。
图像导入Qlab脱机分析软件,观察病灶及未受累子宫肌层的超声造影特征;然后选取病灶区域作为参考区,勾画5 mm2正方形取样框(尽量避开子宫动脉等血管),获得良、恶性病灶时间-强度曲线(TIC),分析量化指标,本研究涉及的指标包括:上升时间、达峰时间、峰值强度、半降时间及内洗斜率。
1.3 统计学分析采用SPSS 18.0统计软件分析数据,计量资料以均数±标准差表示。良恶性组间比较采用独立样本t检验,P<0.05为差异具有统计学意义。
2 结果 2.1 造影增强特征 2.1.1 良性病灶超声造影表现3例宫腔积液在造影的整个过程中均无造影剂灌注,始终为无灌注,与周围组织分界清晰。因无造影剂灌注,TIC量化指标未纳入研究;团注SonoVue后,黏膜下肌瘤首先周边环形或半环形高增强(如图 1A-1C),接近或略早于周围正常肌层,病灶内环形增强快速消退,因此常常在灌注晚期或者廓清相,病灶周边仍然为清晰的环形增强(如图 1D),这也是鉴别黏膜下肌瘤和内膜癌的标准之一;内膜息肉通常有蒂,蒂部血流常常略迟于或接近肌层显影,可见主血管进入病灶内,增强晚期与肌层同时消退或略迟于肌层(如图 2);内膜增生多表现为肌层先显影,逐渐向内膜填充,内膜造影剂廓清与肌层相似或略早于肌层,但在造影的整个过程中,内膜的增强始终低于肌层。
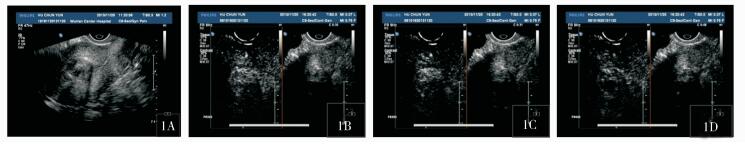
|
图 1 黏膜下肌瘤造影特征 1A:宫腔内见一低回声区,内膜线偏移;1B:病灶造影剂灌注时间早于子宫肌层,并且强度比肌层高;1C:病灶周边环形增强明显,强度依旧高于肌层;1D:病灶开始消退,周边仍可见环形高增强 |
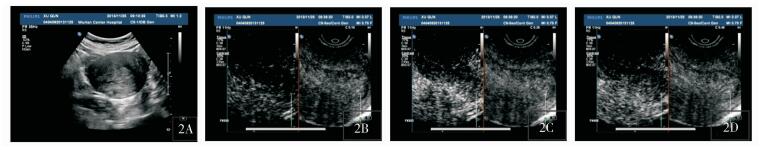
|
图 2 内膜息肉造影特征 2A:宫腔内膜增厚,内可见团状稍强回声,内膜线偏移;2B:病灶造影剂到达时间晚于肌层,强度较肌层低;2C:肌层增强,内膜强度依旧低于肌层;2D:病灶消退早于肌层 |
见图 3。团注造影剂之后,供应病灶内滋养血管早于肌层迅速增强,整体迅速均匀或非均匀性增强(如图 3B),若存在液化坏死区域,则表现为造影剂无灌注区。病灶边界可不规则,周围肌层可存在锯齿样、不光滑面;廓清相,其造影剂强度低于周围肌层,形成分界清晰的造影剂高-低灌注分界层(如图 3D)。
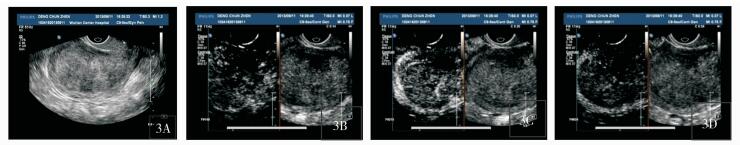
|
图 3 内膜癌造影特征 3A:内膜线显示不清,宫腔内稍强回声区,边界不清晰,回声明显不均;3B:病灶内造影剂开始显影时间较周围肌层提前;3C:病灶内整体快速增强,近前壁肌层出可见不规则无灌注区域,为液化坏死区域;3D:病灶消退较肌层快,周边正常肌层为高增强,分界清晰 |
整体快速增强、周边向中央汇聚、中央向外周灌注,第一种方式在恶性组中多见(28/32,87.5%),后两种多见于良性病灶(39/46,84.8%),见表 1。26例黏膜下肌瘤在团注SonoVue后,均表现为周边向中央增强的方式,呈“环形”或“半环形”高增强;12例内膜息肉中有8例表现为一主血管进入病灶内,首先中央增强,然后缓慢向周围填充,灌注、廓清过程与肌层接近同步,另外4例表现为整体快速增强;5例内膜增生的增强方式与子宫内膜相似,由周边向中央汇聚,灌注时间晚于肌层,强度低于肌层。
| 表 1 良、恶性宫腔占位的三种灌注方式 |
内膜癌多表现为“快升快退”型(如图 4A),上升支及下降支较陡直,两支形成的角度小;少数为“快升慢降”。病灶内液化坏死区TIC为接近基线低-无增强;而黏膜下肌瘤、内膜息肉和内膜增生多表现为“快升慢降”或“慢升慢降”(如图 4B),上升支与下降支较平缓,形成的角度较恶性组大。分析良、恶性组间各量化指标得出(如表 2),上升时间、达峰时间、半降时间和内洗斜率在良恶性组间存在显著统计学差异,P<0.01;而峰值强度上无统计学差异。
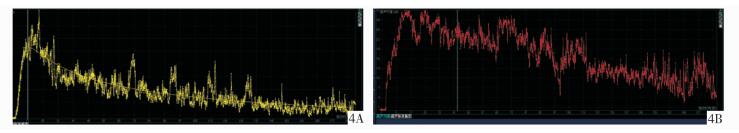
|
图 4 良恶性组的时间-强度曲线 4A:曲线上升支陡直,第10秒增强达峰,下降支快速消退,第45秒强度消退至一半,此为一例内膜癌超声造影TIC特征;4B:该曲线上升支较平缓,第17秒达峰,下降支缓慢,第97秒,强度消退至一半,此为一例黏膜下肌瘤超声造影TIC特征 |
| 表 2 时间-强度曲线指标统计学分析 |
宫腔内占位性病变是导致异常子宫出血的常见原因,最为常见的是子宫黏膜下肌瘤、内膜息肉、内膜增生、内膜癌、宫腔积液等,临床表现为月经过多、经期延长、绝经后出血或阴道流液等。超声造影作为一种微血管成像新技术,通过注入与红细胞大小相似的造影剂微泡,观察微泡到达脏器组织中的浓度和进出速度,间接反映微循环灌注和廓清情况。造影剂进出病灶的速度模式与其病理基础有重要的联系[2],因此,通过观察造影特征和TIC指标可以对病灶性质做出初步诊断。
在本研究中,根据病灶周边及中央灌注时间先后顺序的不同,将其分为整体快速增强(病灶整体呈均匀性或非均匀性快速增强,未见显影时间差)、周边向中央汇聚(病灶周边先增强,而后向中央汇聚)和中央向周边灌注(病灶中央先增强,然后向周边扩散)三种方式。宫腔良恶性肿块灌注过程有所不同。
32例内膜癌中有28例表现为整体快速增强,表现为周边向中央、中央向周边汇聚的方式各为2例。根据肿瘤新生血管学说[4],子宫内膜癌病灶浸润破坏原有的正常血管,诱导产生畸形的新生血管,管壁较薄,缺乏肌层,因此,在造影过程中增强快,表现为整体快速增强过程,同时血管床微泡灌注流量大、总量大,产生极强的声学反射,但在变性、坏死区内表现为无造影剂灌注。根据子宫内膜癌大体分型为弥漫型、局限型及息肉型,本病例中,2例局限型及2例息肉型内膜癌分别表现为后两种灌注方式,未表现为典型的内膜癌整体增强的灌注特征,可能与病灶微循环灌注状态有关。
在46例良性病灶中,3例宫腔积液表现为在造影的整个过程中,宫腔始终可见无灌注区域,肌层显影均匀一致;26例黏膜下肌瘤均表现为周边向中央增强的方式,由于肌瘤外层围绕血管网形成假包膜,呈放射状发出分支伸入肌瘤内,因此可以看到瘤体周边先增强,内部后显影,病灶周边假包膜处形成明显的“环形”或者“半环形”高增强区域;12例内膜息肉中有8例表现为中央向周边灌注,息肉通常有蒂,其血供来源于蒂,因此注入造影剂之后首先通过蒂部病灶内开始显影,然后缓慢逐渐向周围填充,灌注、廓清过程与肌层接近同步,另外4例表现为整体增强,可能是由于息肉多发,血管来源于多个蒂,血管较丰富所形成;5例内膜增生的增强方式与正常子宫内膜相似,灌注时间晚于肌层,强度低于肌层。由于子宫动脉来源于髂内动脉的分支,上升支在子宫侧缘沿宫体上升的同时分出弓状动脉,在肌层外1/3形成血管网,由此垂直分出放射状动脉到达内膜。团注造影剂之后,子宫动脉及分支首先灌注为高增强-肌层增强-内膜增强;增强晚期内膜造影剂的廓清较肌层快,廓清顺序与增强相反,即内膜廓清-肌层廓清-子宫动脉及分支较晚廓清。并且,内膜的增强强度始终低于肌层。
时间-强度曲线内含有丰富的定量信息,本病例中,恶性病灶多表现为陡直的上升支、达峰提前,上升时间及达峰时间分别为(9.12±3.65) s、(32.83±7.33) s,而良性病灶多表现为缓慢消退,达峰时间延长,上升时间及达峰时间分别为(22.83±5.41) s、(48.12±17.89) s,其差异具有显著统计学意义(P<0.01);恶性组下降支陡直,形成明显的波峰,半降时间[(55.29±11.69) s]短于良性组[(101.72±23.14) s],内洗斜率[(1.95±0.54) s]快于良性组[(0.56±0.40) s],其差异也具有统计学意义(P<0.01)。参照1988年国际妇产科联盟(FIGO)手术分期标准,将子宫内膜癌按肌层浸润程度分为:Ⅰa期:无肌层浸润,肿瘤局限于内膜层;Ⅰb期,浅肌层浸润,浸润深度≤1/2肌层厚度;Ⅰc期,深肌层浸润>1/2肌层厚度。根据内膜癌浸润深度不同,其造影表现则不同。有病理研究证实[5],存在肌层浸润的内膜癌微血管密度明显高于无肌层浸润者;内膜癌多普勒超声多见丰富且走行紊乱的血流信号,肌层浸润越深,病灶及周围肌层血供越丰富[6, 7], 因此造影过程中表现为,与良性病灶相比,恶性病灶灌注时间快、达峰提前、廓清快。然后,由于内膜癌病灶内因液化、坏死程度不一致,以及癌灶分化程度的不一致,导致病灶峰值强度与良性组相比并没有统计学差异。
超声造影技术因其无辐射、无创伤、代谢快、操作方便等特点,在超声影像学诊断中应用较广泛。时间-强度曲线量化指标可以作为评价病灶血管灌注的有效工具,但还需进一步研究和完善,特别是在宫腔占位的应用中,需要制定统一定量标准是今后发展的方向。
| [1] | Shiozawa K, Watanabe M, Summibo Y, et al. Evaluation of the hemodynamic status of focal hepatic lesions 20 mm or less in diameter by contrast-enhanced ultrasonography using Sonazoid[J]. Intervirology, 2009, 52(4): 213-222. DOI: 10.1159/000226215. |
| [2] | Dong XQ, Shen Y, Xu LW, et al. Contrast-Enhanced ultrasound for detection and diagnosis of renal clear cell carcinoma[J]. Chinese Medical Journal, 2009, 122(10): 1179-1183. |
| [3] | Zhao H, Xu R, Ouyang Q, et al. Contrast-enhanced ultrasound is helpful in the differentiation of malignant and benign breast lesions[J]. European Journal of Radiology, 2010, 73(2): 288-293. DOI: 10.1016/j.ejrad.2009.05.043. |
| [4] | Folkman J. Tumor angiogenesis:therapeutic implication[J]. N Engl J Med, 1971, 285(21): 1182-1186. DOI: 10.1056/NEJM197111182852108. |
| [5] | Williams JW, Hirschowitz L. Assessment of uterine wall thickness and position of the cascular plexus in the deep myometrium:implications for the measurement of depth of myometrial invasion of endometrial carcinomas[J]. Int J Gynecol Pathol, 2006, 25(1): 59-64. DOI: 10.1097/01.pgp.0000177123.78932.1d. |
| [6] | Kanat-Pektas M, Gungor T, Mollamahmutoglu L. The evaluation of endometrial tumors by transvaginal and Doppler ultrasonography[J]. Arch Gynecol Obster, 2008, 277(6): 495-499. DOI: 10.1007/s00404-007-0517-z. |
| [7] | Ozdemir S, Celik C, Emlik D, et al. Assessment of myometrial invasion in endometrial cancer by transvaginal sonography, Doppler ultrasonography, magnetic resonance imaging and frozen section[J]. Int J Gynecol Cancer, 2009, 19(6): 1085-1090. DOI: 10.1111/IGC.0b013e3181ad3eb6. |
 2016, Vol. 37
2016, Vol. 37

 ,
,