雌激素(estrogen)作为机体内最重要的女性性激素,参与了心血管、免疫、内分泌、神经等系统功能调节与机体第二性特征的发育。17β-雌二醇(17-β-estradiol, E2)作为体内雌激素最重要的生物活性形式,在众多生理病理过程中都起着不可或缺的作用。以往对于雌激素作用方式的认知,主要是E2能通过位于核内的雌激素受体α和β (estrogen receptor α and β, ERα and ERβ),与目标基因启动子区域的雌激素反应元件(EREs)相结合调节基因表达[1]。而新型G蛋白耦联雌激素受体1(G protein-coupled estrogen receptor 1, GPER1)的发现,为我们了解E2的作用机理展开了一片新天地。GPER1, 又称GPER/GPR30,是一种七跨膜G蛋白,在结构上与经典的雌激素受体ERα和ERβ不同。作为新型的雌激素受体,在子宫内膜癌、卵巢癌和乳腺癌发生发展过程中,GPER1可以调节肿瘤细胞对激素的反应。在神经系统的研究中也发现,GPER1通过抑制DAPK1的去磷酸化来抑制细胞内的钙内流,从而达到神经保护作用。由此,GPER1作为新型的靶标在研究肿瘤激素药物反应及神经系统保护方面是极具前景的。
1 雌激素受体 1.1 经典受体/核受体ERα、ERβ传统意义上,雌激素的经典受体包括核雌激素受体α和β(ERα和ERβ),ERα首先在20世纪60年代在大鼠的子宫中发现[2]。1996年,在大鼠前列腺的研究中发现了ERβ的存在[3]。甾体雌激素介导的许多细胞反应,其中的一大部分是由于活化了这两种经典的受体,通过与位于靶标基因启动子区域的雌激素反应元件相结合而调节基因表达[3]。核雌激素受体结构具有一致性,均由5个不同的区域组成:N端转录活化域(主要与转录复合物相结合),DNA结合域(DBD)(与雌激素受体反应元件EREs相结合),铰链区(链接DBD与LBD), 配体结合域(LBD)(与配体结合),C端结构域(保护受体不被其他错误配体活化)[4]。
虽然其结构相似,但ERα和ERβ分别由6号染色体(ESR1)和14号染色体(ESR2)两种不同的基因所编码。它们在DBD和LBD中有大量的同源序列,然而在转录活化域具有不同。所以,雌激素激活两种配体后,产生的生物学反应也不尽相同[4]。
在研究中发现,雌激素受体α至少分为三种亚型,雌激素受体β至少有5种不同的亚型[5]。见表 1。与全长的ERα不同的是,其余两种ERα缺乏了N端转录活化域。由于它们能与全长的ERα形成二聚体,这样便阻碍了ERα与配体结合后的活性。与全长的ERβ不同的是,4种ERβ亚型主要由于配体结合域缺失,导致其丧失与配体结合的能力。
| 表 1 几种雌激素受体特性[5] |
有研究发现,一些细胞反应是在雌激素刺激后数秒至数分钟之内完成的。1967年,Szego和Davis[6]观察到,在去卵巢的SD大鼠中静脉注射E2,在1 min之内可以检测到大鼠子宫中cAMP含量的变化增高了数倍。1977年,Pietras和Szego在子宫内膜细胞与干细胞研究中首次发现,一种能与E2结合的,但位于胞膜的物质存在[7]。更进一步研究发现,共轭雌激素尽管不能通过细胞膜进入细胞内,与核内的ERα、ERβ相结合,但它们仍然能快速地活化MAPK/ERK通路。由此,许多研究提出存在一种能介导细胞快速信号转导的非基因雌激素受体存在可能[8]。
1997年,用cDNA技术证实,在雌激素受体阳性的乳腺癌细胞系MCF-7中发现了一个孤立的G蛋白耦联受体,命名为GPR30,后改名为GPER1。GPER1是由375个氨基酸组成的一类G蛋白耦联受体,与趋化因子受体家族有着高度的同源序列,但在给予一组趋化因子后,并没有发现GPER1受体的活化[9]。从而将GPER1排除在趋化因子受体家族之外。
一些研究证实,GPER1作为雌激素的新型受体,在许多缺乏ERα和ERβ的细胞中,具有雌激素受体活性。但其不同于经典的雌激素受体ERα和ERβ[10]。在肿瘤细胞系的研究中发现,当内源性的、具有膜通透性的配体E2存在时,不论包膜或者胞内的GPER1都可以被E2快速激活,而发挥雌激素的快速非基因调节效应[11]。也有研究发现,GPER1参与调节E2在甲状腺、子宫内膜、卵巢和雌激素受体阴性的SKBr3乳腺癌细胞系的促进细胞增殖作用。使用反义核苷酸或核糖核苷酸干扰技术,使得GPER1损耗,可以使E2介导的这些细胞增殖作用消除[12]。
2 GPER1的组织与细胞定位 2.1 GPER1在组织中的分布GPER1在机体的许多组织都有表达,包括心脏、脑、胰腺、骨骼肌、肾脏、血管和生殖器[13]。在成年小鼠和大鼠的中枢神经系统的研究中发现,在包含扣带回、感觉、运动皮层区域的皮质区和海马齿状回、CA1-3区域都有GPER1的分布。研究发现GPER1不仅在神经元,包括在胶质细胞分布的地方也有表达[14]。同时,本实验室课题组的前期研究发现,GPER1在视网膜的神经节细胞层及内核层中也有表达[15]。
而各个组织GPER1的表达量是受组织的类型、性别、年龄和疾病等因素影响的。例如,在胎盘含有丰富的GPER1,而在骨骼肌,其含量则很低。在肠系膜阻力血管中发现,GPER1的含量在同年龄的男性中更低,同时3个月大的女性要比12月大的女性中更高[16]。疾病的进程也会影响GPER1的表达,在子宫内膜异位症、女性盐负荷的肾脏疾病和肺癌中,GPER1的表达量明显升高[17]。同时也发现,在子宫肌瘤和子宫内膜异位症的患者中,GPER1的表达也是增加的[17],说明某些疾病状态可能会调整该受体表达水平。
2.2 GPER1亚细胞定位对于GPER1的亚细胞定位,一直存在争论。部分研究报道,GPER1主要分布于细胞膜上[18],在背侧纹状体的研究中发现,在无髓轴突和小轴突末端,有大量的GPER1的分布。同时在突触后结构中也发现了大量GPER1的存在于突触后密集区旁,与胞浆膜相结合[19]。然而在细胞内结构,类似于内质网及高尔基体上也有GPER1的表达,在一级树突的胞浆膜、微管、线粒体、高尔基体中都发现GPER1的存在。甚至在核内也有发现GPER1的存在[20]。此外,疾病的病理学表现可能会影响GPER1的表达定位。例如,在MCF7乳腺癌细胞系中,GPER1在核内表达,而在T47D乳腺癌细胞中则位于胞质中[21]。也有研究发现GPER1有一个基本的內吞作用,GPER1可能不仅仅局限在细胞内,而是在细胞膜和细胞内存在一个再分布过程[22]。
3 GPER1的配体GPER1的配体中,包括天然类固醇激素,如E2,其代谢产物2-羟基雌二醇。植物雌激素,如维生素B3(烟酸);染料木黄酮,大豆黄素,和其代谢产物雌马酚,白藜芦醇。抗雌激素药物,类似于他莫昔芬和雷诺昔芬等选择性雌激素受体调节剂;选择性雌激素受体阻断剂,ICI 182,780(氟维司群)。和人工合成的小分子化合物,如非选择性的PPT和MIBE,选择特异性的G1,G15。以及如双酚A和DDT等异源性雌激素[23]。这些配体与GPER1结合后,能导致GPER1的激活或抑制。
能与GPER1特异性结合的人工合成小分子化合物,G1和G15。虽然其化学结构相似,但G1拥有一个额外的乙酰基,其与GPER1结合并导致GPER1构象的变化,从而致G1上的氧原子变成空间激活状态和/或极性发生变化。所有激动型配体(G1, E2,他莫昔芬,氟维司群)与GPER1结合后均会产生氧原子的活化,而其拮抗型配体(G15,G36)则缺乏这一变化。在E2和他莫昔芬之间,除了之前提到的氧原子外,化学结构并无相似性[24]。尽管如此,E2和他莫昔芬都能激活GPER1,说明GPER1与配体结合时,对配体结构特异性要求并不严苛(图 1)。
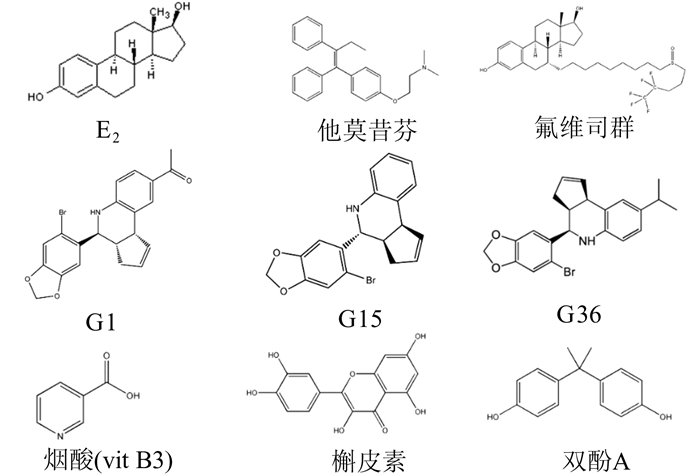
|
图 1 GPER1配体化学结构 |
在甾体激素家族中,雌激素与GPER1结合的亲和力比睾酮、皮质醇、孕激素高(>1 000倍)。GPER1与E2结合的亲和力是3-6 nmol/L,与ICI 182, 780结合的亲和力1 μmol/L[25]。G1与GPER1结合的亲和力为10 nmol/L,即使达到10 μmol/L的浓度[26],也不与ERα和ERβ结合。G15与GPER1亲和力约为20 nmol/L,且不与ER结合。
在功能上,一些抗甾体激素药物可以通过膜受体GPER1的活化来促进快速的非基因的信号通路。ICI 182, 780,作为ERα、ERβ的拮抗剂,和选择性雌激素受体调节剂他莫昔芬都发现具有激动GPER1活性。在子宫内膜癌细胞系中,缺乏ERα受体时,他莫昔芬可以通过GPER1来促进细胞迁移。此外,当给予G15或者敲除GPER1基因能够阻断ICI 182, 780这一作用[27]。
4 GPER1参与的信号通路G蛋白受体超家族是一个约有900种细胞表面分子组成大家族。G蛋白,是由与鸟嘌呤核苷酸结合的α亚单位和一个βγ亚单位二聚体组成,根据其α亚单位的序列同源性分为4种亚型(Gαs, Gαi/o, Gαq/11, Gα12/13)。在非活化状态,α亚单位与一个GDP分子相结合。当一种激动型配体与其相结合时,导致G蛋白α亚单位的构型发生变化,使得与GDP解离并与GTP相结合,同时与βγ二聚体亚单位解离。自从1997年证实了GPER1的存在后,接下来次序证明了GPER1通过非基因信号调节细胞反应。通过调节细胞内cAMP水平变化,促进细胞内的钙动员,活化PI3K转导通路,触发EGFR转录活化从而导致了ERK1/2快速磷酸化等。见图 2。
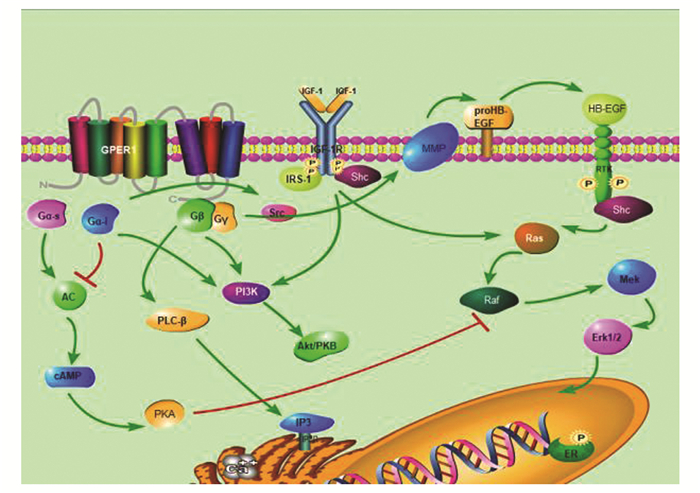
|
图 2 GPER1参与快速非基因信号转导通路图 |
在肿瘤细胞中发现,活化GPER1通过Gαs亚单位导致腺苷酸环化酶(AC)活化,从而导致cAMP水平的上调[28]。有趣的是,GPER1也可能通过与Gαi亚单位耦联[29]或者活化Gαq信号元件,从而下调cAMP的水平。GPER1也可以通过活化百日咳毒素敏感的Gai/o亚单位,从而导致磷脂酰肌醇3激酶(PI3K)的活化。有研究证明,雌激素通过GPER1介导的AC和cAMP依赖的信号通路的活化将导致Raf-1的失活,而最终导致ERK1/2活性降低[30]。然而,在另一些细胞类型中,发现cAMP具有激活ERK1/2的能力,通过促进B-raf介导的Mek-1的活化[31]。由此推断GPER1介导的cAMP对ERK1/2的活性起到了调节平衡作用。
4.2 GPER1与表皮生长因子受体(EGFR)的相互作用EGFR属于酪氨酸蛋白激酶受体家族,在调节正常细胞生长及生理活动方面起到至关重要的作用。通常,活化的EGFRs通过生物化学效应所必需的细胞内信号元件来改变细胞的结构和功能从而调节细胞反应。MAPKs, p42/44 MAPK(ERK1/2)是EGFR功能调节的至关重要的下游物质,因为它们能使众多蛋白质磷酸化,从而调节这些蛋白质的活性。
雌激素介导活化的ERK1/2通路是通过GPER1的Gβγ亚单位蛋白复合物,且需要Src的参与。利用GPER1肽端抗体,发现在人类乳腺癌细胞系MCF-7和SKBR3中,给予雌激素后,GPER1蛋白表达量增高,并且发现了ERK1/2的活化。当给予百日咳毒素或者Src家族特异性酪氨酸激酶抑制剂PP2后,该通路可被阻断。此外,在羧基端表达β肾上腺素能受体激酶bark-1(被认为是Gβγ亚单位蛋白螯合肽)的细胞中也发现该通路活化受阻。同时,在SKBR3乳腺癌细胞系(ERα、ERβ均不表达)中发现了E2能够活化的ERK1/2通路。而MDA-MB-231乳腺癌细胞系(ERα-、ERβ+)缺乏GPER1表达,对E2引起的ERK1/2通路的活化不敏感。而将带有GPER1表达基因的cDNA转染到MDA-MB-231细胞中,发现细胞过表达GPER1蛋白,并转变成了对雌激素反应敏感的表型。以上研究均说明雌激素主要通过GPER1来活化细胞内ERK1/2通路。同时也发现,E2活化ERK1/2信号通路可以被以下阻断:①抑制EGFR酪氨酸激酶活性; ②用抗体中和HB-EGF; ③用白喉毒素突变体CRM-197结合到细胞表面来下调HB-EGF[32]。说明GPER1通过Gβγ亚单位促进细胞表面的pro-HB-EGF释放,并与EGFR相结合而引起的转录活化,从而触发快速的/短暂的MAPKs、细胞外信号调节激酶ERK的活化[30]。
4.3 GPER1调节细胞内Ca2+水平GPER1可以通过多种途径升高细胞内的Ca2+。在雌激素受体阳性的MCF-7细胞中通过与IP3Rs耦联,而在雌激素受体阴性的SKBR3细胞系中,与RyRs相耦联,从而促进胞膜和/或内质网上Ca2+通道开放,而升高细胞内Ca2+水平[12]。在COS-7细胞系的研究中发现百日咳毒素通过激活GPER1的Gai/o亚单位,可以抑制细胞内Ca2+水平的升高。有趣的是,在SKBR3细胞系研究中发现,GPER1通过短暂的升高胞浆中的Ca2+水平,对细胞生长起到促进作用。而在MCF-7细胞系中,GPER1通过持续的增加胞浆中的Ca2+浓度导致细胞增殖受抑制,甚至导致细胞凋亡[33]。而短暂或持续触发的Ca2+反应可能与不同因素参与了胞质中低浓度Ca2+从胞浆膜或是内质网的钙泵释放Ca2+有关。
4.4 GPER1与IGF信号系统相互作用胰岛素样生长因子1受体(IGF-1R)转导通路和G蛋白耦联受体介导的信号通路之间有许多联系。例如,IGF-1R和Gα与Gβγ亚单位间的相互作用与乳腺癌的转移有关。IGF-1R表达缺失与形成对他莫昔芬抵抗的乳腺癌是相关的[34]。此外,IGF-1和GPCRs的激动剂相互作用可以促进胰腺肿瘤细胞DNA的合成、增殖和非贴壁生长。在ER阳性的乳腺癌细胞和子宫内膜癌细胞中,IGF-1可以通过IGF-1R/PKC/MAPK转导通路来调节GPER1的表达和功能。而同时,IGF-1又可以通过GPER1和其目标基因CTGF来刺激细胞的迁移,且通过GPER1和细胞周期蛋白D1的表达来促进细胞增殖[35]。因此,GPCRs和IGF-1之间的相互作用是一个十分复杂的过程。
综上所述,GPER1作为雌激素新型的膜相关受体,在结构、亚细胞定位以及功能等方面与传统的雌激素受体ERα和ERβ有着许多不同。GPER1主要在改变细胞内第二信使的含量及调节蛋白质磷酸化水平方面起作用,主要参与细胞的快速非基因信号调节通路。不论在肿瘤细胞还是正常神经系统等组织均已证实,GPER1可以通过激活上述通路的变化,促进细胞生长、增殖、对抗凋亡。由于技术的进步,GPER1特异性的新型人工合成小分子化合物G1与G15的合成应用,也极大地深入了对GPER1功能的探究。本课题组前期研究发现GPER1在视网膜中有表达,且通过特异性激活GPER1能够对抗小鼠青光眼模型中神经节细胞的凋亡。这些发现,让我们猜想,在未来的临床工作中,能否将GPER1特异性激动剂G1作为眼科抗青光眼神经节细胞损伤药物而应用于临床呢?其有待于我们的进一步探索研究。
| [1] | Prossnitz ER, Barton M. The G-protein-coupled estrogen receptor GPER in health and disease[J]. Nat Rev Endocrinol, 2011, 7(12): 715-726. DOI: 10.1038/nrendo.2011.122. |
| [2] | Soloff MS, Szego CM. Purification of estradiol receptor from rat uterus and blockade of its estrogen-binding function by specific antibody[J]. Biochem Biophys Res Commun, 1969, 34(1): 141-147. DOI: 10.1016/0006-291X(69)90540-3. |
| [3] | Kuiper GG, Enmark E, Pelto-Huikko M, et al. Cloning of a novel receptor expressed in rat prostate and ovary[J]. Proc Natl Acad Sci USA, 1996, 93(12): 5925-5930. DOI: 10.1073/pnas.93.12.5925. |
| [4] | Borahay MA. Estrogenreceptors and signaling in fibroids: role in pathobiology and therapeutic implications[J]. Reprod Sci, 2017, 24(9): 1235-1244. DOI: 10.1177/1933719116678686. |
| [5] | Vrtanik P, Ostanek B, Mencej-Bedra S, et al. The many faces of estrogen signaling[J]. Biochem Medica, 2014, 24(3): 329-342. DOI: 10.11613/issn.1846-7482. |
| [6] | Szego CM, Davis JS. Adenosine 3', 5'-monophosphate in rat uterus: Acute elevation by estrogen[J]. Proc Natl Acad Sci USA, 1967, 58(4): 1711-1718. DOI: 10.1073/pnas.58.4.1711. |
| [7] | Pietras RJ, Szego CM. Specific binding sites for oestrogen at the outer surfaces of isolated endometrial cells[J]. Nature, 1977, 265(5589): 69-72. DOI: 10.1038/265069a0. |
| [8] | Vasudevan N, Pfaff DW. Membrane-initiated actions of estrogens in neuroendocrinology: Emerging principles[J]. Endocr Rev, 2007, 28(1): 1-19. DOI: 10.1210/er.2005-0021. |
| [9] | Owman C, Blay P, Nilsson C, et al. Cloning of human cDNA encoding a novel heptahelix receptor expressed in Burkitt's lymphoma and widely distributed in brain and peripheral tissues[J]. Biochem Biophys Res Commun, 1996, 228(2): 285-292. DOI: 10.1006/bbrc.1996.1654. |
| [10] | Revankar CM, Cimino DF, Sklar LA, et al. A transmembrane intracellular estrogen receptor mediates rapid cell signaling[J]. Science, 2005, 307(5715): 1625-1630. DOI: 10.1126/science.1106943. |
| [11] | Srivastava DP, Evans PD. G-protein oestrogen receptor 1: Trials and tribulations of a membrane oestrogen receptor[J]. Neuroendocrinol, 2013, 25(11): 1219-1230. DOI: 10.1111/jne.2013.25.issue-11. |
| [12] | Ariazi EA, Brailoiu E, Yerrum S, et al. The G protein-coupled receptor GPR30 inhibits proliferation of estrogen receptor-positive breast cancer cells[J]. Cancer Res, 2010, 70(3): 1184-1194. DOI: 10.1158/0008-5472.CAN-09-3068. |
| [13] | Olde B, Leeb-Lundberg LMF. GPR30/GPER1: searching for a role in estrogen physiology[J]. Trends Endocrinol Metab, 2009, 20(8): 409-416. DOI: 10.1016/j.tem.2009.04.006. |
| [14] | Hammond R, Nelson D, Gibbs RB. GPR30 co-localizes with cholinergic neurons in the basal forebrain and enhances potassium-stimulated acetylcholine release in the hippocampus[J]. Psychoneuroendocrinology, 2011, 36(2): 182-192. DOI: 10.1016/j.psyneuen.2010.07.007. |
| [15] |
江梦南, 罗雪, 沈雨濛, 等. 雌激素受体GPR30介导的小鼠视网膜神经节细胞保护作用[J].
武汉大学学报:医学版, 2016, 37(2): 195-199.
Jiang MN, Luo X, Shen YM, et al. Neuroprotection of Estrogen receptor GPR30 in retinal ganglion cell[J]. Medical Journal of Wuhan University, 2016, 37(2): 195-199. |
| [16] | Lindsey SH, da Silva AS, Silva MS, et al. Reduced vasorelaxation to estradiol and G-1 in aged female and adult male rats is associated with GPR30 downregulation[J]. Am J Physiol Endocrinol Metab, 2013, 305(1): E113-E118. DOI: 10.1152/ajpendo.00649.2012. |
| [17] | Plante BJ, Lessey BA, Taylor RN, et al. G protein-coupled estrogen receptor (GPER) expression in normal and abnormal endometrium[J]. Reprod Sci, 2012, 19(7): 684-693. DOI: 10.1177/1933719111431000. |
| [18] | Akama KT, Thompson LI, Milner TA, et al. Post-synaptic density-95 (PSD-95) binding capacity of G-protein-coupled receptor 30 (GPR30), an estrogen receptor that can be identified in hippocampal dendritic spines[J]. Biol Chem, 2013, 288(9): 6438-6450. DOI: 10.1074/jbc.M112.412478. |
| [19] | Almey A, Filardo EJ, Milner TA, et al. Estrogen receptors are found in glia and at extranuclear neuronal sites in the dorsal striatum of female rats: Evidence for cholinergic but not dopaminergic colocalization[J]. Endocrinology, 2012, 153(11): 5373-5383. DOI: 10.1210/en.2012-1458. |
| [20] | Pupo M, Vivacqua A, Perrotta I, et al. The nuclear localization signal is required for nuclear GPER translocation and function in breast Cancer-Associated Fibroblasts (CAFs)[J]. Mol Cell Endocrinol, 2013, 376(1-2): 23-32. DOI: 10.1016/j.mce.2013.05.023. |
| [21] | Samartzis EP, Noske A, Meisel A, et al. The G protein-coupled estrogen receptor (GPER) is expressed in two different subcellular localizations reflecting distinct tumor properties in breast cancer[J]. PLoS One, 2014, 9(1): e83296. DOI: 10.1371/journal.pone.0083296. |
| [22] | Wang C, Liu Y, Cao JM. G protein-coupled receptors: Extranuclear mediators for the non-genomic actions of steroids[J]. Mol Sci, 2014, 15(9): 15412-15425. DOI: 10.3390/ijms150915412. |
| [23] | Barton M. Not lost in translation: Emerging clinical importance of the G protein-coupled estrogen receptor GPER[J]. Steroids, 2016, 111: 37-45. DOI: 10.1016/j.steroids.2016.02.016. |
| [24] | Méndez-Luna D, Martínez-Archundia M, Maroun RC, et al. Deciphering the GPER/GPR30-agonist and antagonists interactions using molecular modeling studies, molecular dynamics, and docking simulations[J]. Biomol Struct Dyn, 2015, 33(10): 2161-2172. DOI: 10.1080/07391102.2014.994102. |
| [25] | Prossnitz ER, Arterburn JB. Internationalunion of basic and clinical pharmacology. XCVII. G protein-coupled estrogen receptor and its pharmacologic modulators[J]. Pharmacol Rev, 2015, 67(3): 505-540. DOI: 10.1124/pr.114.009712. |
| [26] | Dennis MK, Field AS, Burai R, et al. Identification of a GPER/GPR30 antagonist with improved estrogen receptor counterselectivity[J]. Steroid Biochem Mol Biol, 2011, 127(3-5): 358-366. DOI: 10.1016/j.jsbmb.2011.07.002. |
| [27] | Ruiz-Palmero I, Hernando M, Garcia-Segura LM, et al. G protein-coupled estrogen receptor is required for the neuritogenic mechanism of 17β-estradiol in developing hippocampal neurons[J]. Mol Cell Endocrinol, 2013, 372(1-2): 105-115. DOI: 10.1016/j.mce.2013.03.018. |
| [28] | Lindsey SH, Liu L, Chappell MC. Vasodilation by GPER in mesenteric arteries involves both endothelial nitric oxide and smooth muscle cAMP signaling[J]. Steroids, 2014, 81: 99-102. DOI: 10.1016/j.steroids.2013.10.017. |
| [29] | Broselid S, Berg KA, Chavera TA, et al. G protein-coupled receptor 30 (GPR30) forms a plasma membrane complex with membrane-associated guanylate kinases (MAGUKs) and protein kinase a-anchoring protein 5 (AKAP5) that constitutively inhibits cAMP production[J]. Biol Chem, 2014, 289(32): 22117-22127. DOI: 10.1074/jbc.M114.566893. |
| [30] | Filardo EJ, Quinn JA, Frackelton AR, et al. Estrogen action via the G protein-coupled receptor, GPR30: Stimulation of adenylyl cyclase and cAMP-mediated attenuation of the epidermal growth factor receptor-to-MAPK signaling axis[J]. Mol Endocrinol, 2002, 16(1): 70-84. DOI: 10.1210/mend.16.1.0758. |
| [31] | Vossler MR, Yao H, York RD, et al. cAMP activates MAP kinase and Elk-1 through a B-Raf- and Rap1-dependent pathway[J]. Cell, 1997, 89(1): 73-82. DOI: 10.1016/S0092-8674(00)80184-1. |
| [32] | Filardo EJ, Quinn JA, Bland KI, et al. Estrogen-induced activation of Erk-1 and Erk-2 requires the G protein-coupled receptor homolog, GPR30, and occurs via trans-activation of the epidermal growth factor receptor through release of HB-EGF[J]. Mol Endocrinol, 2000, 14(10): 1649-1660. DOI: 10.1210/mend.14.10.0532. |
| [33] | Pinton P, Giorgi C, Siviero R, et al. Calcium and apoptosis: ER-mitochondria Ca2+ transfer in the control of apoptosis[J]. Oncogene, 2008, 27(50): 6407-6418. DOI: 10.1038/onc.2008.308. |
| [34] | Vaziri-Gohar A, Houston KD. GPER1-mediated IGFBP-1 induction modulates IGF-1-dependent signaling in tamoxifen-treated breast cancer cells[J]. Mol Cell Endocrinol, 2016, 422: 160-171. DOI: 10.1016/j.mce.2015.11.033. |
| [35] | De Marco P, Bartella V, Vivacqua A, et al. Insulin-like growth factor-Ⅰ regulates GPER expression and function in cancer cells[J]. Oncogene, 2013, 32(6): 678-688. |
 2018, Vol. 39
2018, Vol. 39


