食管癌目前在我国仍然是发病率及病死率均较高的恶性肿瘤之一,根治性外科手术是食管癌患者重要的治疗手段[1]。随着技术的进步,食管癌患者的远期预后已较前明显提高,但总的5年生存率仍仅有15%-40%[2]。由于食管癌根治术本身的特点,围术期并发症发生率仍然较高,这对患者围术期死亡率、住院天数、生活质量、费用等均会出现显著的影响。但是,围术期并发症是否会对食管癌患者远期预后,如长期生存率、无复发生存等是否有影响,目前国内外学术界尚未达成共识。故我们将2012年1月-2013年12月收治的食管癌手术患者进行回顾性研究,分析出现围术期并发症是否会对患者的远期肿瘤结局出现影响。
1 资料与方法 1.1 临床资料对于2012年1月-2013年12月在我科收治的食管癌手术患者进行资料收集,按照统一信息收集表对患者的姓名、性别、年龄、病理类型、TNM分级、分化程度及是否出现围术期并发症等汇总数据,建立数据库。
1.2 手术治疗术前所有患者均经胃镜或超声胃镜活组织检查确诊为食管癌,并常规进行头部CT、颈腹部超声、上消化道钡餐等检查排除转移等。下段食管癌采用Sweet术式,中段食管癌采用Ivor-Lewis术式,上段食管行McKeown术式。本组患者无胸腹腔镜手术病例。手术采用常规胸、腹部二野淋巴结清扫,并常规放置十二指肠营养管或空肠造瘘。若胸部CT或颈部超声提示淋巴结肿大,则请耳鼻咽喉科医师协助行颈部淋巴结清扫。
1.3 并发症分级标准为了更好地对围术期并发症进行定义和分级,我们采用国际通用的改良Clavien-Dindo分级系统(表 1)[3]。该系统可适用于所有的外科手术,用于评估手术风险及质量,具体可分为6级。详见表 1。临床常见的Ⅱ级并发症有肺部感染、房颤、治疗性输血、切口感染、功能性胃排空障碍、未行有创干预的吻合口瘘等。常见的Ⅲ级并发症有需引流的气胸或胸腔积液、脓胸、气管切开、纤支镜或胃镜介入操作、全麻下开胸止血、吻合口瘘修补、胃扭转修复等手术。常见的Ⅳ级并发症有单发或多发的器官衰竭,如呼吸衰竭、心肌梗塞、脑卒中、肾功能衰竭等。
| 表 1 改良Clavien-Dindo围术期并发症分级系统 |
所有患者术后第3, 6, 9, 12个月及后续每半年门诊或住院复查一次。视情况行胸片、胸部CT、胃镜、超声内镜、PET-CT等检查。随访截止日期为2016年3月31日。肿瘤复发需结合胸外科及肿瘤科医师意见,依据临床症状、实验室检查、影像学资料、必要时活检等来诊断。
1.5 统计学分析统计分析采用SPSS 20.0软件进行处理,通过t检验和卡方检验分别比较计量资料和计数资料的差异,就肿瘤复发进行Logistic单因素和多因素回归分析。应用Kaplan-Meier生存分析探讨长期无复发生存的情况。P < 0.05表示差异有统计学意义。
2 结果 2.1 临床资料2012年1月-2013年12月在我科收治的食管癌手术患者共229名,其中术后成功随访的患者共177名纳入本次研究。临床资料见表 2。
| 表 2 患者的临床基线资料 |
术后发生ClavienⅡ级及以上并发症患者110(62.1%)例,其中Ⅱ级患者62例,Ⅲ级患者36例,Ⅳ级患者12例。
2.3 食管癌复发情况患者随访(28.0±11.3)月,共有88(49.7%)例患者出现复发,其中颈部或纵隔淋巴结复发47例,吻合口(包括残留食管)复发10例,肺转移11例,脑转移5例,骨转移7例,肝、肺等多脏器转移8例。
2.4 食管癌复发的危险因素通过单因素回归分析,提示手术方式、肿瘤浸润深度、淋巴结转移、神经脉管侵犯、淋巴结个数、吻合口残端阳性及术后并发症≥ClavienⅡ级为术后肿瘤复发的危险因素(见表 3)。多因素回归分析提示神经脉管侵犯(OR=2.82, 1.28-4.77)、吻合口残端阳性(OR=6.69, 1.68-24.12)、早期食管癌(pT1N0M0)(OR=0.19, 0.04-0.78)及术后并发症≥ClavienⅡ级(OR=3.68,1.88-9.42)为影响食管癌复发的因素(表 3)。
| 表 3 食管癌术后远期复发的单因素分析 |
根据术后并发症是否≥ClavienⅡ级绘制关于无复发生存的生存曲线(图 1),行Log Rank检验提示两组存在显著的统计学差异(P=0.005)。总的24个月无复发生存率,无明显并发症组( < Clavien Ⅱ级)为82.1%,而有显著并发症组(≥Clavien Ⅱ级)则仅为56.4%。
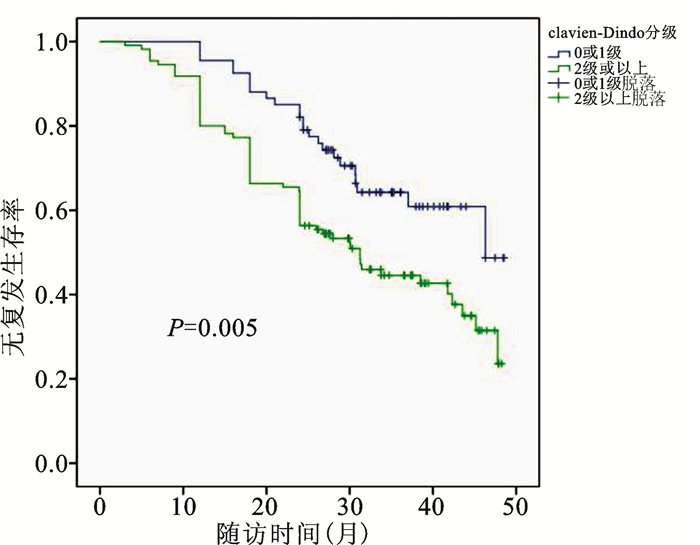
|
图 1 依据术后并发症是否≥Clavien Ⅱ级分组的患者生存曲线 |
随着诊断及治疗方法的进步,食管癌围术期死亡率已从上世纪的30%下降到现在的5%以内[4]。然而,食管癌术后并发症的发生率仍然较高,主要包括胸腔肺部并发症及吻合口并发症。围术期并发症会严重影响患者术后的康复过程,甚至造成严重感染、多器官功能衰竭,导致死亡。食管癌远期的生存率同样不甚理想,主要取决于手术是否为姑息手术(肿瘤残留)及术后的病理分期[5]。而食管癌围术期并发症是否会对远期预后产生影响,国内外研究较少,且未有共识意见。本研究通过回顾性分析证实围术期并发症会影响患者的远期预后,缩短无复发生存。因为本研究随访时间较短,故未纳入术后全因死亡率及肿瘤事件相关死亡率等指标。
术后并发症对远期肿瘤结局的影响探讨由来已久。早在20世纪六七十年代,即有肺癌术后并发脓胸的患者表现出较高的5年生存率的报道[6]。国内1991年山西肿瘤医院邢守正等随访了16例食管癌术后吻合口瘘而痊愈出院的患者,结果发现发生吻合口瘘而又痊愈的病人其5年生存率明显高于同期未出现瘘的病人(50% vs 36.9%,P < 0.01)[7]。而另一部分学者则提出完全相反的观点。如Hirai等在1998年研究205例食管癌术后患者,分为无并发症组、轻微并发症组及严重并发症组,结果三组患者的5年生存率分别为46.7%、32.3%和22.5%(P=0.016),发生并发症的患者,其远期生存率反而降低[8]。
食管癌患者围术期的并发症主要有手术相关并发症(如吻合口瘘、乳糜胸、伤口感染等)和内科并发症(如肺部感染、心律失常等)。文献中关于并发症和预后的研究,多按照自己的定义进行并发症分组,这样文献间的可比性会大大下降。而本文采用国际通用的Clavien-Dindo分级系统,将发生的并发症进行系统分级,对于需要特殊药物或手术干预的并发症,归为发生明显并发症组,更加具有科学性和文献间的可比性。
近些年来,术后并发症对消化道肿瘤远期影响的探讨越来越多。在结直肠癌、胃癌等大量文献,包括Meta分析中,均支持术后外科及炎性并发症会增加局部肿瘤复发及降低远期生存[9, 10]。在食管癌中,文献报道相对较少,且结论未达成一致[11, 12]。
本研究通过回顾性分析支持围术期并发症会影响患者的远期预后,缩短无复发生存期。其可能的机制有:①术后并发症,如吻合口瘘、肺部感染、二次手术等,均会增加全身炎症反应,导致免疫系统紊乱或受损,引起肿瘤的播散或远处血行转移[13];②术后并发症会显著延长患者的术后恢复时间,造成下一步辅助治疗的延时或因全身状态太差放弃辅助治疗,导致远期肿瘤容易复发[14];③术后并发症会降低患者的一般状态及全身状况,影响患者术后的恢复;④术后并发症对患者的心理影响同样不可忽视。
食管癌术后炎性并发症、外科手术的应激与术后身体内的残存肿瘤细胞有着密切的关系。Orr等提出在术后的炎性反应中,如白细胞或巨噬细胞,会产生超氧自由基、过氧化氢等,会造成内皮细胞损伤,随后导致肿瘤细胞转移[15]。除了自由基,术后炎性反应亦会产生白细胞介素-1(interleukin-1, IL-1)、IL-6、IL-8、肿瘤坏死因子等,这些细胞因子会刺激肿瘤细胞的增殖及促进细胞的迁移扩散,影响肿瘤的预后[16]。Matsuda等探讨了食管癌术后系统炎症反应与远期生存的关系,结果发生术后严重全身炎症反应是远期总生存率的独立预后危险因素(HR=2.019, P=0.019)[17]。
综上所述,食管癌围术期并发症与远期预后存在一定的负性影响。肿瘤浸润深度、淋巴结转移、神经脉管侵犯、吻合口残端阳性及术后并发症为术后肿瘤复发的危险因素。其中术后并发症≥ClavienⅡ级是食管癌远期复发的独立预测因子。因此,我们应尽可能通过术前详尽准备,术中精细操作等减少食管癌术后并发症;而对于围术期出现严重并发症后治愈的患者,应积极完成辅助治疗,并注意重点随访跟踪。
| [1] |
张思维, 张敏, 李光琳, 等. 2003-2007年中国食管癌发病与死亡分析[J].
中国肿瘤, 2012, 21(4): 241-247.
Zhang SW, Zhang M, Li GL, et al. Ananlysis of incidence and mortality of esophageal cancer in China[J]. China Cancer, 2012, 21(4): 241-247. |
| [2] | Makowiec F, Baier P, Kulemann B, et al. Improved long-term survival after esophageactomy for esophageal cancer: influence of epidemiologic shift and neoadjuvant therapy[J]. J Gastrointest Surg, 2013, 17(7): 1193-1201. DOI: 10.1007/s11605-013-2212-7. |
| [3] | Clavien PA, Barkun J, de Oliveira ML, et al. The Clavien-Dindo classification of surgical complications-five-year experience[J]. Ann Surg, 2009, 250(2): 187-196. DOI: 10.1097/SLA.0b013e3181b13ca2. |
| [4] | Law S, Wong J. The current management of esophageal cancer[J]. Adv Surg, 2007, 41: 93-119. DOI: 10.1016/j.yasu.2007.05.007. |
| [5] | Rice TW, Zuccaro GJr, Adelstein DJ, et al. Role of clinically determined depth of tumor invasion in the treatment of esophageal carcinoma[J]. J Thorac Cardiovasc Surg, 2003, 125(5): 1091-1102. DOI: 10.1067/mtc.2003.404. |
| [6] | Ruckdeschel JC, Codish SD, Stranahan A, et al. Postoperative empyema improves survival in lung cancer[J]. N Engl J Med, 1972, 287(20): 1013-1017. DOI: 10.1056/NEJM197211162872004. |
| [7] |
邢守正, 刘富才, 郝松梅. 食管贲门癌术后吻合口瘘致脓胸对生存的影响[J].
山西医药杂志, 1991, 20(6): 329-330.
Xing SZ, Liu FC, Hao SM. Effect of pyothorax following anastomotic fistula on the survival of esophagocardial cancer patients after operation[J]. Shanxi Medical Journal, 1991, 20(6): 329-330. |
| [8] | Hirai T, Yamashita Y, Musaki K, et al. Poor prognosis in esophageal cancer patients with postoperative complications[J]. Surg Today, 1998, 28(6): 576-579. DOI: 10.1007/s005950050187. |
| [9] | Mirnezami A, Mirnezami R, Chandrakumaran, et al. Increased local recurrence and reduced survival from colorectal cancer following anastomotic leak: systematic review and meta-analysis[J]. Ann Surg, 2011, 253(5): 890-899. DOI: 10.1097/SLA.0b013e3182128929. |
| [10] | Sierzega M, Kolodziejczyk P, Kulig J, Polis Gastric Cancer Study Grouph. Impact of anastomotic leakage on long-term survival after total gastrectomy for carcinoma of the stomach[J]. Br J Surg, 2010, 97(7): 1035-1042. DOI: 10.1002/bjs.7038. |
| [11] | Lagarde SM, de Boer JD, ten Kate FJW, et al. Postoperative complications after esophagectomy for adenocarcinoma of the esophagus are related to timing of death due to recurrence[J]. Ann Surg, 2008, 247(1): 71-76. DOI: 10.1097/SLA.0b013e31815b695e. |
| [12] | Lindner K, Fritz M, Haane C, et al. Postoperative complications do not affect long-term outcome in esophageal cancer patients[J]. World J Surg, 2014, 38(10): 2652-2661. DOI: 10.1007/s00268-014-2590-3. |
| [13] | Wu Y, Zhou BP. Inflammation:a driving force speeds cancer metastasis[J]. Cell Cycle, 2009, 8(20): 3267-3273. DOI: 10.4161/cc.8.20.9699. |
| [14] | Krarup PM, Nordholm-Carstensen A, Jorgensen LS, et al. Anastomotic leak increases distant recurrence and long-term mortality after curative resection for colonic cancer: a nationwide cohort study[J]. Ann Surg, 2014, 259(5): 930-938. DOI: 10.1097/SLA.0b013e3182a6f2fc. |
| [15] | Orr FW, Adamson IYQ, Warner D, et al. The effect of oxygen radical-mediated pulmonary endothelial damage on cancer metastasis[J]. Mol Cell Biochem, 1988, 84(2): 189-198. DOI: 10.1007/BF00421054. |
| [16] | Germano G, Allavena P, Mantovani A. Cytokines as a key component of cacner-related inflammation[J]. Cytokine, 2008, 43(3): 374-379. DOI: 10.1016/j.cyto.2008.07.014. |
| [17] | Matsuda S, Takeuchi H, Kawakubo H, et al. Correlation between intense postoperative imflammatory response and survival of esophageal cancer patients who underwent transthoracic esophageactomy[J]. Ann Surg Oncol, 2015, 22(13): 4453-4460. DOI: 10.1245/s10434-015-4557-5. |
 2017, Vol. 38
2017, Vol. 38

 ,
,