慢性阻塞性肺疾病 (chronic obstructive pulmonary disease, COPD) 是一种多种炎症细胞及炎症介质参与的复杂的慢性气道炎症性疾病[1, 2],以持续存在气流受限为主要特征,呈慢性进行性加重,严重危害人类健康,但其发病机制复杂且尚不完全明确。近年来有学者认为COPD是一种由吸烟触发的具有自身免疫反应性特征的炎症性疾病[3, 4],并已有相关研究证实[5-7]。调节性T细胞 (Treg) 是一类具有免疫调节功能的T细胞亚群,其所介导的免疫调节作用是维持自身免疫耐受的关键。已有研究表明Treg数量减少或功能缺陷与多种自身免疫性疾病的发生密切相关。因此理论上Treg细胞在COPD发病过程中应该发挥重要作用,但其数量和功能变化仍缺乏规范的实验研究。本研究通过烟熏C57BL/6 Foxp3-GFP knock-in小鼠 (该小鼠Foxp3+的细胞均为GFP荧光,因此便于分离CD4+Foxp3+T细胞) 建立小鼠肺气肿模型,然后通过流式染色观察小鼠肺气肿模型中支气管肺泡灌洗液、肺组织、纵隔淋巴结、脾脏中Treg细胞、CD4+T细胞、CD8+T细胞、CD4+CD69+T细胞、CD8+ CD69+T细胞的数量变化来进一步阐述小鼠肺气肿模型中的淋巴细胞变化及Treg细胞在其中的作用。
1 材料与方法 1.1 实验对象C57BL/6 Foxp3-GFP knock-in小鼠18只,周龄6-8周,体重选择在20-25 g,由武汉大学人民医院实验动物中心提供。
1.2 所需抗体抗小鼠CD4单克隆抗体:PE anti-mouse CD4,购自BD公司,抗小鼠CD8单克隆抗体:PerCP-CyTM 5.5 anti-mouse CD8a,购自BD公司,抗小鼠CD69单克隆抗体:APC anti-mouse CD69,购自eBioscience公司。
1.3 动物模型的建立将吸烟组小鼠暴露于自制烟熏箱里,每天烟熏4 h,每周烟熏5 d,连续24周,烟熏箱内最佳的烟雾/空气的比是1:6,烟熏期间使用医用氧舱测氧仪监测舱内氧浓度使其不低于18%,正常对照组小鼠置入空气清洁的房间。
1.4 HE染色24周后将吸烟组及非吸烟组小鼠以90 mg/kg腹腔注射3%戊巴比妥钠麻醉小鼠,麻醉后打开腹腔放血,继而打开胸腔,立即结扎右肺,以4%多聚甲醛固定24 h以上后进行固定、包埋、切片、HE染色,将完成染色的组织切片置于光学显微镜下观察并拍照。
1.5 流式染色将小鼠肺泡灌洗液、脾脏、纵隔淋巴结和肺组织的单细胞悬液调整细胞浓度为106个/100 μl,将各组织单细胞悬液100 μl加入相应的离心管中,每管加入相应的流式抗体:PE anti-mouse CD4 0.5 μl,PerCP-CyTM 5.5 anti-mouse CD8a 0.5 μl,APC anti-mouse CD69 0.5 μl,经避光孵育、冲洗、离心后弃上清,每管加入300 μl 1%多聚甲醛重悬细胞 (支气管肺泡灌洗液使用200 μl 1%多聚甲醛重悬细胞),置于流式管内,24 h内上机检测。
1.6 流式图谱分析将上述标本上流式细胞仪分析,将所得到的流式图谱运用Portable Flowjo 7.6软件进行分析绘图,具体分析方法如下:在各组织的单细胞悬液的所有细胞中筛选出淋巴细胞;在筛选的淋巴细胞中筛选出CD4+T细胞和CD8+T细胞;在筛选出的CD4+T细胞中筛选出CD4+Foxp3+T细胞,即Treg细胞和CD4+CD69+T细胞,同理在筛选出的CD8+T细胞中筛选出CD8+CD69+T细胞。
1.7 统计学处理使用SPSS 19.7软件进行统计学分析。数据以x±s的形式表示,均数的比较以独立样本的t检验处理,以P<0.05为差异有统计学意义。
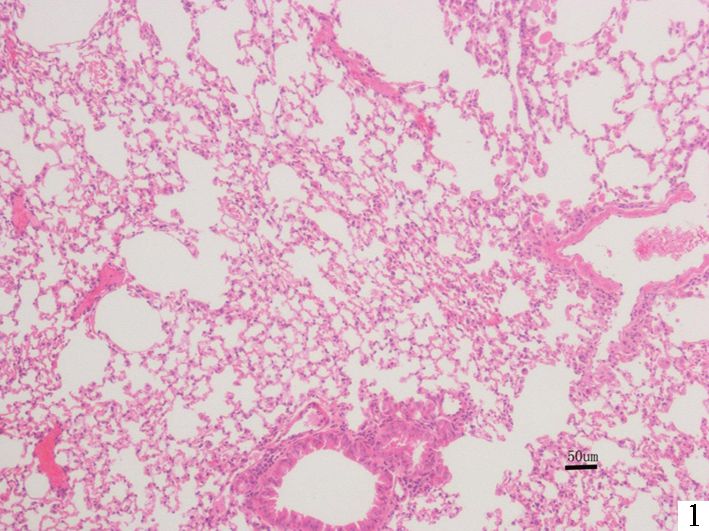
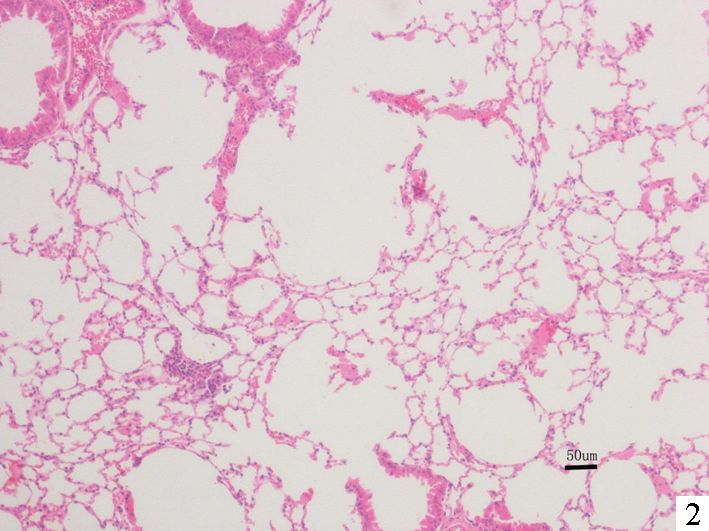
2 结果 2.1 HE染色光镜下可见吸烟组肺泡扩张,部分相邻肺泡融合成大的囊腔,肺泡间隔变窄,部分断裂,间隔内毛细血管床减少,支气管壁及肺泡间隔内可见较多的炎性细胞浸润,杯状细胞增多,纤毛上皮脱落,纤毛减少;而对照组肺泡结构正常,纤毛上皮完整,未见明显腺体增生及炎症细胞浸润,提示吸烟组小鼠有明显肺气肿形成 (见图 1、图 2)。
|
图 1 24周后对照组小鼠肺组织的病理切片 (HE染色×400) |
|
图 2 24周后吸烟组小鼠肺组织的病理切片 (HE染色×400) |
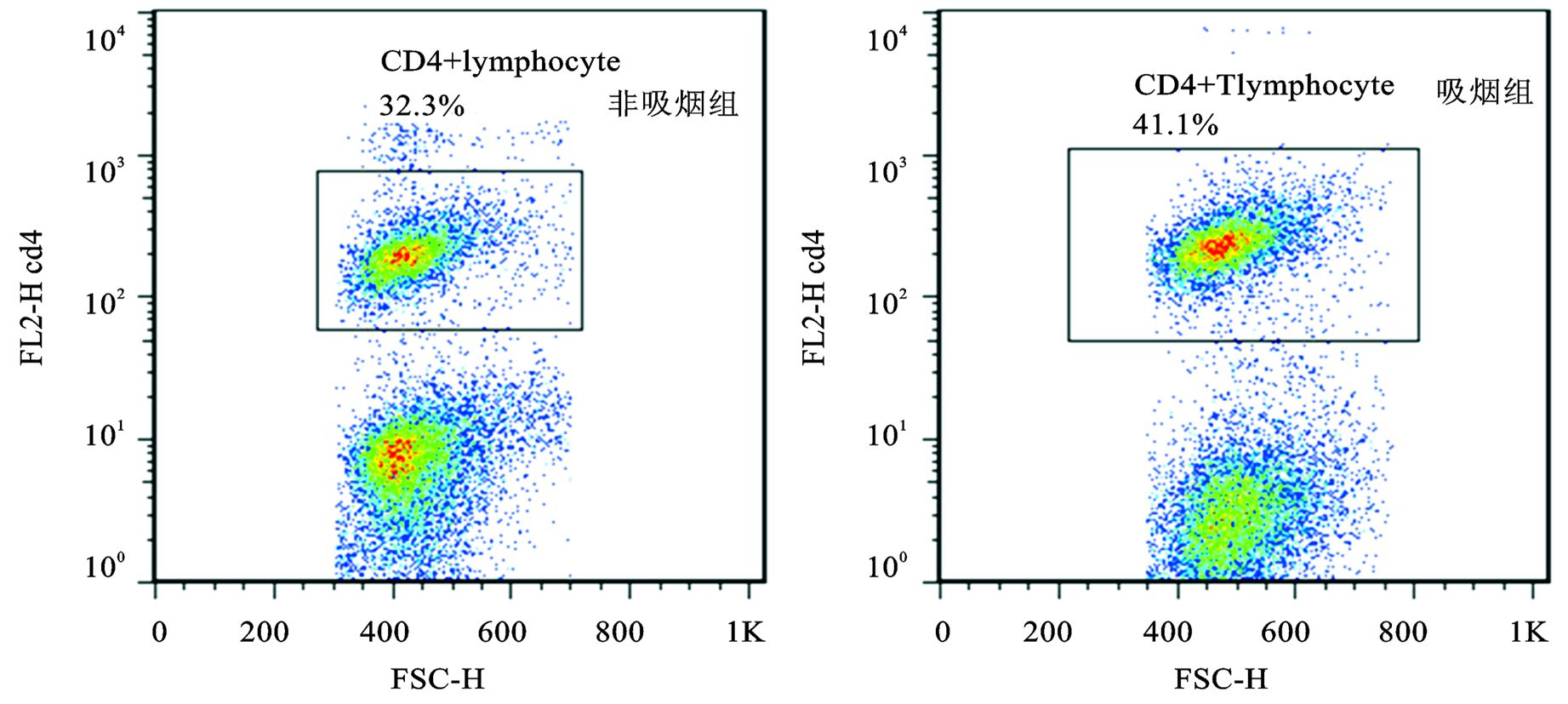
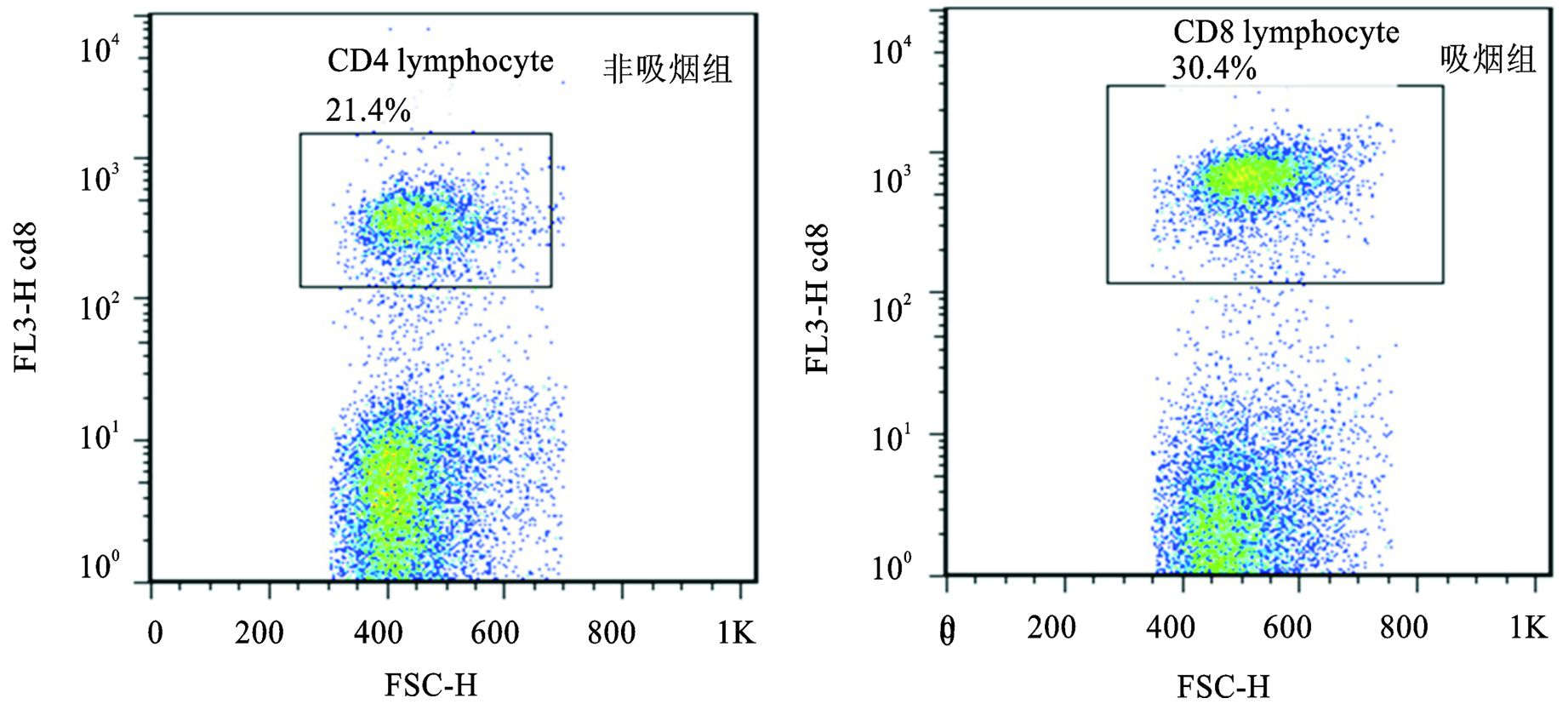
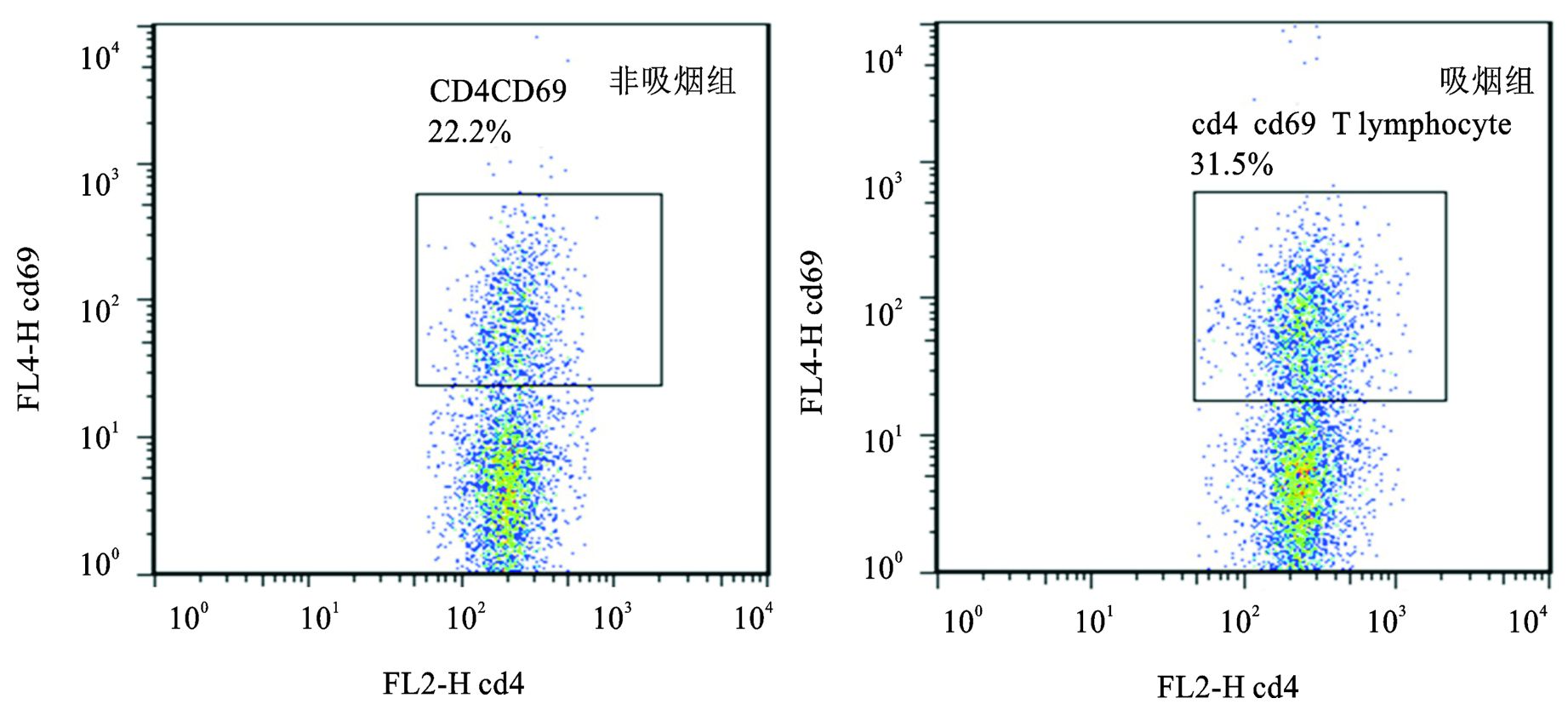
吸烟组小鼠肺组织、纵隔淋巴结和支气管肺泡灌洗液中CD4+T细胞的数量 (%淋巴细胞)、CD8+T细胞的数量 (%淋巴细胞) 及其活化细胞 (CD4+CD69+T细胞和CD8+CD69+T细胞) 的数量明显高于非吸烟组小鼠,差异有统计学意义 (P<0.05),而两组小鼠脾脏中上述细胞数量无明显差异 (P>0.05)(见表 1),其中CD4+细胞、CD8+细胞、CD4+CD69+细胞的流式图谱见图 3、图 4、图 5(以纵隔淋巴结为例)。
|
图 3 吸烟组和对照组小鼠纵隔淋巴结中CD4+T 细胞数量比较的流式图谱 |
|
图 4 吸烟组和对照组小鼠纵隔淋巴结中 CD8+T细胞数量比较的流式图谱 |
|
图 5 吸烟组和对照组小鼠纵隔淋巴结中 CD4+CD69+T细胞数量比较的流式图谱 |
| 表 1 吸烟鼠和非吸烟鼠各组织CD4+T细胞、CD8+T细胞及其活化细胞数量比较 |
而与非吸烟组小鼠比较,吸烟组小鼠肺组织、纵隔淋巴结和支气管肺泡灌洗液中Treg的数量 (%CD4+T细胞)、明显增多,差异有统计学意义 (P<0.05),而Treg数量在两组小鼠脾脏中无明显差异 (P>0.05)(见表 2),具体流式图谱见图 6(以纵隔淋巴结为例)。
| 表 2 吸烟鼠和非吸烟鼠各组织Treg细胞数量比较 (%CD4+T细胞) |

|
图 6 吸烟组和对照组小鼠纵隔淋巴结中 Treg细胞数量比较的流式图谱 |
慢性阻塞性肺疾病 (COPD) 是一种慢性进展的气道炎症性疾病,以往研究表明多种炎症细胞浸润及炎性介质释放参与COPD的发病过程。本研究发现烟熏24周后小鼠肺组织的病理染色可以见到典型肺气肿的病理表现,且吸烟鼠肺组织、纵隔淋巴结及支气管肺泡灌洗液中CD4+T细胞及CD8+T细胞的数量明显高于非吸烟组,提示吸烟鼠体内存在异常炎症反应及炎性细胞浸润,这与既往研究[8-11]也是一致的,而吸烟鼠的脾脏中CD4+T细胞和CD8+T细胞的数量虽有增高趋势,但统计学分析并无明显差异,提示COPD虽然是一种全身性的炎症性疾病,但炎症仍主要累及肺组织及其周围组织。
T细胞的活化是T细胞执行功能的前提和基础,而在T细胞活化的过程中有一些特殊膜表面分子的表达,即活化标记,而CD69是早期表达的活化标记之一[12],可在TCR接受活化信号后诱导表达于成熟T细胞表面并促进T细胞的活化与增殖[13]。本研究利用CD69用来标记CD4+T细胞和CD8+T细胞中的活化的T细胞,通过流式分析发现吸烟鼠肺组织、纵隔淋巴结及支气管肺泡灌洗液中活化T细胞的数量 (CD4+CD69+T细胞和CD8+CD69+T细胞) 明显高于非吸烟鼠,而两组小鼠脾脏中活化T细胞的数量无明显差异,提示吸烟鼠体内存在异常增强的炎症反应,且主要累及肺组织、小气道及其相关的淋巴组织,而活化的T细胞可能在这种异常炎症发生过程中发挥重要作用。
上述结果表明COPD患者体内存在异常炎症反应,而T淋巴细胞可能在这种异常增强的炎症反应中发挥重要作用。但暴露于危险因素的正常人群中只有少部分最终发展为COPD[14, 15],且停止暴露后COPD患者体内炎症仍持续存在且进行性进展,故最新理论认为炎症反应及自身免疫性反应可能共同参与了COPD的发病过程[6, 7]。而调节性T细胞数量或功能障碍导致的免疫调节缺陷与多种自身免疫性疾病及慢性炎症性疾病密切相关。根据Treg细胞的功能,理论上认为COPD患者体内Treg细胞数量不足或功能障碍导致慢性炎症的持续存在,但本研究发现相对于非吸烟鼠,吸烟组小鼠肺组织、纵隔淋巴结及支气管肺泡灌洗液中Treg细胞 (CD4+Foxp+T细胞) 占CD4+的比例明显升高,而两组脾脏中Treg细胞的数量无明显差异,与2007年Smyth[16]、2009年Plumb[17]和2011年Vargas[18]的研究结果相一致。据此推测烟雾刺激触发了COPD患者肺部及其相关淋巴组织、气道异常的炎症反应,引起大量的炎性细胞 (包括CD4+T细胞和CD8+T细胞) 浸润和炎性介质的释放,从而进一步激活体内反馈调节系统,使得Treg细胞的数量明显增加。虽然Treg细胞的数量较健康人明显升高,但由于炎性细胞亦大量增殖超过Treg细胞的抑制能力即Treg细胞相对不足或在COPD的发病过程中Treg细胞发生功能障碍使其不能正常发挥其抑制作用导致COPD体内异常炎症的持续存在。而这一推测亦有相关研究所证实,2007年Smyth等[16]研究表明相对于健康人,健康吸烟者和COPD患者运气管肺泡灌洗液 (BALF) 中的CD4+CD25+Treg较不吸烟的健康者明显升高,但健康吸烟者与COPD患者BALF中CD4+CD25+Treg数量无明显差异,且Treg细胞表达CD27明显减少,提示吸烟触发了吸烟者体内异常的炎症反应,但肺功能正常的吸烟者Treg的数量明显增多,从而控制了吸烟引起的异常炎症反应,而相对于健康吸烟者,COPD患者CD8+T细胞数量明显增高,但其Treg数量无明显差异,提示COPD患者体内Treg细胞数量相对不足,且其CD27表达减少,提示其功能障碍,从而导致免疫调节失控,造成肺组织损伤和肺气肿的发生。此外COPD患者体内存在异常的炎症反应及免疫功能的紊乱,Treg细胞数量增多虽然不足以维持自身抗原免疫耐受,但导致不能对外界抗原或自身肿瘤抗原及时作出免疫应答,从而使得COPD患者易反复并发呼吸系统感染与恶性肿瘤。
虽然对Treg细胞在COPD发病过程中的数量变化及其作用尚存在争议,但均提示COPD患者体内免疫功能紊乱,而Treg细胞在其中发挥重要作用,故针对Treg细胞进一步进行深入研究有助于全面了解COPD的发病机制和正确认识COPD患者本身的免疫状态,从而为研发新的治疗药物和治疗靶点提供理论支持。但是由于本研究只是针对吸烟鼠体内CD4+T细胞、CD8+T细胞及Treg细胞的数量的变化,而对于Treg的细胞的具体作用机制、功能变化、调控机制及信号表达,仍需要深入研究。
| [1] | Hogg JC, Chu F, Utokaparch S, et al. The nature of small-airway obstruction in chronic obstructive pulmonary disease[J]. N Engl J Med, 2004, 350(26): 2645-2653. DOI: 10.1056/NEJMoa032158. |
| [2] | Saetta M, Turato G, Maestrelli P, et al. Cellular and structural bases of chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2001, 163(6): 1304-1309. DOI: 10.1164/ajrccm.163.6.2009116. |
| [3] | Voelkel N, Taraseviciene-Stewart L. Emphysema: an autoimmune vascular disease[J]. Proc Am Thorac Soc, 2005, 2(1): 23-25. DOI: 10.1513/pats.200405-033MS. |
| [4] | Agusti A, Macnee W, Donaldson K, et al. Hypothesis: does COPD have an autoimmune component[J]. Thorax, 2003, 58(10): 832-834. DOI: 10.1136/thorax.58.10.832. |
| [5] | Lee SH, Goswami S, Grudo A, et al. Antielastin autoimmunity in tobacco smoking-induced emphysema[J]. Nat Med, 2007, 13(5): 567-569. DOI: 10.1038/nm1583. |
| [6] | Feghali-Bostwick CA, Gadgil AS, Otterbein LE, et al. Autoantibodies in patients with chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2008, 177(2): 156-163. DOI: 10.1164/rccm.200701-014OC. |
| [7] | Nunez B, Sauleda J, Anto JM, et al. Anti-tissue antibodies are related to lung function in chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 2011, 183(8): 1025-1031. DOI: 10.1164/rccm.201001-0029OC. |
| [8] | O'Shaughnessy TC, Ansari TW, Barnes NC, et al. Inflammation in bronchial biopsies of subjects with chronic bronchitis: inverse relationship of CD8+ T lymphocytes with FEV1[J]. Am J Respir Crit Care Med, 1997, 155(3): 852-857. DOI: 10.1164/ajrccm.155.3.9117016. |
| [9] | Saetta M, Di Stefano A, Turato G, et al. CD8+ T-lymphocytes in peripheral airways of smokers with chronic obstructive pulmonary disease[J]. Am J Respir Crit Care Med, 1998, 157(Pt 1): 822-826. |
| [10] | Saetta M, Baraldo S, Turato G, et al. Increased proportion of CD8+ T-lymphocytes in the paratracheal lymph nodes of smokers with mild COPD[J]. Sarcoidosis Vasc Diffuse Lung Dis, 2003, 20(1): 28-32. |
| [11] | Turato G, Zuin R, Miniati M, et al. Airway inflammation in severe chronic obstructive pulmonary disease: relationship with lung function and radiologic emphysema[J]. Am J Respir Crit Care Med, 2002, 166(1): 105-110. DOI: 10.1164/rccm.2111084. |
| [12] | Ziegler SF, Ramsdell F, Alderson MR. The activation antigen CD69[J]. Stem Cells, 1994, 12(5): 456-465. DOI: 10.1002/stem.v12:5. |
| [13] | Pages F, Ragueneau M, Rottapel R, et al. Binding of phosphatidylinositol-3-OH kinase to CD28 is required for T-cell signalling[J]. Nature, 1994, 369(6478): 327-329. DOI: 10.1038/369327a0. |
| [14] | Kohansal R, Martinez-Camblor P, Agusti A, et al. The natural history of chronic airflow obstruction revisited:an analysis of the Framingham offspring cohort[J]. Am J Respir Crit Care Med, 2009, 180(1): 3-10. DOI: 10.1164/rccm.200901-0047OC. |
| [15] | Hogg JC. Pathophysiology of airflow limitation in chronic obstructive pulmonary disease[J]. Lancet, 2004, 364(9435): 709-721. DOI: 10.1016/S0140-6736(04)16900-6. |
| [16] | Smyth LJ, Starkey C, Vestbo J, et al. CD4-regulatory cells in COPD patients[J]. Chest, 2007, 132(1): 156-163. DOI: 10.1378/chest.07-0083. |
| [17] | Plumb J, Smyth LJ, Adams HR, et al. Increased T-regulatory cells within lymphocyte follicles in moderate COPD[J]. Eur Respir J, 2009, 34(1): 89-94. DOI: 10.1183/09031936.00100708. |
| [18] | Vargas-Rojas MI, Ramirez-Venegas A, Limon-Camacho L, et al. Increase of Th17 cells in peripheral blood of patients with chronic obstructive pulmonary disease[J]. Respir Med, 2011, 105(11): 1648-1654. DOI: 10.1016/j.rmed.2011.05.017. |
 2017, Vol. 38
2017, Vol. 38

