2. 河北北方学院附属第一医院 检验科 河北 张家口 075000
2. Dept. of Laboratory Medicine, the First Affiliated Hospital of Hebei North University, Zhangjiakou 075000, Hebei, China
严重脓毒症是重症医学科患者死亡的重要原因,脓毒症的死亡率约为25%-30%,目前的脓毒症治疗非常有限[1, 2],早期研究表明,严重脓毒症是脓毒症与免疫抑制共同作用的结果,在严重脓毒症的早期阶段即可发生免疫抑制。白细胞介素-10(IL-10)的过表达与淋巴细胞消耗是脓毒症诱导的免疫抑制的主要原因。但是IL-10的表达及淋巴细胞百分比与严重脓毒症患者的死亡率之间的是否相关仍不清楚。本研究探讨了IL-10和淋巴细胞的相关性及其与严重脓毒症患者死亡率的关系。
1 资料与方法 1.1 一般资料选取2015年11月-2017年6月于河北北方学院附属第一医院ICU,诊断为严重脓毒症的患者78例。纳入及排除标准,脓毒症诊断标准为存在已证实或临床诊断的感染,具有以下标准中的至少2个:①体温高于38 ℃或低于36 ℃; ②心率>90次/min; ③每分钟呼吸频率超过20次或二氧化碳分压低于32 mmHg; ④白细胞增多(白细胞计数>12×109/L)或白细胞减少(白细胞计数<4×109/L)。严重脓毒症被定义为具有至少一种器官功能障碍的脓毒症患者[1, 2]。排除标准如下:①患者年龄<18岁; ②严重自身免疫性疾病长期服用免疫抑制类药物; ③血液病等恶性肿瘤患者,入院前6个月内接受过放疗或化疗; ④3个月内至少1个月连续使用激素类药物[大于0.5 mg/(kg·d)的泼尼松龙等药物]; ⑤急性脑梗及心肌梗死患者; ⑥服用过可能影响IL-10浓度的药物(如他汀类药物)。从患者或其亲属处获得书面知情同意书,该研究得到河北北方学院附属第一医院伦理审查委员会的批准。
1.2 血IL-10的测量入ICU 24 h内收集患者血清样本。抽取静脉全血置于促凝管中,并以1 000 g离心10 min。留取血清并在-80 ℃冷冻备用。严格按照说明书,使用商业化的基于化学发光法的检测试剂盒,应用德国SIEMENS公司IMMUNIT1000免疫分析仪,检测IL-10的血清浓度水平。
1.3 其他数据采集收集入ICU 24 h内的常规检查并记录基本临床检验数据及急性生理学和慢性健康评估Ⅱ(APACHE-Ⅱ)评分,记录年龄、性别,机械通气时间、ICU住院时间、感染部位、细菌培养结果。研究的中心事件是28 d死亡率。
1.4 统计学分析正态分布定量数据用平均数和标准差(x±s)表示,非正态分布的用中位数和四分位数范围表示。定性数据以率(%)表示。连续变量数据使用独立样本t检验或Mann-Whitney检验进行两组比较。Pearson相关系数用于检测IL-10水平与其他临床变量之间的相关性。使用ROC曲线来确定IL-10预测临床结果的灵敏度和特异性及最佳预测值,生存曲线风险回归模型确定28 d死亡率。所有数据统计分析均采用SPSS 17.0进行。P<0.05(双侧)被认为具有统计学意义。
2 结果 2.1 一般情况78例纳入研究的严重脓毒症患者,年龄(64.31±16.68)岁,男性占61.52%,平均ICU天数为(19.1±8.5)d,其中56例(71.8%)患有肺部感染,35例(44.9%)有腹部感染,13例(16.7%)合并腹部和肺部感染。其中50例(64.1%)患者微生物培养阳性。28 d随访期间有37例(47.4%)患者死亡,根据脓毒症患者28 d临床结局分为存活组和死亡组。存活组和死亡组在年龄上有显著差异,P<0.05, 性别方面没有差异,P>0.05。结果见表 1。
| 表 1 严重脓毒症存活组和死亡组患者一般情况 |
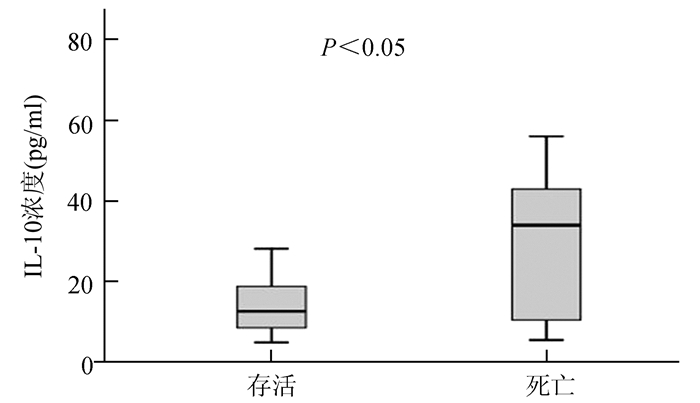
死亡组的APACHE-Ⅱ评分高于存活组[中位数值为25.4(12.9-31.5)和15.1(8.8-23.7),P<0.05]。死亡组IL-10浓度水平显著高于存活组[中位数38.5(17.9-55.6)和26.3(14.5-36.2),P<0.05](见图 1)。进行Pearson相关系数检验IL-10水平与APACHEⅡ的相关性,显示血浆IL-10水平与APACHE-Ⅱ评分不相关(Pearson相关系数为0.056,P=0.7)。
|
图 1 存活组IL-10浓度水平与死亡组间的比较 |
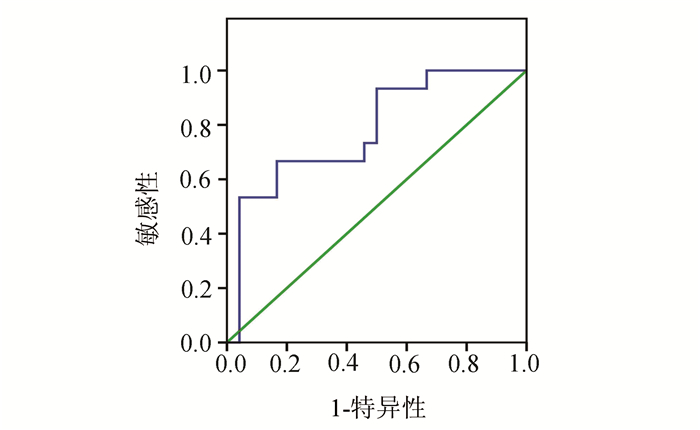
本研究发现ROC曲线下的面积为0.749(95%CI为62.1%-87.7%,P=0.002)(图 2)。最佳临界值为22.8 ng/ml,IL-10对严重脓毒症患者28 d死亡率的敏感性和特异性分别为66.7%和83.3%。
|
图 2 IL-10浓度在严重脓毒症患者预后判断中的ROC曲线 |
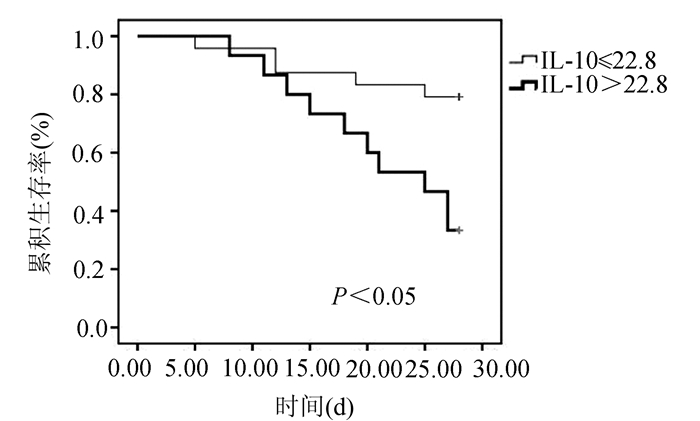
根据IL-10水平高于或低于22.8 ng/ml,对严重脓毒症患者的28 d是否死亡预后进行评估。Kaplan-Meier生存曲线显示,IL-10高于22.8 ng/ml的患者死亡风险高于IL-10低于22.8 ng/ml的患者(P=0.006)(图 3)。这表明更高水平的IL-10与严重脓毒症患者的较高死亡率显著相关。
|
图 3 Kaplan-Meier生存曲线 |
细胞因子网络效应(cytokine network)是指细胞因子通过合成、分泌、相互调节、受体的表达调控、生物学效应的交互影响等而组成效应网络。机体的免疫反应通常由一种或几种细胞因子通过诱导第二或第三细胞因子来反馈性增强或抑制第一种细胞因子的生物学作用,从而达到调节机体免疫状态的作用。在炎症疾病发生过程中,细胞因子网络调节紊乱,使病原体占据优势,导致疾病持续发展恶化。炎症因素进入机体后,免疫细胞可产生促进炎症发展的细胞因子,但同时也会分泌抑制炎症发展的抑炎因子,二者互相制约,达到一个动态平衡,形成一个复杂的反应网络。如果致病因素持续存在,机体免疫系统发生调节不能,使促炎细胞因子将会处于优势地位,导致机体炎性反应加剧,自身调节和抗炎能力下降,疾病必将向全身炎症反应综合征(SIRS)或脓毒症方向发展。
IL-10是Th2细胞产生的多效细胞因子合成抑制因子(anti-inflammatory cytokine),可调节过量的促炎细胞因子和趋化因子的免疫宿主反应[3],主要由Th2淋巴细胞、LPS等刺激的单核巨噬细胞和上皮细胞产生,其受体(IL-10R)表达于许多不同的细胞表面。IL-10可以通过抑制干扰素γ、IL-2、IL-12和IL-18的产生来抑制巨噬细胞活性。IL-10对炎症反应的调节作用对于维持免疫系统平衡是非常有意义的,IL-10的分泌在炎症发生后7 h才开始,24-48 h达高峰,研究发现IL-10能明显抑制LPS诱导巨噬细胞的IL-1、IL-6和TNF-α的产生,脓毒症中IL-10的分泌可能会限制并最终终止炎症反应,属于抑制炎症发展的重要炎性因子[4],然而高水平的IL-10又可以诱导功能性免疫状态,导致不可控的感染[5]。研究表明,IL-10的过量产生可能是病情恶化和死亡的预测因子[6-8]。在本研究中,我们发现严重脓毒症患者入ICU时IL-10浓度水平死亡组显著高于存活组[中位数38.5(17.9-55.6) pg/ml和26.3(14.5-36.2) pg/ml,P<0.05],提示IL-10或可成为预测严重脓毒症患者死亡率的良好指标。IL-10在预测严重脓毒症患者预后的ROC曲线下面积为0.749(95%CI为62.1%-87.7%,P=0.002)。最佳临界值为22.8 ng/ml,该临界值与报道的临界值23.1 ng/ml相近[9],对临床判断预后具有指导意义,其对严重脓毒症患者28 d死亡率的敏感性和特异性分别为66.7%和83.3%。
我们进行了Pearson相关系数检验IL-10水平与APACHE-Ⅱ的相关性,显示血浆IL-10水平与APACHE-Ⅱ评分不相关(Pearson相关系数为0.056,P=0.7)。这与报道不符[9],其原因可能是细胞因子IL-10在体内的检测有效窗口期短,在外周血循环中表达量微少,其性状也较不稳定,导致临床不易捕捉到其特征值,造成较大的偏差,所以在临床应用和比较中也存在着一定程度的偏差[10]。有研究显示IL-10和淋巴细胞的水平具有密切的相互作用,二者联合应用在判断严重脓毒症患者预后中灵敏度和特异性均更高。研究显示,一方面,脓毒症的淋巴细胞减少症是由消耗和凋亡引起的,IL-10可能在T淋巴细胞的凋亡中起作用;另一方面,T细胞和B细胞可以表达和保护IL-10[11]。因此,为了更好地了解脓毒症病理生理变化,将IL-10的浓度结合淋巴细胞百分比或可减低偏差,更好地指导预后。
侵袭性感染引发促炎和抗炎反应,其大小取决于多种因素,包括病原体感染部位、毒力、宿主遗传学和合并症等[12],最后,大多数严重脓毒症患者死于免疫严重受损。一些研究表明,死于脓毒症的患者处于免疫系统严重受损阶段,主要表现为免疫效应细胞的大量消耗和机会性感染的发生[13],因此,恢复宿主免疫力是治愈脓毒症患者的一种潜在途径[14],因此,找到一个很好的指标来检测免疫状况,并作为死亡预测因素是非常重要的。抗炎细胞因子的增加是严重脓毒症患者免疫抑制的主要原因[15],我们检测IL-10的浓度来反映脓毒症诱导的免疫抑制状态,发现IL-10高于22.8 ng/ml的患者死亡风险高于IL-10低于22.8 ng/ml的患者(P=0.006),这表明更高水平的IL-10与严重脓毒症患者的较高死亡率显著相关。
虽然细胞因子在脓毒症疾病监测中仍需要进一步界定和标准化,但其与疾病的关系已基本具备了判断疾病及评估预后的功能,本实验中也给出了一些结论,由于实验条件的限制,有些结论还需进一步给予验证。
| [1] | Kaukonen KM, Bailey M, Suzuki S, et al. Mortality related to severe sepsis and septic shock among critically ill patients in Australia and New Zealand, 2000-2012[J]. JAMA, 2014, 311(13): 1 308-1 316. DOI: 10.1001/jama.2014.2637. |
| [2] | Vincent JL, Marshall JC, amendys-Silva SA, et al. Assessment of the worldwide burden of critical illness: the Intensive Care Over Nations (ICON) audit[J]. The Lancet Respiratory Medicine, 2014, 2(5): 380-386. DOI: 10.1016/S2213-2600(14)70061-X. |
| [3] | Drewry AM, Samra N, Skrupky LP, et al. Persistent lymphopenia after diagnosis of sepsis predicts mortality[J]. Shock, 2014, 42(5): 383-391. DOI: 10.1097/SHK.0000000000000234. |
| [4] | Zhang X, Li N, Shao H, et al. Methane limit LPS-induced NF-κB/MAPKs signal in macrophages and suppress immune response in mice by enhancing PI3K/AKT/GSK-3β-mediated IL-10 expression[J]. Sci Rep, 2016, 11(6): 29 359. |
| [5] | Abe R, Hirasawa H, Oda S, et al. Up-regulation of interleukin-10 mRNA expression in peripheral leukocytes predicts poor outcome and diminished human leukocyte antigen-DR expression on monocytes in septic patients[J]. The Journal of Surgical Research, 2008, 147(1): 1-8. DOI: 10.1016/j.jss.2007.07.009. |
| [6] | Tamayo E, Fernandez A, Almansa R, et al. Pro-and anti-inflammatory responses are regulated simultaneously from the first moments of septic shock[J]. European Cytokine Network, 2011, 22(2): 82-87. |
| [7] | Liu C, Li M, Cao S, et al. Effects of HV-CRRT on PCT, TNF-α, IL-4, IL-6, IL-8 and IL-10 in patients with pancreatitis complicated by acute renal failure[J]. Exp Ther Med, 2017, 14(4): 3 093-3 097. DOI: 10.3892/etm.2017.4843. |
| [8] | Kartall ED, Karkac1 E, Gülbas Z, et al. Several cytokines and protein C levels with the apache Ⅱ scoring system for evaluation of patients with sepsi[J]. Balkan Med, 2012, 29: 174-182. DOI: 10.5152/balkanmedj.. |
| [9] | Bruno S, Antje K, Elizabeth IG, et al. Role of IL-10 in resolution of inflammation and functional recovery after peripheral nerve injury[J]. The Journal of neuroscience, 2015, 35(50): 1 6431-1 642. DOI: 10.1523/JNEUROSCI.2119-15.2015. |
| [10] |
尹建永, 刘嘉琳, 瞿洪平. 脓毒症患者免疫功能障碍监测与评估的新进展[J].
中华急诊医学杂志, 2013, 22(10): 1 187-1 189.
Yin JY, Liu JL, Qu HP. Immune dysfunction of patients with sepsis monitoring and evaluation of new progress[J]. Chinese Journal of Emergency Medicine, 2013, 22(10): 1 187-1 189. |
| [11] | Sawada L, Nagano Y, Hasegawa A, et al. IL-10-mediated signals act as a switch for lymphoproliferation in Human T-cell leukemia virus type-1 infection by activating the STAT3 and IRF4 pathways[J]. PLoS Pathog, 2017, 13(9): e1006597. DOI: 10.1371/journal.ppat.1006597. |
| [12] | Wiersinga WJ, Leopold SJ, Cranendonk DR, et al. Host innate immune responses to sepsis[J]. Virulence, 2014, 5(1): 36-44. DOI: 10.4161/viru.25436. |
| [13] | Boomer JS, To K, Chang KC, et al. Immunosuppression in patients who die of sepsis and multiple organ failure[J]. JAMA, 2011, 306(23): 2 594-2 605. DOI: 10.1001/jama.2011.1829. |
| [14] | Dambuza IM, He C, Choi JK, et al. IL-12 p35 induces expansion of IL-10 and IL-35-expressing regulatory B cells and ameliorates autoimmune disease[J]. Nat Commun, 2017, 8(1): 719. DOI: 10.1038/s41467-017-00838-4. |
| [15] | Cohen J, Vincent JL, Adhikari NK, et al. Sepsis: a roadmap for future research[J]. Lancet Infect Dis, 2015, 15(5): 581-614. DOI: 10.1016/S1473-3099(15)70112-X. |
 2018, Vol. 39
2018, Vol. 39

