2. 中国科学院上海药物研究所 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
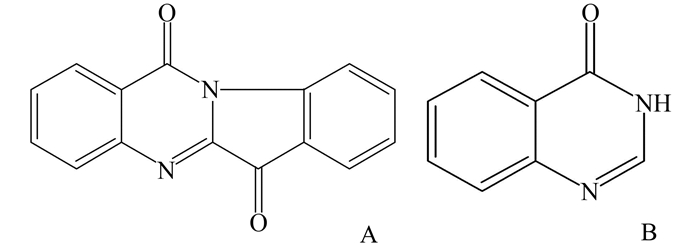
色胺酮(tryptanthrin)为一种从自然界菘蓝、马蓝等植物中发现的吲哚喹啉类生物碱,迄今国内外研究学者发现色胺酮具有非常良好的抗肿瘤、抗菌、抗炎活性[1, 2],已经开发了色胺酮化合物天然药物分离、有机化学合成、微生物发酵这样不同的生产制备方法[3-5],显示出广阔的药用开发价值(图 1)。目前未见色胺酮药物在小鼠体内的药物动力学研究报道,本实验建立了一种简单、准确的测定小鼠血浆中色胺酮含量的HPLC-UV法,开展了色胺酮在小鼠体内的药物动力学研究。
|
图 1 色胺酮(A)和内标4(3H)-喹唑酮的化学结构(B) |
LC-100型高效液相色谱仪(上海伍丰),配有LC-P100plus二元高压恒流泵,LC-UV100 plus紫外检测器,LC-CO100柱恒温箱,LC-WS100色谱工作站;SB-5200D超声波清洗机(宁波新芝);TGL-16G高速台式离心机(上海安亭);AY-120万分之一电子天平(日本岛津);SK-1旋涡混合器(江苏金坛)。
1.2 试剂色胺酮注射液(自制, 纯度25%, 批号: 20150710);色胺酮对照品(西北大学生命科学院提供, >98%, CAS号: 13220-57-0);4(3H)-喹唑酮对照品(上海九鼎, 98%, CAS号: 491-36-1) (图 1);肝素钠(Solarbio, 批号: 425C0215);0.9%氯化钠注射液(批号: D15031506, 贵州科伦药业);甲醇(HPLC级, TEDIA);其余试剂均为分析纯;纯净水。
1.3 动物昆明小鼠,雄性,体质量18-25 g,贵州医科大学实验动物中心提供,许可证号: SYXK (黔)2012-0001。
2 方法与结果 2.1 色谱条件色谱柱为Diamonsil C18钻石一代(250 mm×4.6 mm, 5 μm)色谱柱,C18保护柱(XB-C18, 10 mm×4.6 mm, 5 μm);流动相为甲醇-水(60:40);检测波长251 nm;流速1.0 ml/min;柱温为室温;进样量20 μl。
2.2 给药取昆明小鼠40只,尾静脉注射色胺酮药液80 mg/kg (以色胺酮计)[6],按10 ml/kg给予。实验前10 h禁食,自由饮水。
2.3 样品采集与处理昆明小鼠被给药0.167, 0.333, 0.50, 0.75, 1.0, 1.5, 2.5, 4.0, 6.0, 8.0, 10.0, 12.0 h后, 摘眼球取血。置1.5 ml含肝素EP管,4 000 r/min离心10 min后,转移上清液。-20 ℃冰箱冷藏,待测。进样分析前,取待测血浆样品上清液(或空白血浆上清液) 40 μl,空白甲醇(或色胺酮对照品溶液)10 μl,内标溶液(70.0 μg/ml 4(3H)-喹唑酮对照品溶液) 10 μl,甲醇100 μl (1:3, V/V);涡旋混匀20 s,12 000 r/min离心5 min,取上清液,进HPLC色谱仪检测。
2.4 对照品溶液的制备精密称取色胺酮对照品4.0 mg,置10 ml量瓶中,甲醇溶解并稀释至刻度,得质量浓度为0.4 mg/ml的色胺酮储备液,4 ℃冰箱冷藏,备用。精密称取4(3H)-喹唑酮对照品7.0 mg,置10 ml量瓶中,甲醇溶解并稀释至刻度,得质量浓度为0.7 mg/ml的4(3H)-喹唑酮储备液,4 ℃冰箱冷藏,备用。
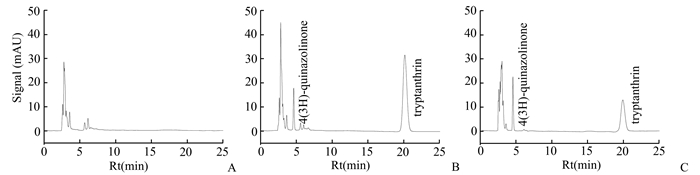
2.5 方法学考察 2.5.1 专属性试验样品按“2.3”项下方法处理,按“2.1”项下色谱条件测定。结果内标(4(3H)-喹唑酮)的保留时间为4.6 min,色胺酮的保留时间为20.1 min,小鼠空白血浆的内源性物质对色胺酮的测定无干扰,见图 2。
|
图 2 小鼠空白血浆(A)、空白血浆+色胺酮对照品+内标(B)、给药0.167 h后小鼠血浆+内标(C)的HPLC色谱图 |
以空白血浆与甲醇1:3 (V/V)制备空白血浆上清液,配得0.25, 2.5, 12.5 μg/ml色胺酮的待测上清溶液。同时配制相同低、中、高浓度的色胺酮对照品溶液。分别进样测定,计算得到低、中、高浓度色胺酮溶液的基质效应分别为85.6%,96.1%和93.2%,表明在本实验条件下,可以忽略基质效应的影响。
2.5.3 线性关系试验精密量取空白血浆40 μl置1.5 ml EP管中,分别加入4.0-400.0 μg/ml范围内6种色胺酮对照品溶液10 μl;接着依次加入内标溶液(70.0 μg/ml)10 μl,甲醇100 μl (1:3, V/V);按照“2.3”项下方法处理后,最终得到浓度在0.25-25.0 μg/ml的模拟血浆样品。分别进HPLC色谱仪检测。以样品前处理后色胺酮的最终质量浓度为横坐标(X),以色胺酮峰面积与内标峰面积的比值为纵坐标(Y),进行线性方程回归,得到Y=0.730 1X-0.354 1,r=0.999 4。表明小鼠血浆中色胺酮质量浓度在0.2-25.0 μg/ml范围内,线性关系良好。LLOQ (lower limit of quantification,定量下限)为0.2 μg/ml (S/N≥10),LOD (limit of detection,检测限)为40.0 ng/ml (S/N=3)。
2.5.4 精密度试验按“2.3”项下方法处理,“2.1”项下方法测定, 分别考察了经样品前处理后得到的0.25,2.5,12.5 μg/ml色胺酮的血浆上清液(n=5),连续测试3 d。结果低、中、高浓度的色胺酮溶液的日内精密度的RSD分别为2.37%,1.05%,1.74%;日间精密度的RSD分别为2.65%,1.81%,2.93%。
2.5.5 稳定性试验依次考察了加入4.0,40.0,200.0 μg/ml色胺酮对照品溶液的模拟血浆样品,在室温放置8 h、反复冻融3次、-20 ℃冰箱冷藏15 d条件下样品稳定性(n=3)。结果0.25, 2.5, 12.5 μg/ml色胺酮溶液的RSD分别为2.17%,1.26%,2.34%;3.76%,2.51%,2.09%;4.64%,2.93%,3.38%。表明在上述条件下,血浆样品稳定性良好。
2.5.6 提取回收率试验向空白血浆40 μl中,分别加入4.0,40.0,200.0 μg/ml色胺酮对照品溶液,按照“2.3”项下方法处理后,得到0.25, 2.5, 12.5 μg/ml色胺酮的待测溶液(n=5)。同时以空白血浆与甲醇1:3 (V/V)制备空白血浆上清液,配制相同低、中、高浓度的含空白血浆的色胺酮对照溶液。分别进样测定,计算得到0.25, 2.5, 12.5 μg/ml色胺酮溶液的平均提取回收率分别为86.44% (RSD 3.98%),95.87%(RSD 2.28%)和96.41% (RSD 2.12%)。
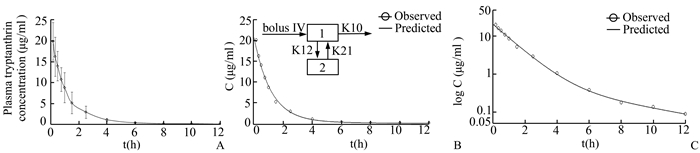
2.6 药物动力学实验昆明雄性小鼠40只,尾静脉注射色胺酮药物溶液后的平均药-时曲线见图 3。我们分别采用WinNonlin 6.1、DAS 3.0、Kinetica 5.1专业药物动力学分析软件对本次实验数据进行了系统分析,三款软件程序下的计算结果一致。PK参数数据说明,当加权系数w=1/c·c,二室模型时,AIC值最小,拟合度为1(表 1),静注色胺酮的在小鼠体内过程符合二室模型。
|
图 3 小鼠单剂量静脉注射色胺酮后的浓度-时间(C-t)曲线(A), 平均C-t曲线(B)与log C-t曲线(C)(n=3) |
| 表 1 静脉注射色胺酮在小鼠体内的主要药物动力学参数结果 |
本实验建立了一种简便、准确的HPLC-UV法测定小鼠血浆中色胺酮的含量,以结构相似的4(3H)-喹唑酮作为含色胺酮血浆样品检测的内标,建立的甲醇沉淀蛋白法能够有效排除血浆中蛋白、内源物的干扰,样品中被测峰与内标峰之间分离度良好。经色谱方法学验证,该测定方法的线性关系、日内/日间精密度、样品稳定性和提取回收率均符合生物样品检测的有关要求,适合于色胺酮在小鼠体内的药物动力学研究。
我们此次研究的色胺酮静脉给药剂量是目前报道的最大剂量[6-8],在整个实验过程中,未见色胺酮导致的药物不良反应的发生,可见色胺酮致生物毒性低、安全治疗窗良好。静脉注射色胺酮药物后,实际平均血药浓度Cmax达到20.10 μg/ml;药物动力学参数t1/2β 4.00 h,CL 2.93 L/(h·kg),V1 3.83 L/kg,AUC 0-∞28.20 μg·h/ml表明色胺酮在小鼠体内吸收、代谢过程较慢,在小鼠体内分布比较广泛,存在于血液、细胞内液和脂肪组织中。与血浆蛋白结合率比较低,大多以游离态存在。我们课题组也将后续开展色胺酮药物在生物机体内的组织分布与抗癌新药开发工作。
| [1] | Liao XM, Zhou XL, Mak NK, et al. Tryptanthrin Inhibits Angiogenesis by Targeting the VEGFR2-Mediated ERK1/2 Signalling Pathway[J]. PLoS One, 2013, 8(12): e82294. DOI: 10.1371/journal.pone.0082294. |
| [2] |
刘丽娟, 王允亮, 许树青, 等. 靛玉红、色胺酮对LPS诱导RAW264.7炎症细胞模型的抗炎作用研究[J].
世界中西医结合杂志, 2015, 10(8): 1069-1072.
Liu LJ, Wang YL, Xu SQ, et al. Study of Indirubin and Tryptanthrin on LPS Induced RAW264.7 Inflammatory Cell Model in Vitro[J]. World Journal of Integrated Traditional and Western Medicine, 2015, 10(8): 1069-1072. |
| [3] |
王翠玲, 侯宝龙, 张宁, 等. 天然产物色胺酮及其衍生物的仿生合成[J].
高等学校化学学报, 2015, 36(2): 274-278.
Wang CL, Hou BL, Zhang N, et al. Biomimetic Synthesis of Natural Product Tryptanthrin and Its Derivatives[J]. Chemical Journal of Chinese Universities, 2015, 36(2): 274-278. |
| [4] | Chang CF, Hsu YL, Lee CY, et al. Isolation and Cytotoxicity Evaluation of the Chemical Constituents from Cephalantheropsis gracilis[J]. International Journal of Molecular Sciences, 2015, 16(2): 3980-3989. DOI: 10.3390/ijms16023980. |
| [5] | Jao CW, Lin WC, Wu YT, et al. Isolation, structure elucidation, and synthesis of cytotoxic tryptanthrin analogues from Phaius mishmensis[J]. Journal of Natural Products, 2008, 71(7): 1275-1279. DOI: 10.1021/np800064w. |
| [6] |
李捷, 缪珊, 王四旺, 等. 色胺酮对小鼠急性和亚急性毒性实验研究[J].
中国医药导报, 2012, 9(32): 13-14.
Li J, Miao S, Wang SW, et al. Acute and sub-acute toxicity test of tryptanthrin in mice[J]. China Medical Herald, 2012, 9(32): 13-14. |
| [7] |
李捷, 缪珊, 王四旺, 等. HPLC法测定大鼠血浆中色胺酮的浓度及药代动力学参数[J].
中国药理学通报, 2012, 28(2): 270-274.
Li J, Miao S, Wang SW, et al. Determination of tryptanthrin in rat plasma by HPLC and its pharmacokinetic parameters[J]. Chinese Pharmacological Bulletin, 2012, 28(2): 270-274. |
| [8] | Zhang N, Hua Y, Wang CL, et al. Distribution study of tryptanthrin in rat tissues by HPLC and its relationship with meridian tropism of indigo naturalis in traditional Chinese medicine[J]. Biomedical Chromatography, 2014, 28: 1701-1706. DOI: 10.1002/bmc.v28.12. |
 2017, Vol. 38
2017, Vol. 38

