2. 武汉大学中南医院 肾内科 湖北 武汉 430071
2. Dept. of Nephrology, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
糖尿病肾病(diabetic nephropathy, DN)是糖尿病微血管并发症之一,也是导致终末期肾衰(end-stage renal disease, ESRD)的重要病因。如何延缓DN进展,特别是延缓显性DN进展至ESRD,是肾病专科医生工作中的难点。舒洛地特,一种外源性糖胺聚糖,曾被认为对于DN的防治具有很好的前景。本文回顾性分析舒洛地特对显性糖尿病肾病的治疗作用,现报道如下。
1 资料与方法 1.1 病例来源病例来源于我院2012年1月-2016年12月在我科就诊的显性DN患者。入选标准为:符合显性DN诊断标准; 在我院随诊超过1年。排除标准:伴肿瘤、严重心脑血管并发症; 仅有尿蛋白定性而无24 h尿蛋白定量(TP/24 h)结果的病人; 糖尿病同时合并慢性肾炎患者。共入选病例70例,其中男性48例,平均年龄(64.6±8.3)岁,女性22例,平均年龄(66.5±7.6)岁。
1.2 病例分组和治疗方法根据是否同时合并使用舒洛地特治疗,将70例病例分为对照组及舒洛地特治疗组。对照组42例,男28例,女14例,舒洛地特治疗组28例,男18例,女10例。两组患者均以胰岛素(或胰岛素+口服降糖药)降糖,以钙离子拮抗剂、ACEI、ARB单药或联合降压治疗。舒洛地特治疗组在此基础上使用舒洛地特[剂量500-1 000脂酶单位(LSU)/次,2次/d]治疗1年以上。舒洛地特治疗组未给予其他抗凝和血小板解聚药物治疗。
1.3 观察指标主要观察治疗1年对照组和舒洛地特治疗组尿蛋白下降程度。以TP/24 h下降至小于0.5 g/d定义为治疗显效。次要观察指标为校正肾小球滤过率(eGFR), 以肾脏ECT扫描获得结果,观察治疗1年前后eGFR变化情况。同时记录患者是否有出血事件发生。
1.4 统计学分析以SPSS 21.0统计学软件分析,所有数据均以x±s表示, 组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果 2.1 两组患者入组时基线指标比较对照组患者入组时平均年龄(57.5±12.8)岁,糖尿病病史平均(13.1±7.8)年,平均体重(65.2±8.6) kg,平均糖化血红蛋白(7.6±1.3)%, 平均收缩压(146.3±16.8) mmHg,平均舒张压(88.2±13.1)mmHg。舒洛地特治疗组患者入组时平均年龄(56.5 ±10.6)岁,糖尿病病史平均(12.9±8.1)年,平均体重(62.2±9.1) kg,平均糖化血红蛋白(7.4±1.7)%, 平均收缩压(143.3±18.2)mmHg,平均舒张压(90.1±12.1)mmHg。两组基线资料比较,差异无统计学意义(P>0.05),具有可比性。具体情况见表 1。
| 表 1 研究患者基线指标比较 |
两组患者入组时TP/24 h均大于0.5 g/d,肾病范围内蛋白尿(>3.5 g/d)在对照组仅5例(11.2%),在舒洛地特治疗组仅3例(10.7%),两组蛋白尿程度分布无统计学差异。两组均包括慢性肾病(CKD)2-4期患者,且两组eGFR分布无差异,见表 2。
| 表 2 研究患者基线eGFR及蛋白尿分级(%) |
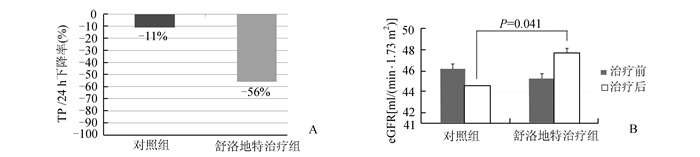
经过1年治疗,两组患者TP/24 h均下降,但舒洛地特治疗组下降幅度明显大于对照组(P<0.01)。且舒洛地特组经过1年治疗,10例达到显效标准(TP/24 h<0.5 g/d),对照组无1例达到显效。对照组eGFR较治疗前略有下降,而舒洛地特组经过1年治疗,eGFR较前略有上升,两治疗组在治疗前eGFR无明显差异,而在治疗后两组差异有显著性(P<0.05)。两组患者在治疗1年期间,均未记录出血事件发生。见表 3和图 1。
| 表 3 研究患者治疗1年TP/24 h及eGFR变化情况 |
|
图 1 各组患者治疗1年后尿蛋白下降情况(A)及肾功能变化情况(B) |
舒洛地特治疗组10例出现显效,其中6例为CKD 2期患者,4例为CKD 3期患者,CKD 4期患者则无1例出现显效反应。3例肾病范围蛋白尿患者经1年治疗,尿蛋白较前下降,但无1例出现显效反应。
3 讨论舒洛地特,一种外源性糖胺聚糖,商品名为伟素,化学名为葡糖醛酸基葡糖聚糖硫酸盐,由80%硫酸艾杜糖葡糖胺聚糖(IGS)和20%硫酸皮肤素(DS)组成。
1994年Solini等最早开始了对舒洛地特治疗糖尿病肾病的研究[1],之后国内外学者相继进行了多个临床研究[2-4]。我们曾报道舒洛地特治疗早期糖尿病肾病,取得了良好疗效[5]。而对临床期糖尿病肾病,舒洛地特的治疗作用未得到广泛认同。舒洛地特大量白蛋白尿(Sun-MACRO)试验提前结束,未能发现舒洛地特对临床期糖尿病肾脏的保护作用[6]。但有学者指出了该研究存在设计缺陷[7],且近期多个基础试验都表明舒洛地特可能通过下调血管内皮生长因子表达、减轻氧化应激反应等机制,延缓糖尿病肾病进展[8, 9]。美国肾脏病杂志(AJKD)也连登两条评论[10, 11],指出舒洛地特治疗糖尿病肾病还有待于进一步研究。
本文回顾性分析了近5年在我院就诊、且随诊超过1年的糖尿病肾病患者资料,结果发现:①舒洛地特治疗1年,临床糖尿病肾病患者TP/24 h下降高达56%,而对照组仅11%;②舒洛地特治疗1年,临床糖尿病肾病患者eGFR不降反升,而对照组eGFR明显下降; ③舒洛地特治疗组患者,能达到显效(TP/24 h<0.3 g/d)者均满足eGFR>30 [ml/(min·1.73 m2)]且入组TP/24 h<3.5 g/d。这些结果提示长期舒洛地特治疗,能有效减轻显性糖尿病肾病患者蛋白尿程度,抑制肾脏损伤进展,且对于肾脏损伤相对较轻的患者更有效。
舒洛地特由80%的快速移动肝素和20%的硫酸皮肤素组成,与传统肝素相比较,舒洛地特具有半衰期长、口服吸收率高、抗凝作用弱的特点。近年来,舒洛地特和微循环的关系引起了人们的关注。研究发现,舒洛地特通过多种机制改善糖尿病肾小球微循环,具体可能包括以下几个方面:①通过抑制因子Ⅹa激活达到抗凝作用; ②通过增强组织纤溶酶原激活物活性及下调组织纤溶酶原抑制剂活性促进纤溶; ③通过抑制补体激活改善微血管炎症; ④通过促进脂蛋白脂酶释放,抑制血管硬化; ⑤通过保持微血管壁正常负电荷,改善血管通透性; ⑥改善内皮依赖性血管舒张。另外,也有研究表明舒洛地特可能通过抑制基质金属酶活性、下调血管内皮生长因子及抑制氧化应激、下调肾小管上皮细胞凋亡等机制延缓糖尿病肾组织损伤进展[12]。由此,有理由认为舒洛地特通过多种机制延缓糖尿病肾病进展。
关于舒洛地特治疗糖尿病肾病的剂量及疗程问题,目前亦无统一意见。在DiNAS研究中,作者用不同剂量舒洛地特治疗糖尿病肾病患者4个月,发现舒洛地特的治疗效应呈量效关系,最大剂量(2 000 LSU/d)舒洛地特达到了最大的降尿蛋白效果[13]。DAVET研究则显示小剂量(500 LSU/d)舒洛地特长期治疗(超过1年),可以显著降低糖尿病肾病患者蛋白尿[14]。我们的试验中,患者采用两种剂量舒洛地特(1 000 LSU/d和2 000 LSU/d)治疗1年,未有出血事件记录,提示这两种剂量舒洛地特长期治疗的安全性。但由于采用1 000 LSU/d舒洛地特治疗患者例数偏少(5例),我们未比较1 000 LSU/d和2 000 LSU/d舒洛地特长期治疗疗效差异。
综上所述,我们采用回顾性队列研究,发现舒洛地特长期治疗不仅显著降低显性糖尿病肾病患者蛋白尿程度,而且逆转了eGFR下降趋势,提示舒洛地特长期治疗可使显性糖尿病肾病患者获益,值得进一步研究。
| [1] | Solini A, Vergnani L, Ricci F, et al. Glycosaminoglycans delay the progression of nephropathy in NIDDM[J]. Diabetes Care, 1997, 20(5): 819-823. DOI: 10.2337/diacare.20.5.819. |
| [2] | Lewis EJ, Lewis JB, Greene T, et al. Sulodexide for kidney protection in type 2 diabetes patients with microalbuminuria: a randomized controlled trial[J]. Am J Kidney Dis, 2011, 58: 729-736. DOI: 10.1053/j.ajkd.2011.06.020. |
| [3] | Heerspink HL, Greene T, Lewis JB, et al. Collaborative Study Group. Effects of sulodexide in patients with type 2 diabetes and persistent albuminuria[J]. Nephrol Dial Transplant, 2008, 23: 1 946-1 954. DOI: 10.1093/ndt/gfm893. |
| [4] | Li R, Xing J, Mu X, et al. Sulodexide therapy for the treatment of diabetic nephropathy, a meta-analysis and literature review[J]. Drug Des Devel Ther, 2015, 9: 6 275-6 283. |
| [5] |
陈玲, 杨仁勇. 舒洛地特治疗糖尿病肾病的疗效观察[J].
武汉大学学报:医学版, 2013, 34(3): 450-452.
Chen L, Yang RY. Effect of sulodexide on urine protein excretion in type 2 diabetes with proteinuria[J]. Medical Journal of Wuhan University, 2013, 34(3): 450-452. |
| [6] | Packham DK, Wolfe R, Reutens AT, et al. Sulodexidefails to demonstrate renoprotection in overt type 2 diabeticnephropathy[J]. J Am Soc Nephrol, 2012, 23(1): 123-130. DOI: 10.1681/ASN.2011040378. |
| [7] | Olde Engberink RH, Vogt L. The renoprotective effects of sulodexide[J]. Drug Des Devel Ther, 2016, 10: 1 233-1 234. |
| [8] | Cha JJ, Kang YS, Hyun YY, et al. Sulodexide improves renal function through reduction of vascular endothelialgrowth factor in type 2 diabetic rats[J]. Life Sci, 2013, 92(23): 1 118-1 124. DOI: 10.1016/j.lfs.2013.04.008. |
| [9] | Liu YN, Zhou J, Li T, et al. Sulodexide protects renal tubular epithelial cells from oxidative stress-induced injury via upregulating klotho expression at an early stage of diabetic kidney disease[J]. J Diabetes Res, 2017, 8: 498-508. |
| [10] | Coccheri S. Game not over for sulodexide[J]. Am J Kidney Dis, 2012, 59(3): 467. |
| [11] | Gambaro G. Discounting the efficacy of sulodexide in diabetic nephropathy is premature[J]. Am J Kidney Dis, 2012, 60(1): 169-170. |
| [12] | Yung S, Chau MK, Zhang Q, et al. Sulodexide decreases albuminuria and regulates matrix protein accumulationin C57BL/6 mice with streptozotocin-induced type Ⅰ diabetic nephropathy[J]. PLoS One, 2013, 8(1): 545-564. |
| [13] | Gambaro G, Kinalska I, Adrian O, et al. Oral sulodexide reduces albuminuria in microalbuminuricand macroalbuminuric type 1 and type 2 diabetic patients: The DiNAS Randomized Trial[J]. J Am Soc Nephrol, 2002, 13(6): 1 615-1 625. DOI: 10.1097/01.ASN.0000014254.87188.E5. |
| [14] | Blouza S, Dakhli S, Abid H, et al. Efficacy of low-dose oral sulodexide in the management of diabetic nephropathy[J]. J Nephrol, 2010, 23(4): 415-424. |
 2018, Vol. 39
2018, Vol. 39

