2. 华中师范大学生命科学学院 湖北 武汉 430079
2. College of Life Sciences, Huazhong Normal University, Wuhan 430079, China
全球每年数百万人死于肝脏疾病,其中许多是由于没有合适配型的供体——肝脏[1, 2]。科学家们试图通过肝组织工程来缓解供体短缺的问题:体外利用生物相容性良好的可降解材料,与肝细胞及其他细胞复合,构建活的肝脏类器官,经体外培养后移植体内替代肝脏功能。细胞外基质(extracellular matrix,ECM)材料起着对种子细胞(应用组织工程的方法再造组织和器官所用的各类细胞)的支持、营养、信号交流等作用,对ECM材料的开发研究是组织工程学研究中的重要环节,细胞与ECM的相互作用直接影响细胞形态、增殖、迁移、分化和存活等行为[3-5]。对肝组织工程ECM材料的开发让细胞的体外培养从二维平面扩展到三维立体空间,为细胞的分裂增殖和肝脏特有功能体现提供一个类似体内的环境,促进细胞功能的体现。肝组织工程学中研究的ECM材料主要有胶原、壳聚糖、透明质酸、海藻酸盐等,近年来木糖萄聚糖(xyloglucan,XG)作为一种新型材料已成为研究热点[6-8]。XG的分子骨架由葡聚糖构成,其侧链上的部分木糖基被半乳糖木糖基取代,罗望子果中提取的XG的分子结构如图 1,由三种寡糖单元组成——七糖、八糖和九糖[9],支链的半乳糖基在细胞/基质相互作用中非常重要。XG作为多糖类,既具有生物活性和生物可降解性,也提供肝细胞的锚定位点,促进肝细胞的特有功能体现,是一种良好的肝组织工程ECM材料[10]。HepG2细胞增殖快,易于培养,具有一定的合成和代谢能力,可作为肝组织工程的种子细胞来源[11, 12]。本文以XG作为ECM材料,探讨XG对HepG2细胞在细胞培养板上的贴壁性以及对微囊化HepG2细胞的NH4+清除速率、清蛋白合成速率和细胞增殖的影响。
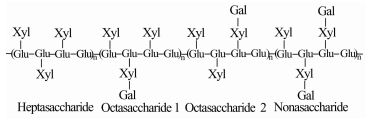
|
图 1 木糖葡聚糖的分子结构示意图 Glu:葡萄糖;Xyl:木糖;Gal:半乳糖 |
BCATM Protein Assay Kit(美国Pierce,Pro#23227)。Ammonia Assay Kit(美国Sigma,No. AA0100)、多聚赖氨酸(Poly-L-lysine,PLL,美国Sigma)。木糖葡聚糖(爱尔兰Megazyme,基团比Xyl:Glu:Gal:Ara=9.5:10.5:4:1),海藻酸钠(alginate,AL,上海楷洋生物技术有限公司)。Human Serum Albumin Elisa kit(上海蓝基生物科技有限公司,No. E01S0014)。
1.2 实验方法 1.2.1 细胞系的选择及培养HepG2细胞(ATCC No. HB-8065) 来自于一个15岁美国白人男孩的肝癌组织,乙肝表面抗原阴性,无致瘤性,可分泌多种蛋白如清蛋白、转铁蛋白、视黄醇结合蛋白、β-脂蛋白及补体C37F激活因子、C4等[11]。HepG2细胞与原代肝细胞相比不需要复杂的分离步骤,更易大规模培养,且仍保持部分合成、代谢功能如清蛋白合成、NH4+代谢能力,另外,HepG2细胞可自身合成某些生长因子(胰岛素,IGF-2)[12],可作为肝组织工程的种子细胞来源。
HepG2用含青霉素、链霉素及10%胎牛血清的DMEM培养基培养,置于37 ℃的5%二氧化碳培养箱中[13, 14]。
1.2.2 细胞贴壁性分析设1% AL溶液为空白对照,用含不同浓度XG(0.5,1,4,6 mg/ml)的AL(1%)溶液200 μl/孔包被24孔板,55 ℃干燥2 h后紫外照射灭菌30 min。将HepG2细胞按106/孔接种于包被的24孔板,于细胞培养箱孵育4 h后用PBS洗涤3次去掉未贴壁细胞,收集贴壁的细胞(1 000 r/min,4 min)后加蛋白裂解液制备细胞总蛋白,以BCA法测定细胞总蛋白量,以最大值为1计算各组细胞贴壁率。
1.2.3 微囊化装置本实验室自制了一套HepG2细胞的微囊化装置,过程如下:去掉风扇(A7010-22RA-2GN-U1) 转盘周围的扇叶,将直径100 μm的铜丝成中心对称粘贴到转盘边缘并拉直,装上支架,如图 2。工作时将USB接口接入5 V直流电。该装置采用geniaLab Bio Technologie JetCutter Type S的基本原理,利用铜丝对液柱的横向切割将液柱分散到溶液中形成微囊[15]。

|
图 2 微囊化装置实物图(a)与示意图(b) |
将胰蛋白酶消化收集的HepG2细胞加入1% AL或含XG的AL溶液中并轻轻混匀,接通微囊化装置电源,用注射器将细胞悬液快速注入0.1 mol/L CaCl2溶液中(见图 2b),会在CaCl2溶液中形成均匀的微囊颗粒,静置10 min后弃CaCl2溶液用DMEM基础培养基洗涤微囊3次,以PLL溶液处理微囊5 min后再用0.1% AL(生理盐水配制)处理微囊5 min,最后以55 mmol/L柠檬酸钠溶液处理微囊10 min,即得到APA微囊。在6孔细胞培养板中每孔加入2 ml完全培养基和1 ml微囊进行培养,微囊培养过程中每2 d更新一次培养基。
1.2.5 清蛋白合成速率及NH4+清除速率测定取微囊培养第6, 10, 14天的培养基,参考Human Serum Albumin Elisa kit说明书测定培养基中HSA的含量。
微囊培养第6, 10, 14天时,弃去培养基,以生理盐水洗涤微囊3次,加入2 ml含0.5 mmol/L NH4+的生理盐水,于细胞培养箱孵育2 h后收集生理盐水,参考Ammonia Assay Kit说明书测定生理盐水中NH4+的浓度。
1.2.6 细胞活力的测定微囊培养第6,10,14天后弃去培养基,以生理盐水洗涤微囊3次,加入55 mmol/L柠檬酸钠溶液常温处理微囊10 min使微囊裂解释放细胞,1 000 r/min离心4 min收集细胞,加入200 μl蛋白裂解液于4 ℃裂解30 min,用BCA法测定细胞总蛋白量,计算细胞数目。
1.2.7 Cx32,E-cadherin的表达分析以Premier Primer5.0设计间隙连接蛋白32(connexin 32,Cx32)、细胞黏附分子(epithelial-cadherin,E-cadherin)及内参基因GAPDH的PCR引物,如表 1。
| 表 1 GAPDH、Cx32、E-cadherin的检测引物序列 |
用含1 mg/ml XG的1% AL溶液制备HepG2细胞APA微囊,微囊培养1, 2, 3 d后用55 mmol/L柠檬酸钠处理微囊收集细胞,Trizol法提取细胞总RNA,取800 ng总RNA用反转录试剂盒合成cDNA第一条链,取0.5 μl产物加入10 nmol各基因引物和12.5 μl 2×PCR Mix并补足体积到25 μl进行PCR检测,94 ℃预变性3 min后进行26个循环(94 ℃ 30 s,52.6 ℃ 30 s,72 ℃ 1 min),最后72 ℃延伸10 min后降温至4 ℃。2%琼脂糖凝胶电泳检测1, 2, 3 d微囊内Cx32与E-cadherin表达情况。
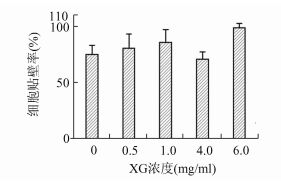
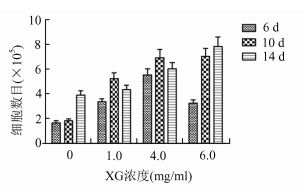
2 结果贴壁性分析结果(图 3)显示,随着XG浓度的增加,细胞贴壁率呈增加趋势,说明XG可促进细胞在培养板上的贴附作用。而且,随着微囊中XG浓度的增加,细胞的数目也增加(图 4),说明XG的存在促进了细胞与胞外基质直接的相互作用,促进了细胞增殖。
|
图 3 不同XG浓度下细胞贴壁率柱形图 |
|
图 4 不同XG浓度组细胞增殖情况柱形图 |
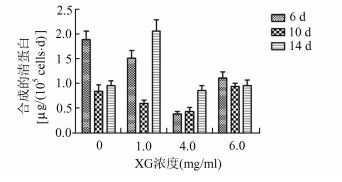
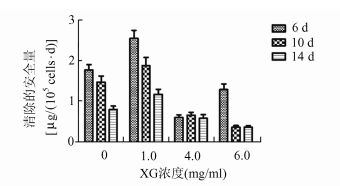
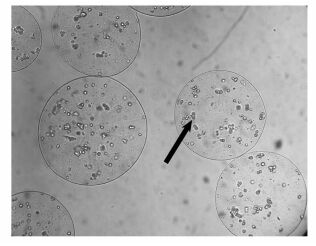
清蛋白合成及对NH4+的清除能力在一定程度上反映了微囊化HepG2细胞的肝脏特有功能,检测结果显示在1 mg/ml XG的实验组中细胞清蛋白合成速率和NH4+清除率最高(图 5,图 6),在第14天分别达到2.076 μg albumin/105 cells/d、1.18 μg ammonia/105 cells/h,1 mg/ml的XG最适宜于微囊化HepG2细胞的肝脏特有功能体现,更高浓度的XG反而使微囊化细胞的清蛋白合成及NH4+清除率降低,可能是由于细胞的生理活动受限于微囊高黏度的内核[16, 17]。同时,微囊的直径也可能对此有所影响,本实验中制备的微囊粒径为(496.0±74.9) μm(σ) (图 7)。
|
图 5 不同浓度组清蛋白合成速率 |
|
图 6 不同浓度XG组NH4+清除速率柱形图 |
|
图 7 APA微囊光学显微镜照片(×10) 箭头所指为微囊内HepG2细胞 |
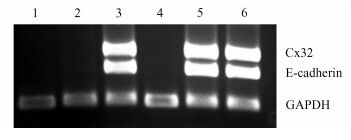
肝细胞在体外培养中形成细胞簇能促进细胞肝脏特有功能体现[18],细胞簇的形成依赖于细胞/细胞相互作用,胞间黏附因子Cx32、E-cadherin等在其中扮演着重要角色。Cx32是肝脏中肝细胞表达的主要间隙连接蛋白,通过参与细胞间信号传递和细胞内信号转导调控细胞的生长增殖[19]。E-cadherin是调控细胞分化、增殖的一种细胞间黏附分子,能促进细胞/细胞相互作用和细胞功能的维持。在XG存在的情况下第2天即检测到细胞簇中Cx32、E-cadherin的表达,而不含XG的组则在第3天检测到基因表达(图 8),AL/XG组中微囊化细胞表达Cx32的时间较AL组提前,说明XG使得细胞更早地通过Cx32进行细胞间信息交流形成细胞簇,从而促进细胞肝脏特有功能的体现。
|
图 8 GAPDH、Cx32、E-cadherin PCR产物琼脂糖凝胶电泳图 AL微囊内表达(1:第1天,2:第2天,3:第3天);AL/XG微囊内表达(4:第1天,5:第2天,6:第3天) |
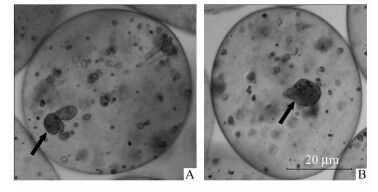
虽然AL并不能促进细胞的贴壁和延展[20],但HepG2细胞在AL微囊内仍然生长增殖形成细胞簇(图 9a),因为细胞更倾向于选择细胞/细胞相互作用以求得生存[21],同时,相对于AL/XG组微囊内细胞簇生长情况,AL组细胞簇直径更小(图 9)。因此,AL微囊内HepG2细胞簇形成较缓慢,使细胞的清蛋白合成速率与NH4+代谢速率较AL/XG组低。
|
图 9 培养5 d的微囊化细胞光学显微镜照片(×20) A:AL; B:AL/XG (1 mg/ml XG),箭头所指为微囊内HepG2细胞簇 |
总之,木糖葡聚糖对海藻酸钠微囊内HepG2细胞间的信号交流具有促进作用,能够促进微囊内细胞簇的形成与细胞增殖,从而加强了微囊化HepG2细胞的合成和解毒功能。
3 讨论木糖葡聚糖是植物初生细胞壁的重要结构组分,其水溶液具有黏性,无毒无味,是肝组织工程学中材料研究的一个热点。XG分子中侧链的半乳糖基已被证实可与原代肝细胞结合促进细胞的功能体现,2004年Seo最早将XG用于肝组织工程的材料研究,其研究结果显示,XG侧链的半乳糖基与肝细胞表面的ASGPR特异性识别,可以显著促进肝细胞的贴壁及细胞簇的形成[22]。2005年Seo等研究了XG对小鼠原代肝细胞功能的影响,结果表明XG侧链中的半乳糖基通过ASGPR斑与肝细胞结合,并可促进原代肝细胞的合成、代谢功能[23],是一种良好的胞外基质材料。本文结果也证实了XG对肿瘤来源细胞系HepG2细胞微囊化后肝脏特有功能的促进作用,同时XG作为天然多糖类物质,具有生物可降解性等优势,是一种具有潜在价值的肝组织工程胞外基质材料,然而天然材料的生物降解速率、力学性质等则需要进一步改善,对木糖葡聚糖这种新型高分子材料进行化学修饰,产生多种衍生物,可以使其更适于肝组织工程的实际应用。另外,本实验使用的肿瘤来源的肝细胞系HepG2细胞体外增殖能力强,能够满足临床上对细胞数量的要求,且具有正常肝细胞的某些功能,如合成白蛋白、合成尿素等,不含HBV,在裸鼠模型中的致瘤性小[24],有希望作为肝组织工程的细胞来源。对HepG2细胞进行修饰如进行基因修饰等工作,有望使其也能满足生物人工肝系统对种子细胞代谢能力的要求。
| [1] | Schramm C, Bubenheim M, Adam R, et al. Primary liver transplantation for autoimmune hepatitis: A comparative analysis of the European Liver Transplant Registry[J]. Liver Transplantation, 2010, 16(4): 461-469. |
| [2] | Lee MH, Kim EJ, Lee H, et al. Liposomal Texaphyrin Theranostics for Metastatic Liver Cancer[J]. Journal of the American Chemical Society, 2016, 138(50): 16380-16387. DOI: 10.1021/jacs.6b09713. |
| [3] | Cho CS, Hoshiba T, Harada I, et al. Regulation of hepatocyte behaviors by galactose-carrying polymers through receptor-mediated mechanism[J]. Reactive and Functional Polymers, 2007, 67(11): 1301-1310. DOI: 10.1016/j.reactfunctpolym.2007.07.044. |
| [4] | da Anunciac o A, Mess AM, Orechio D, et al. Extracellular matrix in epitheliochorial, endotheliochorial and haemochorial placentation and its potential application for regenerative medicine[J]. Reproduction in Domestic Animals, 2017, 52(1): 3-15. DOI: 10.1111/rda.2017.52.issue-1. |
| [5] | Rainero E. Extracellular matrix endocytosis in controlling matrix turnover and beyond: emerging roles in cancer[J]. Biochemical Society Transactions, 2016, 44(5): 1347-1354. DOI: 10.1042/BST20160159. |
| [6] | Huang JH, Jiang R, Kortstee A, et al. Transgenic modification of potato pectic polysaccharides also affects type and level of cell wall xyloglucan[J]. J Sci Food Agric, 2016, doi: 10.1002/jsfa.8172. |
| [7] | Shigeyama T, Watanabe A, Tokuchi K, et al. α-Xylosidase plays essential roles in xyloglucan remodelling, maintenance of cell wall integrity, and seed germination in Arabidopsis thaliana[J]. Experimental Botany, 2016, 67(19): 5615-5629. DOI: 10.1093/jxb/erw321. |
| [8] | Benselfelt T, Cranston ED, Ondaral S, et al. Adsorption of Xyloglucan onto Cellulose Surfaces of Different Morphologies: An Entropy-Driven Process[J]. Biomacromolecules, 2016, 17(9): 2801-2811. DOI: 10.1021/acs.biomac.6b00561. |
| [9] | York WS, van Halbeek H, Darvill AG, et al. Structural analysis of xyloglucan oligosaccharides by 1H-N.M.R. spectroscopy and fast-atom-bombardment mass spectrometry[J]. Carbohydrate Research, 1990, 200: 9-31. DOI: 10.1016/0008-6215(90)84179-X. |
| [10] | Seo SJ, Akaike T, Choi YJ, et al. Alginate microcapsules prepared with xyloglucan as a synthetic extracellular matrix for hepatocyte attachment[J]. Biomaterials, 2005, 26(17): 3607-3615. DOI: 10.1016/j.biomaterials.2004.09.025. |
| [11] | Knowles BB, Howe CC, Aden DP. Human hepatocellular carcinoma cell lines secrete the major plasma proteins and hepatitis B surface antigen[J]. Science, 1980, 209(4455): 497-499. DOI: 10.1126/science.6248960. |
| [12] | Schardt C, Rotsch M, Erbil C, et al. Characterization of insulin-like growth factor II receptors in human small cell lung cancer cell lines[J]. Experimental Cell Research, 1993, 204(1): 22-29. DOI: 10.1006/excr.1993.1004. |
| [13] | Shin EJ, Park JH, Sung MJ, et al. Citrus junos Tanaka peel ameliorates hepatic lipid accumulation in HepG2 cells and in mice fed a high-cholesterol diet[J]. BMC Complementary and Alternative Medicine, 2016, 16(1): 499. DOI: 10.1186/s12906-016-1460-y. |
| [14] | Wongtrakul J, Paemanee A, Wintachai P, et al. Nevirapine induces apoptosis in liver (HepG2) cells[J]. Asian Pacific Journal of Tropical Medicine, 2016, 9(6): 547-553. DOI: 10.1016/j.apjtm.2016.04.015. |
| [15] | GeniaLab. Jcprinciple2.gif. http://www.genialabcom/image/Jcprinciple2gif. |
| [16] | Guo XL, Yang KS, Hyun JY, et al. Morphology and metabolism of Ba-alginate-encapsulated hepatocytes with galactosylated chitosan and poly(vinyl alcohol) as extracellular matrices[J]. J Biomater Sci, Polym Ed, 2003, 14(6): 551-565. DOI: 10.1163/15685620360674245. |
| [17] | Klock G, Pfefferrnann A, Ryser C, et al. Biocompatibility of mannuronic acid-rich alginates[J]. Biomoteriols, 1997, 18(10): 707-713. DOI: 10.1016/S0142-9612(96)00204-9. |
| [18] | Koide N, Sakaguchi K, Koide Y, et al. Formation of multicellular spheroids composed of adult rat hepatocytes in dishes with positively charged surfaces and under other nonadherent environments[J]. Experimental Cell Research, 1990, 186(2): 227-235. DOI: 10.1016/0014-4827(90)90300-Y. |
| [19] | Piechocki MP, Toti RM, Fernstrom MJ, et al. Liver cell-specific transcriptional regulation of connexin32[J]. Biochim Biophys Acta, 2000, 1491(1-3): 107-122. DOI: 10.1016/S0167-4781(00)00036-1. |
| [20] | Smetana K Jr. Cell biology of hydrogels[J]. Biomaterials, 1993, 14(14): 1046-1050. DOI: 10.1016/0142-9612(93)90203-E. |
| [21] | Glicklis R, Shapiro L, Agbaria R, et al. Hepatocyte behavior within three-dimensional porous alginate scaffolds[J]. Biotechnology and Bioengineering, 2000, 67(3): 344-353. DOI: 10.1002/(ISSN)1097-0290. |
| [22] | Seo SJ, Park IK, Yoo MK, et al. Xyloglucan as a synthetic extracellular matrix for hepatocyte attachment[J]. J Biomater Sci Polym Ed, 2004, 15(11): 1375-1387. DOI: 10.1163/1568562042368059. |
| [23] | Seo SJ, Akaike T, Choi YJ, et al. Alginate microcapsules prepared with xyloglucan as a synthetic extracellular matrix for hepatocyte attachment[J]. Biomaterials, 2005, 26(17): 3607-3615. DOI: 10.1016/j.biomaterials.2004.09.025. |
| [24] |
郭秀蝉, 蓝祥英, 周玲, 等. 乙型肝炎病毒和黄曲霉素协同作用诱发人肝细胞癌细胞株的建立[J].
病毒学报, 2001, 17(3): 205-209.
Guo XC, Lan XY, Zhou L, et al. Establishment of human hepatocellular carcinoma cell line induced by synergetic effect of hepatitis B virus and aflatoxin[J]. Chinese Journal of Virology, 2001, 17(3): 205-209. |
 2017, Vol. 38
2017, Vol. 38

