临床上盆底肌肉手法按摩及凯格尔运动等康复治疗有助于产后盆底组织恢复,并可用于治疗无症状的盆底功能障碍性疾病,可见适度的机械力刺激有利于维护和修复组织正常结构和功能;超过盆底组织承受力的机械力刺激将会损伤盆底组织,造成盆腔器官脱垂(pelvic organ prolapse, POP)发生。这一临床现象提示我们机械力对盆底组织可能有双向调控作用。文献研究表明细胞增殖和功能活性与动态力学的作用方式、应变大小、作用时间密切相关[1]。
由此可见,不同模式机械力可诱导细胞出现增殖或凋亡两种相反的结果。然而,机械力是否对盆底成纤维细胞也具有修复或损伤的双向调控作用呢?目前国内外尚未见相关报道。为此我们利用四点弯曲细胞力学加载系统建立机械力加载细胞模型干预原代培养的人盆底成纤维细胞。
1 材料与方法 1.1 标本采集与保存经武汉大学人民医院伦理委员会批准并签署患者知情同意书,收集2013年1月到2015年1月于我院因非POP患者行阴式全子宫切除的骶主韧带组织,排除雌激素相关疾病和恶性肿瘤、心血管疾病、糖尿病等有机体氧化应激标志物增高性疾病,且3个月内未使用过激素治疗的患者。采取标本体积大小约0.5 cm×0.5 cm×1 cm,立即放入的无血清高糖DMEM培养基(含有链霉素-青霉素双抗试剂)中,置于无菌冰盒,立即送实验室行成纤维细胞原代培养。
1.2 原代细胞培养原代细胞培养选用改良的酶原消化法。超净台内,将组织用含青霉素-链霉素双抗的PBS清洗3-5遍,至清洗液无色,在高压消毒的小青霉素瓶内,用锋利的眼科剪清除坏死组织及脂肪,并快速将组织剪成大小约1 mm3的碎块,加入3 ml 1% Ⅰ型胶原酶的DMEM(用PBS溶解成1 mg/ml母液储存,使用时再用不含血清的DMEM培养基稀释10倍),巴氏滴管转入培养瓶,放入培养箱37 ℃,消化约2-3 h,每30 min摇动一下,当看到其中组织块已经明显蓬松,液体浑浊显得比较黏稠时,再加入2 ml 0.25%胰蛋白酶辅助消化5 min,最后加入2 ml FBS终止消化。将液体吸入15 ml离心管,300 g/10 min离心,弃上清,收集细胞和组织块沉淀,再用3 ml含15% FBS的DMEM重悬,置于培养箱内(5% CO2,37 ℃饱和湿度),拧松瓶盖,半开放培养。3 d后观察细胞情况并换培养液,以后每隔2 d换一次,并倒掉没能贴壁的组织块残留物和残留的不会贴壁的少量红细胞。当80%-90%成纤维细胞在培养瓶底表面生长并汇合后,予以传代处理,约10-14 d,经过2-3传代后,可获得较纯的成纤维细胞。本实验中选取第4-8代细胞取对数生长期细胞进行研究。采用梯度法进行细胞冻存,依次在-20 ℃冰箱中放置2 h,-80 ℃冰箱过夜,若需长久保存则在-196 ℃液氮罐中冻存备用。
1.3 实验方法 1.3.1 细胞加力步骤① 将应变培养板使用前先用75%乙醇浸泡1 h,在超净工作台内紫外照射过夜;②用预先配制的50 μg/ml鼠尾胶原蛋白(0.1 mmol/L醋酸溶解,配成1 mg/ml的浓缩液体,分装冷藏储存,使用前稀释20倍)包被应力培养板,在超净工作台内紫外照射吹风干燥备用;③选取生长状态良好的3-6代成纤维细胞,采用上述细胞消化方法消化后离心,制成浓度为1.0×105个/ml的单细胞悬液。取1.5 ml均匀平铺到培养板上,每次铺制两块,其中一块加力,一块不加力。小心整体移入5% CO2培养箱中在37 ℃下培养6 h左右。④待细胞基本贴壁后向培养皿内添加适量DMEM培养基(含10% FBS,以没过培养板为宜),继续培养24 h,即为应力加载细胞爬片;⑤用含1% FBS的DMEM培养基换液,继续培养24 h;⑥处理后的细胞爬片换至含10% FBS的DMEM培养基;⑦将细胞爬片转移至经121 ℃、20 min高压灭菌烘干的应变加载培养皿支架上,皿内加入含10% FBS的DMEM培养液50 ml,放入动力系统中进行加力;⑧通过主机设置加力参数:为了研究不同大小的机械力对细胞的作用特点,采用单一变量原则,结合前期预实验结果,根据四点弯曲细胞力学加载系统的参数设置进行分组:①不加力对照组;②1 mm 4 h 0.5 Hz组;③4 mm 4 h 0.5 Hz组。
1.3.2 CCK-8法检测各组加力干预后细胞增殖活性收集上述各组机械力干预后细胞,在96孔板中配置100 μl的细胞悬液;向每孔加入10 μl CCK溶液。将培养板在培养箱内孵育1-4 h。用酶标仪测定在450 nm处的吸光度。
细胞增殖活性(%)=[A(加力组)-A(空白对照组)/A(未加力组)-A(空白对照组)]×100%。实验结果重复3次。
1.3.3 Western Blot① 蛋白提取:取适量组织标本于匀浆器中按照蛋白提取试剂盒的说明提取蛋白,BCA法测定其蛋白浓度;②电泳:取蛋白40 μg及等量上样缓冲液95 ℃、5 min后冷却上样进行电泳;③转膜及封闭,经10% SDS-PAGE凝胶电泳后转移至聚偏二氟乙烯膜上,加封闭液及一抗1:500稀释4 ℃过夜,TBST洗涤4次,10 min/次,将膜与HRP标记的二抗1:500稀释,室温孵育1 h,TBST洗涤4次,10 min/次;④蛋白检测:将显影液加到膜上,曝光显影,用Gel-Doc XR (Bio-Rad Laboratories, Inc., Hercules, CA, USA)图像分析系统进行采图,用Quantity One 4.62软件(Bio-Rad Laboratories, Inc.)予以分析。使用的抗体有:兔抗人的Ⅰ型胶原蛋白抗体,兔抗人的Ⅲ型胶原蛋白抗体,购自英国Abcam公司;Anti-GAPDH抗体,购自美国Santa Cruz公司。
1.4 统计学处理采用SPSS统计软件分析,计量资料采用均数±标准差(x±s)表示,多组独立样本间比较采用单因素方差分析,组间两两比较采用SNK方法,P < 0.05为差异有统计学意义。
2 结果 2.1 CCK-8法检测不同机械力干预后细胞增殖活性不同力学参数加载人盆底成纤维细胞后,与对照组相比,1 mm 4 h 0.5 Hz组细胞增殖活性增强(188.22%±10.53%),4 mm 4 h 0.5 Hz组细胞增殖活性减弱(66.09%±4.06%),差异有统计学意义(P<0.05)。见图 1。
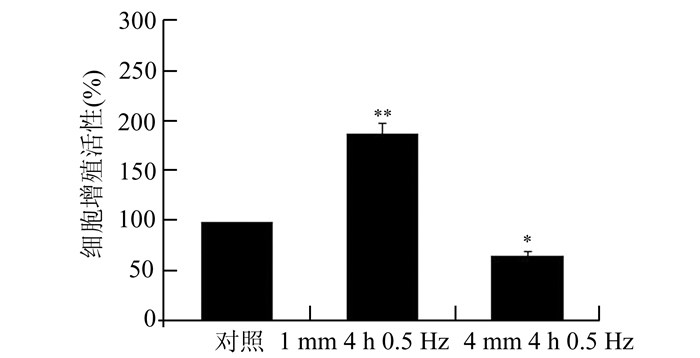
|
图 1 不同机械力加载盆底成纤维细胞的双向作用 与对照组对比,*P<0.05,**P<0.01;n=3 |
经不同大小的力加载细胞4 h后,Western Blot检测各组中Ⅰ、Ⅲ型胶原蛋白表达水平的变化。与不加力对照组相比,1 mm 4 h 0.5 Hz组的人盆底成纤维细胞Ⅰ型胶原蛋白的表达明显上调(P<0.05),而4 mm 4 h 0.5 Hz组的人盆底成纤维细胞Ⅰ型胶原蛋白的表达具有明显下调(P<0.001)。见图 2。
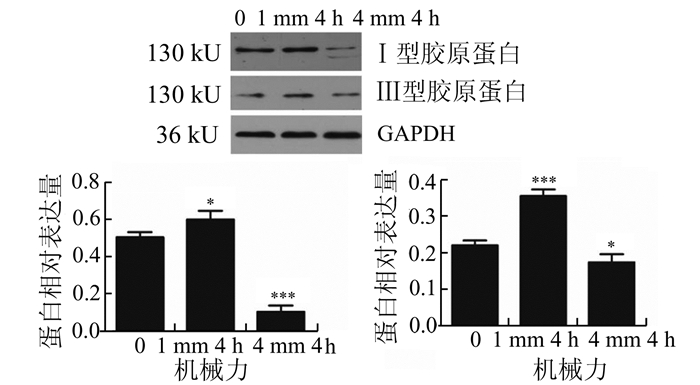
|
图 2 Western Blot检测细胞中Ⅰ、Ⅲ型胶原蛋白的表达结果 与对照组对比,*P<0.05,**P<0.01;n=3 |
Ⅲ型胶原蛋白表达的结果显示,1 mm 4 h 0.5 Hz对人盆底成纤维细胞Ⅲ型胶原蛋白的表达具有明显促进作用(P<0.001),而4 mm 4 h 0.5 Hz对人盆底成纤维细胞Ⅲ型胶原蛋白的表达具有明显抑制作用(P<0.05)。见图 2。
3 讨论机械应力普遍存在于生物界,是生命赖以存活的重要环境因素之一。研究发现,机械应力可以直接影响基因表达水平和蛋白质的活性,进而调控细胞的生物行为和生长活性,扮演细胞命运裁决者的角色[2]。
外界机械应力可以通过细胞外基质(extracellular matrix,ECM)微环境影响细胞命运,ECM微环境多由水合蛋白和多糖组成的物理信号和化学可溶性信号网络,这些信号网络与细胞表面的特异性受体结合,引发一系列复杂的胞内信号效应,从而实现机械应力信号向化学信号转导的过程,促使基因表达的调控,细胞表型的改变,进而引发细胞增殖、存活、迁移和分化等一系列生物学改变。而ECM的主要成分是胶原及弹性蛋白。据研究表明盆底成纤维细胞弹性或胶原蛋白代谢紊乱可能为POP的关键发病机制[3-5]。机械力在盆底功能障碍性疾病中扮演角色,目前尚不明确。
临床上盆底肌肉手法按摩及凯格尔运动等康复治疗有助于产后盆底组织恢复,并可用于治疗无症状的盆底功能障碍性疾病。而妊娠、分娩、排便、咳嗽等导致腹压增大的牵张力对女性盆底支持组织损伤与POP发生发展密切相关[6-8]。可见机械力的作用模式决定了其对盆底组织修复或损伤的生物学效应。有文献报道适度的机械力刺激可促进成骨细胞增殖分化及合成胶原蛋白能力[9];而损伤水平机械力学刺激将对颌骨成骨细胞造成损害,细胞凋亡比例增加[10]。因此,我们推测不同模式机械力对盆底组织可能有双向调控作用。
本实验研究发现1 mm 4 h 0.5 Hz的机械力作用可促进盆底成纤维细胞增殖,上调Ⅰ、Ⅲ型胶原蛋白的表达,而4 mm 4 h 0.5 Hz的机械力作用却明显抑制盆底成纤维细胞增殖,下调Ⅰ、Ⅲ型胶原蛋白的表达;本课题组前期研究结果显示4 mm 4 h 0.5 Hz的机械力可促进细胞凋亡及老化[11]。上述研究结果首次证实机械力对盆底组织有损伤或修复的双向调控作用,其机制可能为机械力对盆底成纤维细胞具有促增殖或损伤双向调控作用,并双向调控Ⅰ、Ⅲ型胶原蛋白代谢。由此可见,生理水平机械力作用修复盆底组织,而损伤水平机械力作用可造成盆底组织损害,造成POP发病。
| [1] | Irvine KD, Shraiman BI. Mechanical control of growth: ideas, facts and challenges[J]. Development, 2017, 144(23): 4238-4248. DOI: 10.1242/dev.151902. |
| [2] | Carter PJ. Lippincott's textbook for nursing assistants: a humanistic approach to caregiving[M]. 3rd ed. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2012: 862. |
| [3] | Zhou Y, Ling O, Bo L. Expression and significance of lysyl oxidase-like 1 and fibulin-5 in the cardinal liga-ment tissue of patients with pelvic floor dysfunction[J]. J Biomed Res, 2013, 27: 23-28. |
| [4] | Konovalov P, Mitrofanova L. The characteristic of connective tissue of myometriumin women with pelvic organ prolapse[J]. Virchows Archiv, 2015, 467: S138-S138. |
| [5] | Li BS, Hong L, Min J, et al. The expression of glutathione peroxidase-1 and the anabolism of collagen regulation pathway transforming growth factor-β1-connective tissue growth factor in women with uterine prolapse and the clinic significance[J]. Clin Exp Obstet Gynecol, 2013, 40(3): 586-590. |
| [6] | Gyhagen M, Bullarbo M, Nielsen TF, et al. Prevalence and risk factors for pelvic organ prolapse 20 years after childbirth: a national cohort study in singleton primiparae after vaginal or caesarean delivery[J]. BJOG: An International Journal of Obstetrics & Gynaecology, 2013, 120(2): 152-160. |
| [7] |
万纷纷, 毛宝宏, 陈亚, 等. 盆腔器官脱垂的危险因素研究进展[J].
国际妇产科学杂志, 2017, 44(1): 99-102.
Wan FF, Mao BH, Chen Y, et al. The risk factors of pelvic organ prolapse[J]. J Int Obstet Gynecol, 2017, 44(1): 99-102. |
| [8] | Vergeldt TFM, Weemhoff M, IntHout J, et al. Risk factors for pelvic organ prolapse and its recurrence: a systematic review[J]. J Urol, 2015, 26(11): 1559-1573. |
| [9] | Tripuwabhrut P, Mustafa M, Gjerde CG, et al. Effect of compressive force on human osteoblast-like cells and bone remodelling: an in vitro study[J]. Arch Oral Biol, 2013, 58(7): 826-836. DOI: 10.1016/j.archoralbio.2013.01.004. |
| [10] | Jacobs C, Grimm S, Ziebart T, et al. Osteogenic differentiation of periodontal fibroblasts is dependent on the strength of mechanical strain[J]. Archives of Oral Biology, 2013, 58(7): 896-904. DOI: 10.1016/j.archoralbio.2013.01.009. |
| [11] | Hong S, Li H, Wu D, et al. Oxidative damage to human parametrial ligament fibroblasts induced by mechanical stress[J]. Mol Med Rep, 2015, 12(4): 5342-5348. DOI: 10.3892/mmr.2015.4115. |
 2018, Vol. 39
2018, Vol. 39


