2. 武汉大学基础医学院药理学系 湖北 武汉 430071;
3. 中南大学湘雅三医院/卫生部移植医学工程技术研究中心 湖南 长沙 410013
2. Dept. of Pharmacology, Wuhan University School of Basic Medical Sciences, Wuhan 430071, China;
3. The 3rd Xiangya Hospital of Central South University & Research Center of National Health Ministry on Transplantation Medicine Engineering and Technology, Changsha 410013, China
脑死亡供体已成为我国心脏移植供体的主要来源,但脑死亡会影响机体血流动力学稳定,扰乱机体激素的正常分泌,干扰神经-体液调节等多种生理效应,引发机体一系列病理反应,造成供体心脏形态结构和生理功能异常,导致临床上移植物存活率降低,直接影响患者移植成功率及预后状况[1-3]。本文通过建立家兔脑死亡模型,模拟临床上脑死亡状态,观察不同时间点心脏形态结构及细胞凋亡相关指标的变化,探讨其作用机制,以期为临床上脑死亡心脏供体的利用和评价提供理论依据。
1 材料与方法 1.1 材料 1.1.1 实验动物健康成年新西兰雄兔30只,体质量(2.9±0.3)kg,14周龄,购自武汉万千佳禾实验动物养殖中心,动物许可证号:SCXK(鄂)2007-0006,饲养于SPF级环境中,温度保持在22-28 ℃,相对湿度40%-60%,不限制食物和水。
1.1.2 主要试剂与仪器HX-100E动物呼吸机(成都泰盟科技有限公司)、BL-420生物机能实验系统(成都泰盟科技有限公司)、JR1/2智能恒温控制仪(成都泰盟科技有限公司)、多功能心电监护仪(美国惠普公司)、Foley 18F气囊导管(美国Baxter公司)、动物手术台(兴化市同昌不锈钢制品厂)、颅骨钻及常规手术器械[上海医疗器械(集团)有限公司手术器械厂]、RevertAidTM反转录试剂盒(美国Fermentas公司)、抗PCNA、Caspase3单克隆抗体(美国Abcam公司)辣根过氧化物酶(HRP)标记的山羊抗小鼠单克隆抗体(SC-2005)(美国Santa Cruz公司)、盐酸多巴胺注射液(20 mg/2 ml,批号:1005045)(上海禾丰制药有限公司)。
1.2 方法 1.2.1 实验分组及干预30只家兔随机均分为2组,即:假实验组(n=15):行股动脉插管、气管插管及颅骨钻孔置管术,不行颅内加压脑死亡术,持续麻醉维持,按时间点采集标本;脑死亡组(n=15):行股动脉插管、气管插管、颅骨钻孔置管及颅内加压脑死亡术,呼吸机维持脑死亡状态,按时间点采集标本。各组均在术后2,6和8 h时间点取心尖组织标本,每个时间点5只。
1.2.2 脑死亡模型的建立采用兔缓慢颅内加压法建立脑死亡模型。实验兔术前12 h禁食,自由饮水。称质量后,按500 mg/kg剂量耳缘静脉注射戊巴比妥维持全身麻醉。左侧腹股沟纵行切口,暴露出左侧股动脉、股静脉,分别行血管插管,股动脉接压力换能器,股静脉连接微量注射泵。同时,行气管切开术,连接呼吸机,行机械通气支持。完成上述步骤后,将实验兔仰卧位固定,用颅骨钻沿颅骨正中线开颅,于硬脑膜外腔置入Foley 18F气囊导管,并向气囊导管中缓慢注水加压,先按3 ml/min的速度注入生理盐水1 ml,密切观察脑电图、心率、血压变化5 min;待生命体征平稳后,再继续注水,直至成功建立兔脑死亡模型。在排除麻醉等导致可逆性昏迷的因素前提下,观察到脑电图静息30 min以上,且家兔瞳孔对光反射,角膜反射均消失,仅靠呼吸机维持呼吸,即可判定为脑死亡。
1.2.3 标本的收集在确定脑死亡后,分别于2,6,8 h 3个时间点摘取其心脏,剪成小组织块,部分置于冻存管中于-80 ℃冰箱保存,用以反转录酶-聚合酶链锁反应(reverse transcription-polymerase chain reaction, RT-PCR)检测Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、含半胱氨酸的天冬氨酸蛋白水解酶9(cysteinyl aspartate specific proteinase 9,Caspase9) mRNA的表达。另一部分经体积分数10%的甲醛溶液固定后,以石蜡包埋,用以常规切片,用苏木精-伊红染色法检测各组织的形态学变化情况及免疫组织化学法检测增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)、Caspase3的表达。
1.2.4 RT-PCR法检测心脏组织中Bax、Caspase9 mRNA的表达取出冻存的组织,用液氮研磨至粉末状,TRIzol法提取RNA,用RevertAidTM反转录试剂盒得cDNA后进行PCR扩增。PCR扩增Bax、Caspase9及GAPDH的引物序列如下:Bax:F:5′-TGCAGAGGATGATTGCTGAC-3′,R:5′-GAGGACTCCAGCCACAAAGA-3′;Caspase9:F:5′-AATCCTGCTTGGGTATCAGG -3′,R:5′-GAGA CCCAGTCTCAGGGAAA-3′;GAPDH:F:5′-TC TGGCAAAGTGGATGTTGTC-3′,R:5′-TCACGC CCATCACAAACAT-3′,由上海英骏生物公司合成。PCR产物用2%的琼脂糖凝胶电泳检测,对目的条带进行灰度扫描。Bax及Caspase9 mRNA的相对表达量=该目的条带灰度值/同一标本GAPDH灰度值,并对表达量进行统计学分析。
1.2.5 免疫组化法检测PCNA、Caspase3蛋白的表达石蜡切片经70 ℃烘烤40 min后依次置于二甲苯中脱蜡,并依次置于50%,70%,100%乙醇溶液中进行脱水,置于体积分数为3%的甲醇-过氧化氢溶液中浸泡5 min以灭活内源性过氧化物酶,微波修复抗原。PBS洗涤2次后,滴加5%BSA,室温封闭20 min后除尽液体。加PCNA、Caspase3一抗,于4 ℃孵育过夜。用PBS洗涤后滴加辣根过氧化物酶标记的羊抗兔二抗,室温孵育1 h。PBS洗涤,加二氨基联苯胺(DAB)显色,苏木精复染细胞核,梯度脱水,二甲苯封闭,镜检。细胞中出现黄色颗粒者为阳性细胞。
1.2.6 观察指标脑死亡后各组家兔动脉血压、心率;苏木精-伊红染色观察心肌组织形态学变化;RT-PCR法检测心脏组织中Bax、Caspase9 mRNA的表达;免疫组化法检测PCNA、Caspase3蛋白的表达。
1.2.7 统计学分析采用SPSS 21.0统计软件进行ANOVA统计分析。计量资料均采用以均数±标准差表示,以P<0.05为差异有统计学意义。
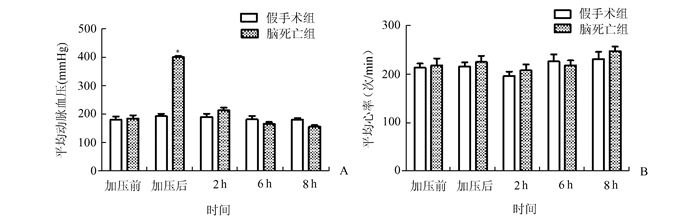
2 结果 2.1 家兔动脉血压和心律变化监测加压前及加压后2,6和8 h时间点家兔动脉血压变化,发现假手术组平均动脉血压维持稳定,各时间点所测血压无统计学差异(P>0.05)。就脑死亡组而言,在脑死亡之前,动脉血压随注水量的增加而升高,直至达到400 mmHg,此时家兔出现脑死亡。此后,动脉血压因失去外界加压作用而逐渐下降至正常水平,加压后各时间点均与假手术组心率无明显差异(P>0.05)。见图 1。
|
图 1 家兔颅内加压前后动脉血压、心率变化 *与同组加压前比较,P < 0.05;A:家兔颅内加压前及加压后2、6、8 h平均动脉压; B:家兔颅内加压前及加压后2、6和8 h心率 |
监测加压前及加压后2,6和8 h时间点家兔心率变化,发现假手术组与脑死亡组心率均未发生明显变化,且两组间心率也无明显差异(P>0.05)。
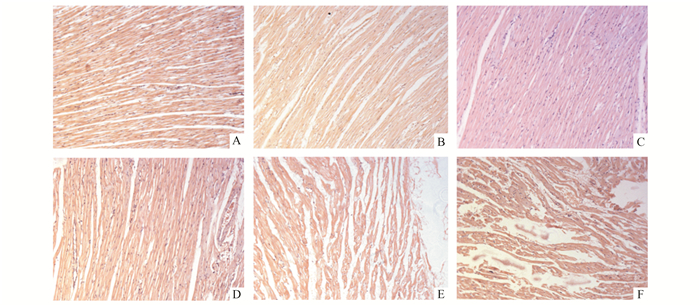
2.2 脑死亡状态下心脏组织学形态变化观察心尖组织病理切片(图 2),结果发现,假手术组:心肌纤维呈短柱状,交织成网,结构完整,染色均匀,细胞核呈卵圆形,位于细胞中央。术后2,6和8 h,心脏组织形态无明显改变。脑死亡组:2 h时,心肌组织可见血管周围轻微水肿,出现炎症细胞;6 h时,心肌细胞皱缩,网状结构不完整,细胞间隙增大,炎症细胞浸润并可见血细胞分布,部分心肌细胞核周围成空泡状,出现核固缩;脑死亡8 h,细胞皱缩明显加剧,部分凋亡样细胞与周围细胞分离,心肌纤维发生断裂,网状结构消失,间质水肿严重,伴随明显出血现象。
|
图 2 两组家兔心尖组织形态变化(HE×200) A-C:假手术组在术后2,6,8 h;D-F:实验组脑死亡后2,6,8 h |
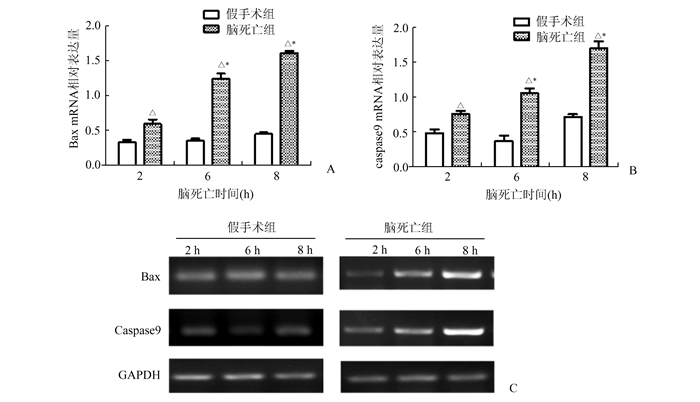
通过RT-PCR检测(图 3),可见假手术组Bax mRNA表达量低且稳定,而脑死亡组中Bax mRNA表达量明显高于假手术组(P<0.05)。同样,脑死亡组中Caspase9 mRNA各时间点的表达量逐渐增加,且均高于假手术组。
|
图 3 各时间点Bax及Caspase9 mRNA表达量 *与同组前一时间点比较,P < 0.05;△与假手术组同一时间点比较,P < 0.05;A:不同时间点两组Bax mRNA相对表达量;B:不同时间点两组Caspase9 mRNA相对表达量;C:Bax,Caspase9 mRNA电泳结果(GAPDH为内参) |
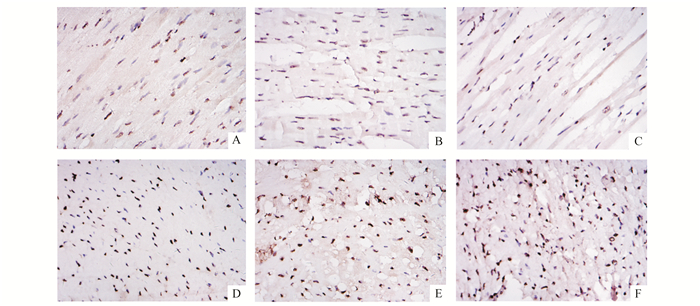
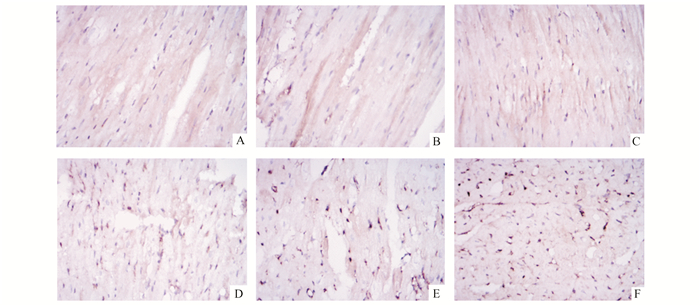
经免疫组化检测发现,假手术组PCNA、Caspase3蛋白表达量均无统计学差异(P>0.05);脑死亡组较假手术组而言,各时间点测得PCNA蛋白表达量均较高,且6,8 h两组明显高于2 h(P<0.05);同样,脑死亡组Caspase3蛋白表达量随时间的延长而增加,且均高于对应时间点假手术组蛋白表达量(图 4, 5)。
|
图 4 心脏组织PCNA蛋白表达量情况(DAB-苏木精染色×400) A-C:假手术组术后2,6,8 h;D-F:脑死亡组脑死亡后2,6,8 h |
|
图 5 心脏组织Caspase3蛋白表达量情况(DAB-苏木精染色×400) A-C:假手术组术后2,6,8 h;D-F:脑死亡组脑死亡后2,6,8 h |
目前我国脑死亡供体已成为器官移植供体的主要来源。多种原因导致的脑死亡会使机体发生多种病理改变,与活体移植相比,移植器官原发性无功能发生率、排斥反应发生率均较高[5],故研究脑死亡状态下器官的形态变化及损伤机制具有重要意义。本实验建立家兔脑死亡模型,探讨其损伤机制,为临床心脏移植质量的评估提供实验基础。
实验发现,脑死亡后家兔动脉血压及心率均无明显波动,说明通过呼吸机辅助呼吸及血管活性药物等措施,在一定时间内可以维持心脏的正常生理功能。通过对脑死亡后各时间点心尖组织的形态结构观察,结果发现,与假手术组相比,脑死亡组心肌组织出现细胞皱缩,细胞核固缩深染,凋亡样细胞与周围正常细胞分离等显著形态改变,且随时间的推移,改变加剧,提示脑死亡状态对心脏等器官的影响是一个渐进和累积的过程,且可能与细胞凋亡的程度和数量相关。
为进一步探究其作用机制,我们分别采用了RT-PCR法和免疫组化法测定了家兔脑死亡后各时间点心肌组织中Bax,Caspase9 mRNA及PCNA,Caspase3蛋白的表达量。结果发现,以上4个细胞凋亡相关因子在脑死亡组中的表达量均显著高于假手术组,且与脑死亡时间成正相关。此检测结果与心脏组织形态结构的病理改变趋势一致,进一步证实脑死亡状态下心脏质量的好坏与细胞凋亡存在相关性。
细胞凋亡主要有三条信号转导途径,即内源性线粒体途径,死亡受体介导的外源性凋亡途径和p53基因依赖的信号途径[6, 7],且Bax,Caspase9,Caspase3及PCNA均分别直接或间接参与以上各途径并在其中发挥关键作用。
Bax作为B淋巴细胞瘤-2(B-cell lymphoma-2,BCL-2)基因家族中的一员,可通过形成二聚体促进线粒体外膜的透化(mitochondrial outer membrane permeabilization,MOMP),促使细胞色素C向胞质释放,进而激活衔接蛋白-1(adapter proteins,Apaf-1)[8]。后者可与起始凋亡蛋白酶Caspase9结合,并与细胞色素C一起形成凋亡小体,活化Caspase级联反应,以激活下游的效应凋亡蛋白酶,使其水解相关蛋白,破坏细胞正常结构并使DNA断裂,最终导致细胞凋亡[9]。本实验发现脑死亡组中Bax、Caspase9一致的高表达,从分子层面证实脑死亡状态下心脏确实存在大量心肌细胞凋亡,且可能通过激活内源性线粒体凋亡途径实现。
Caspase3作为效应凋亡蛋白酶,主要是通过Fas/FasL介导的死亡受体凋亡途径而激活,直接执行细胞凋亡的生理功能。此外,由于Caspase3处于信号传导途径的下游,通过体内多条信号网络,可由Caspase2,8,9,10等多种因子和路径而激活,故Caspase3是反映细胞凋亡状态的重要指标[10]。Caspase3表达量明显增加,提示除内源性通路外,脑死亡状态亦可能通过死亡受体等其他途径诱导心肌细胞凋亡。
PNCA是DNA聚合酶δ的辅助蛋白,参与DNA损伤修复,细胞周期调控及细胞凋亡等多个生理过程[11]。已有实验发现[12],使用细胞周期素依赖激酶(cyclin dependent kinase,CDK)可以通过抑制PNCA的表达进而减少Caspase3的生成,从而降低脑缺血后再灌注导致的神经元死亡。说明PNCA虽未直接参与细胞凋亡途径,但可以通过调控关键因子,间接调节该通路的信号传递。本实验中,脑死亡组PNCA表达量显著高于假手术组,提示细胞可能通过PCNA的高表达,扩大细胞凋亡传导信号和生理效应,间接促使细胞程序性死亡。
综上所述,由于脑死亡状态使机体血流动力学,内分泌系统,神经体液调节等多个系统发生改变,导致内环境稳态失衡,心脏等器官可能通过多种途径,自发诱导细胞程序性死亡以适应机体内环境的变化,最大限度维持心脏的生理功能。实验发现脑死亡状态下,短时间内心脏生理功能无明显变化,但其组织结构已出现异常,故为保证临床移植供体的生物活性和正常功能,应尽快实施手术,防止心肌细胞过度凋亡而造成心脏不可逆的功能丧失。同时,临床上也应采取对应措施,阻断细胞凋亡传导途径,降低心肌细胞凋亡的速度,以保证移植物的质量,为移植争取时间。
| [1] | Belzberg H, Shoemaker WC, Wo CC, et al. Hemodynamic and oxygen transport patterns after head trauma and brain death: implications for management of the organ donor[J]. J Trauma, 2007, 63(5): 1032-1042. DOI: 10.1097/01.ta.0000235995.86162.d2. |
| [2] | Ranasinghe AM, Bonser RS. Endocrine changes in brain death and transplantation[J]. Best Pract Res Clin Endocrinol Metab, 2011, 25(5): 799-812. DOI: 10.1016/j.beem.2011.03.003. |
| [3] | Floerchinger B, Oberhuber R, Tullius SG. Effects of brain death on organ quality and transplant outcome[J]. Transplant Rev (Orlando), 2012, 26(2): 54-59. DOI: 10.1016/j.trre.2011.10.001. |
| [4] | Cohen O, De La Zerda DJ, Beygui R, et al. Donor brain death mechanisms and outcomes after heart transplantation[J]. Transplant Proc, 2007, 39(10): 2964-2969. DOI: 10.1016/j.transproceed.2007.08.102. |
| [5] | Chi SW. Structural insights into the transcription-independent apoptotic pathway of p53[J]. BMB Rep, 2014, 47(3): 167-172. DOI: 10.5483/BMBRep.2014.47.3.261. |
| [6] | Goldar S, Khaniani MS, Derakhshan SM, et al. Molecular mechanisms of apoptosis and roles in cancer development and treatment[J]. Asian Pac J Cancer Prev, 2015, 16(6): 2129-2144. DOI: 10.7314/APJCP.2015.16.6.2129. |
| [7] | Lee SY, Ko KW, Kang WK, et al. Induction of the intrinsic apoptotic pathway by 3-deazaadenosine is mediated by BAX activation in HL-60 cells[J]. Korean J Physiol Pharmacol, 2010, 14(6): 407-412. |
| [8] | Reubold TF. Eschenburg SA molecular view on signal transduction by the apoptosome[J]. Cell Signal, 2012, 24(7): 1420-1425. DOI: 10.1016/j.cellsig.2012.03.007. |
| [9] | Jia LT, Chen SY, Yang AG. Cancer gene therapy targeting cellular apoptosis machinery[J]. Cancer Treat Rev, 2012, 38(7): 868-876. DOI: 10.1016/j.ctrv.2012.06.008. |
| [10] | Strzalka W, Ziemienowicz A. Proliferating cell nuclear antigen (PCNA): a key factor in DNA replication and cell cycle regulation[J]. Ann Bot, 2011, 107(7): 1127-1140. DOI: 10.1093/aob/mcq243. |
| [11] | Muller R, Misund K, Holien T, et al. Targeting proliferating cell nuclear antigen and its protein interactions induces apoptosis in multiple myeloma cells[J]. PLoS One, 2013, 8(7): e70430. DOI: 10.1371/journal.pone.0070430. |
| [12] |
张梁, 赵同峰, 王伟, 等. 周期素依赖激酶抑制剂对大鼠大脑中动脉缺血后海马迟发性神经元死亡的影响[J].
中国药学杂志, 2004, 39(8): 28-31.
Zhang L, Zhao TF, Wang W, et al. Effects of cydm-dependent kinase Whibiter on delayed neuronal death of hippocampus in rats after MCA occlusion[J]. Chin Pham J, 2004, 39(8): 28-31. |
 2018, Vol. 39
2018, Vol. 39


