2. 华中科技大学同济医学院附属同济医院口腔医学中心 湖北 武汉 430030
2. Dept. of Stomatology, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan 430030, China
健康牙髓组织损伤后具有一定的再生修复能力。当牙齿受到剧烈的外界刺激时,牙髓能够分泌形成修复性牙本质抵御外界刺激。许多实验研究表明,体外培养的牙髓细胞(dental pulp cell,DPC)能够分化形成成牙本质样细胞,并形成类似牙本质-牙髓复合体样的结构[1]。因此探讨牙髓细胞的成牙分化调控机制对于揭示牙髓的损伤再生机制具有重要的理论意义。
目前,对于牙髓细胞成牙本质向分化的调控机制主要集中于信号通路水平,转录因子水平,microRNA等转录后调控水平。近年来的研究表明,表观遗传学机制在机体的发育及干细胞分化中发挥着重要作用。其中DNA甲基化和组蛋白修饰是表观遗传学重要调控机制,该机制通过改变染色质的结构影响转录因子与靶基因作用元件的结合。一般认为,组蛋白H3的Lys4甲基化(H3K4me)参与基因表达的开放,而组蛋白H3的Lys27甲基化(H3K27me)以及基因启动子的甲基化对基因表达起抑制作用[2]。牙本质涎磷蛋白(dentin sialophosphoprotein, DSPP)基因是调控牙齿发育的重要基因之一,在矿化组织发育过程中发挥着重要的作用。DSPP的表达能够被Runx2、smad3等转录因子转录水平进行调节及microRNA转录后水平调节[3],然而其是否涉及表观遗传学修饰的改变尚不清楚。
本研究采用DPC体外培养诱导成牙本质向分化,观察成牙本质向分化过程中的DSPP基因甲基化修饰和组蛋白修饰的改变,分析DPC成牙本质向分化过程中表观遗传学机制的作用,对揭示DPC的成牙本质向调控机制具有重要的理论意义,并对促进牙髓损伤修复药物的开发具有重要的临床指导意义。
1 材料与方法 1.1 人牙髓细胞的分离和培养选取临床上13-18岁因正畸治疗需拔除的健康、完整的双尖牙。无菌条件下劈开牙冠及牙根,取出牙髓,将获得的牙髓组织剪碎后,用培养基冲洗3次,将牙髓组织浸泡于原代细胞培养基中。用眼科剪将牙髓组织剪碎至大小约为1 mm3,均匀地贴附于T25细胞培养瓶的底壁。置入37 ℃、5%CO2细胞培养箱内培养。每隔3 d更换一次培养液。2周后,细胞传代。取生长良好的第3代细胞用于后续实验研究。
1.2 DPC体外成牙本质向诱导以2×105个/孔的密度接种DPC于6孔板中,加入成牙本质细胞矿化诱导液(α-MEM完全培养基,10 mmol/L β-磷酸甘油钠,10 nmol/L地塞米松,50 g/L抗坏血酸)[4],每3 d更换一次分化诱导液。倒置相差显微镜下观察记录细胞的生长状况。
1.3 茜素红染色在成牙诱导的第7天和第14天,吸去诱导液,PBS缓冲液小心地洗培养物2次后,用新鲜配置的4%多聚甲醛固定30 min,PBS洗3次,每次5 min,每空加入2 ml的0.2%茜素红染液,在37 ℃孵育30 min后,PBS洗3次,镜下观察矿化结节的形成情况并拍照记录。
1.4 DNA甲基化水平检测采用重亚硫酸盐测序法(Bisulfite sequencing PCR)检测DNA甲基化水平的改变。首先使用Axygen公司的试剂盒提取DNA。具体提取步骤按试剂说明书操作。用紫外分光光度计检测DNA的含量和纯度。取2 μg DNA用超纯水稀释至50 μl,经NaOH变性处理后,加入DNA重亚硫酸钠修饰试剂(10 mmol/L Hydroquinone和3.6 mol/L Sodium bisulfite),避光56 ℃水浴中反应16 h。修饰后DNA通过Wizard DNA Clean-up System(Promega)纯化,去磺基和脱盐处理后,溶于20 μl TE溶液。修饰后DNA经甲基化特异性引物进行扩增(见表 1)。反应条件为: 95 ℃预变性5 min;95 ℃变性15 s,49 ℃退火15 s,72 ℃延伸25 s,反应40个循环;最后72 ℃延伸5 min。PCR扩增产物通过2.5%琼脂糖凝胶电泳分离,切取目的条带位置的凝胶。采用Axygen(公司的凝胶纯化试剂盒,按照说明书步骤纯化回收目的片段,回收的DNA产物参照Takara公司提供的优化体系和步骤连接T载体,转化DH5α感受态细胞后涂于含有氨苄青霉素的LB琼脂平板,每组挑取20个单菌落,在LB液体培养基中培养12 h后进行PCR鉴定,将鉴定为阳性的克隆的样本取1 ml送测序公司测序,测序由上海生工生物工程公司完成。测序获得的序列采用DNA甲基化分析软件BiQ Analyzer分析,并输出检测片段的甲基化结果。
| 表 1 Real-time PCR、Bisulfite sequencing和ChIP使用的引物序列 |
染色质免疫共沉淀(Chromatinimmunoprecipitation,ChIP)参考Gopinathan的方法[5]。在DPC成牙诱导分化的第0天和14天,在培养基中加入甲醛至终浓度为1%,37 ℃交联固定10 min,用含Protease Inhibitor Cocktail(PTC,Roche公司)的冰冷PBS洗细胞2次,细胞刮收集细胞,1 000 g离心10 min,去除上清,每106细胞加入0.2 ml含PTC的ChIP裂解缓冲液(1% SDS,5 mmol/L Tris-HCl)冰上裂解细胞10 min。将裂解后的细胞在4 ℃用超声破碎机断裂染色质。取20 μl超声处理后的样本作为Input溶液,放入-20 ℃保存;取200 μl作免疫沉淀组和阴性对照组,加入1.8 ml ChIP dilution buffer后再加入5 μl免疫沉淀抗体,4 ℃孵育12 h后,加入蛋白G-磁珠吸附免疫复合物,在磁力架上顺序用低盐、高盐和TE缓冲液清洗沉淀复合物后,用洗脱缓冲液洗脱得到蛋白质/DNA交联物。把Input溶液加入相同体积的洗脱缓冲液后,在NaCl作用下65 ℃水浴中解交联4 h,通过苯酚/氯仿抽提获得DNA片段并在-20 ℃保存。
1.6 Real-timePCR收集成牙诱导第0天、7天和14天的细胞。采用Trizol (Invitrogen)提取总细胞总RNA,采用PrimeScriptTM RT反转录试剂盒(RR047,Takara)合成cDNA。PCR引物序列见表 1,引物委托上海生工生物工程公司合成。采用SYBR Premix DimerEraserTM荧光定量试剂盒(RR091,Takara),应用Bio-Rad IQ2定量PCR仪,检测各模板的Ct值。通过检测Ct值进行相对定量分析,其中GAPDH (Glyceraldehyde-3-phosphate dehydrogenase)作为内对照。
1.7 统计学分析采用Sigmastat 9.0软件对数据处理,两组数据间的比较采用Student’s t检验,P<0. 05认为差异有统计学意义。
2 结果 2.1 DPC培养情况及形态学观察采用改良组织块法原代培养人DPC,培养4-5 d时组织块周围有少量细胞游出(图 1A),10-12 d时细胞聚集在组织块周围,细胞达培养皿底面积约80%时进行首次传代。在培养至第3代时,细胞状态良好,胞质均匀,多呈长梭形,呈集落样成长(图 1B)。
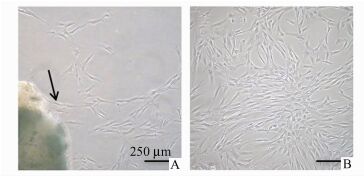
|
图 1 人DPC的原代和传代培养 A:原代培养的DPC从组织块周围游出(箭头所示);B:传至第3代的DPC |
采用茜素红染色观察DPC向成牙本质向分化过程中形成矿化结节的情况。倒置显微镜下观察,在分化诱导的第7天,有散在的矿化小结节形成(图 2A)。在分化诱导的第14天时出现成片的大结节团块(图 2B)。
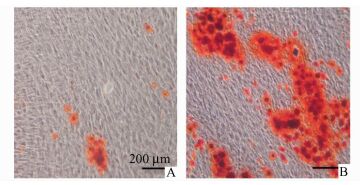
|
图 2 茜素红染色检测矿化结节的形成 A:诱导DPC分化第7天组;B:诱导DPC分化第14天组 |
Real-time PCR方法检测DPC成牙本质向分化相关基因DSPP、BSP和OCN的mRNA的表达水平。DSPP是牙齿发育的关键基因,也是成牙本质向分化重要的标记性基因,如图 4显示,在DPC成牙本质向分化诱导后第7天DSPP的mRNA的表达水平呈明显的升高,诱导后第14天,DSPP的mRNA的表达水平较第7天组有显著性升高;BSP和OCN的mRNA表达呈相同的趋势(图 3)。
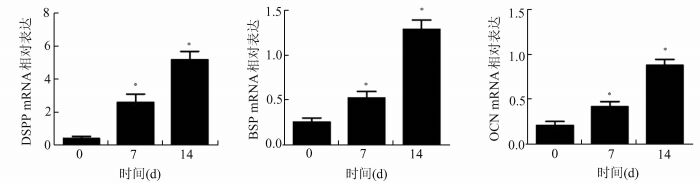
|
图 3 DPC成牙本质分化过程中DSPP基因的表达 Real-time PCR检测DPC成牙本质向分化过程中的第0天、第7天和第14天的DSPP mRNA表达;*P<0.05,与前一实验组比较 |

|
图 4 DPC成牙分化过程中DSPP基因甲基化修饰的改变 |
基因测序结果显示,在未诱导分化的第3代DPC,DSPP基因呈现一定水平的甲基化(77.5%),在成牙本质向诱导的第14天,DSPP基因甲基化水平明显降低(37.5%),是未诱导分化组甲基化水平的1/2(图 4)。
2.5 DPC成牙本质向分化过程中DSPP基因的组蛋白修饰为探讨DPC成牙本质向分化过程中DSPP基因的组蛋白修饰模式的变化,采用ChIP方法检测了DSPP转录起始区域的中H3K4me3和H3K27me3修饰水平的变化。如图 5所示,与转录激活相关的H3K4me3修饰水平在诱导成牙本质向分化的第14天时募集增加;与之对应的,转录抑制相关的组蛋白修饰模式H3K27me3在诱导分化的第14天显著降低(图 5)。
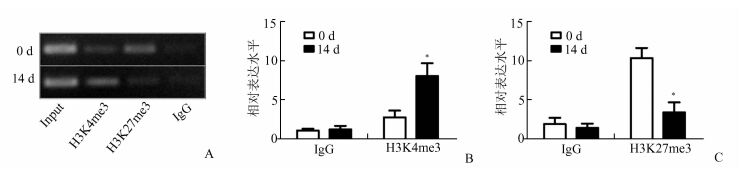
|
图 5 DPC成牙本质向分化过程中DSPP基因组蛋白修饰的改变 A:琼脂糖凝胶电泳观察ChIP结果;B和C:Real-time PCR分析ChIP结果,每组的Input作为内参照;*P<0.05,与相同实验组第0天比较 |
牙髓细胞具备多向分化的潜能,其在牙齿的损伤修复中起着重要作用。牙髓细胞是一种混杂细胞,包含不同分化程度的祖细胞。目前认为严重刺激后修复性牙本质的形成是由这些具有分化能力的祖细胞群共同参与形成,而不仅仅由某种单一细胞参与完成[6]。本研究中通过体外诱导,实现了牙髓细胞向成牙本质向分化。
干细胞分化的过程涉及多种转录因子的调节及对应的分化特异性基因的表达改变。表观遗传学调控在发育和分化的关键节点起重要的作用,通过调整染色质的结构,暴露转录因子的结合位点。目前已知,组蛋白去乙酰化酶抑制剂能够促进牙髓细胞矿化[7]。最近,Wang等的研究发现组蛋白乙酰化酶p300能够调控牙髓细胞分化过程中DSPP、DMP和DSP等多种成牙相关基因的表达[8]。其中DSPP是牙本质矿化所必需的非胶原蛋白,在牙齿发育和成牙分化中具有关键作用[9]。然而在成牙分化过程中表观遗传学修饰的改变是否参与到DSPP表达的调控还未见报道。
本研究发现,DPC的体外成牙本质向过程中,DSPP的表达逐渐增高。DSPP转录起始区域DNA甲基化水平降低,由抑制性组蛋白修饰模式H3K27me3转变为开放性组蛋白修饰模式H3K4me3。这说明DPC成牙本质向分化过程中,基因的表观遗传学修饰参与到DSPP基因表达的调控。这为进一步研究DPC定向分化的机制及促进牙髓损伤修复药物的开发提供理论基础。
| [1] | Kumabe S, Nakatsuka M, Kim GS, et al. Human dental pulp cell culture and cell transplantation with an alginate scaffold[J]. Okajimas Folia Anat Jpn, 2006, 82(4): 147-155. DOI: 10.2535/ofaj.82.147. |
| [2] | De Gobbi M, Garrick D, Lynch M, et al. Generation of bivalent chromatin domains during cell fate decisions[J]. Epigenetics Chromatin, 2011, 4(1): 9. DOI: 10.1186/1756-8935-4-9. |
| [3] | Cho YD, Yoon WJ, Woo KM, et al. The canonical BMP signaling pathway plays a crucial part in stimulation of dentin sialophosphoprotein expression by BMP-2[J]. J Biol Chem, 2010, 285(47): 36369-36376. DOI: 10.1074/jbc.M110.103093. |
| [4] | Han N, Zheng Y, Li R, et al. beta-catenin enhances odontoblastic differentiation of dental pulp cells through activation of Runx2[J]. PLoS One, 2014, 9(2): e88890. DOI: 10.1371/journal.pone.0088890. |
| [5] | Gopinathan G, Kolokythas A, Luan X, et al. Epigenetic marks define the lineage and differentiation potential of two distinct neural crest-derived intermediate odontogenic progenitor populations[J]. Stem Cells Dev, 2013, 22(12): 1763-1778. DOI: 10.1089/scd.2012.0711. |
| [6] | Huang GT, Shagramanova K, Chan SW. Formation of odontoblast-like cells from cultured human dental pulp cells on dentin in vitro[J]. J Endod, 2006, 32(11): 1066-1073. DOI: 10.1016/j.joen.2006.05.009. |
| [7] | Paino F, La Noce M, Tirino V, et al. Histone deacetylase inhibition with valproic acid downregulates osteocalcin gene expression in human dental pulp stem cells and osteoblasts: evidence for HDAC2 involvement[J]. Stem Cells, 2014, 32(1): 279-289. DOI: 10.1002/stem.v32.1. |
| [8] | Wang T, Liu H, Ning Y, et al. The histone acetyltransferase p300 regulates the expression of pluripotency factors and odontogenic differentiation of human dental pulp cells[J]. PLoS One, 2014, 9(7): e102117. DOI: 10.1371/journal.pone.0102117. |
| [9] | Guo S, Lim D, Dong Z, et al. Dentin sialophosphoprotein: a regulatory protein for dental pulp stem cell identity and fate[J]. Stem Cells Dev, 2014, 23(23): 2883-2894. DOI: 10.1089/scd.2014.0066. |
 2017, Vol. 38
2017, Vol. 38

