对于肿瘤的治疗,除手术外,临床上的传统方案主要是化疗或放疗,然而此种方案的副作用大,增加患者的死亡风险。近年来,免疫疗法作为一种全新的治疗手段逐渐被应用于临床。其中,嵌合抗原受体T细胞免疫疗法(chimeric antigen receptor T-cell immunotherapy, CART)以其独特的抗肿瘤优势[1],已成为全球生物医学领域研究的热点。CART技术是指将能识别某种肿瘤抗原的抗体单链可变区(Single chain antibody fragment, Scfv)与胞内信号区在体外偶联为一个嵌合蛋白,通过基因转导的方法转染体外培养的患者T细胞,使其表达嵌合抗原受体(CAR)[2]。患者的T细胞被“重编程”后,生成大量具有杀伤性的CART细胞,然后静脉回输入患者体内,能够特异性的识别并靶向肿瘤细胞[3]。CART与传统的免疫疗法相比,具有治疗更精确、靶向更精准、杀瘤更广泛、效果更持久等显著优势。
目前,CART免疫疗法在血液系统肿瘤中的治疗效果尤为突出[4, 5],其中以CD19-CART的临床应用最为广泛,已成为国内外大多数临床研究机构针对B淋巴细胞血液肿瘤的模式疗法[6, 7]。此外,CD22-CART作为CD19肿瘤靶点丢失时的补救疗法,逐渐开展临床研究[8, 9]。因此,有研究者提出序贯回输CD19和CD22多靶点CART细胞,将成为治疗难治复发性B淋巴细胞白血病的有效措施。大量临床报道显示,CART细胞在体内持续增殖是保证治疗效果的关键因素[10],如何快速、准确检测出CART细胞的增殖情况至关重要。对于单靶点CART疗法,国内外主要通过流式细胞仪技术进行检测,然而,对于双靶点甚至多靶点CART疗法,流式技术无法准确区分而受到限制。本研究采用TaqMan实时荧光定量技术,通过设计特异探针能够准确检测不同靶点的慢病毒拷贝数,进而确定CART在体内的增殖情况,为制定下一步临床治疗方案提供可靠依据。
1 材料与方法 1.1 材料 1.1.1 实验材料本研究所用细胞株293T保存于武汉科技大学生物医学研究院中心实验室;Raji细胞由华中科技大学同济医学院附属同济医院血液科惠赠;pTK881慢病毒质粒系统由美国北卡大学惠赠;本研究中的CART细胞治疗患者均来自华中科技大学同济医学院附属同济医院,T细胞从其血液中分离得到。该研究已获得华中科技大学附属同济医院伦理委员会批准,患者均已签署知情同意书。
1.1.2 相关试剂DMEM培养基、T细胞培养基OpTmizerTM CTSTM T-Cell Expansion SFM和胎牛血清购自Gibco公司;病毒浓缩液Lentivirus Concentration Solution(6×)购自GeneCopoeia公司;Lipfectamine 3000转染试剂购自Invitrogen公司;IL-6细胞因子ELISA检测试剂盒购自Biolegend公司;血液全基因组DNA提取试剂盒购自QIAGEN公司;TaqMan实时荧光定量PCR试剂盒Probe qPCR Mix购自大连宝生物工程有限公司。全波长分光光度计为Molecular Devices公司产品,实时定量PCR仪CFX 96为Bio-Rad公司产品。
1.2 方法 1.2.1 细胞培养与转染细胞培养:293T细胞用含10%胎牛血清的DMEM培养基培养;T细胞和Raji细胞用含105 U/L的人重组IL-2的OpTmizerTM CTSTM T-Cell Expansion SFM培养基培养。
重组质粒转染293T细胞:将293T细胞铺于10 cm皿中,待细胞长到对数生长期时,将构建好的pTK881-CD19scfv/pTK881-CD22scfv质粒12 μg与包膜蛋白VSVG 4 μg、结构蛋白NRF 8 μg混匀,加入24 μl的Lipfectamine 3000转染试剂,室温孵育25 min,缓慢的滴加入293T细胞,在37 ℃含5% CO2的培养箱中培养6-7 h换成完全培养基,继续培养72 h后从上清中收取病毒。
病毒感染293T或原代T细胞:将处于对数生长期的细胞接种于6孔板中,分成转染组和阴性对照组,按照感染复数(multiple of infection, MOI)=10进行感染,48 h后,收集细胞进行后续检测。
1.2.2 病毒浓缩将转染慢病毒质粒的293T细胞上清经0.45 μm微孔滤膜过滤收集病毒,将慢病毒与浓缩试剂按照5:1的比例混合,4 ℃孵育过夜。完成孵育后,将混合液在4 ℃温度下3 500 g离心25 min,小心弃去上清液。根据收集的慢病毒上清液体积,量取其1/100体积的PBS,轻轻吹打悬起慢病毒沉淀。将浓缩的病毒分装后保存在-80 ℃,并同时取少量测定病毒滴度确保病毒包装成功。
1.2.3 TaqMan探针与引物设计以前期研究中确定有效的CD19和CD22的scfv序列为靶标,用ABI Primer Express 2.0软件设计TaqMan探针和引物(见表 1),然后将设计好的序列在NCBI上进行Blast比对,以确保探针和引物的特异性。探针5′端荧光标记为FAM,3′端荧光标记为MGB,探针和引物送于武汉擎科生物技术有限公司合成。
| 表 1 antiCD19-CART和antiCD22-CART的检测探针及引物序列 |
将转染CD19和CD22慢病毒的CART细胞与Raji细胞分别按照1:1、10:1和20:1的比例混合,培养于48孔板中,单独培养CART细胞和Raji细胞设为阴性对照组,每孔中加入终浓度为5 μmol/L的活细胞荧光染料CMTMR,每组均设定3个复孔。细胞培养24 h后,通过流式检测活细胞数,计算杀瘤效率。此外,取细胞培养上清,根据ELISA试剂盒操作说明,检测每组的细胞因子IL-6的表达水平,通过制作标准曲线,计算IL-6的释放量。
1.2.5 TaqMan实时定量技术检测病毒拷贝数将构建好的包含CD19或CD22 scfv片段的重组质粒,在大肠杆菌DH5α中扩大培养,提取质粒,用作建立荧光定量方法的标准品。将标准品浓度调整为1.0×108 copies/ml,按每管20 μl分装后冻存于-80 ℃备用。本研究所用的模板为10倍系列稀释的标准品,浓度从1.0×107 copies/ml至1.0×102 copies/ml。TaqMan荧光定量PCR的反应体系为20 μl,内含Probe qPCR Mix 10 μl,TaqMan Probe (10 μmol/L)2 μl,上下游引物(10 μmol/L)各1 μl,模板1 μl,PCR级水5 μl。循环条件为94 ℃ 5 min;94 ℃ 15 s和60 ℃ 30 s共40个循环。检测回输CART细胞后的临床血液样本中病毒拷贝数时,使用回输前的样本作为阴性对照组,浓度为1.0×108 copies/ml的标准品作为阳性对照组。
1.2.6 统计分析本研究中的所有实验均至少做3个重复。以SPSS 20.0软件对数据进行统计学处理;数据资料以x±s表示,组间比较均采用t检验,P<0.05为差异有统计学意义。
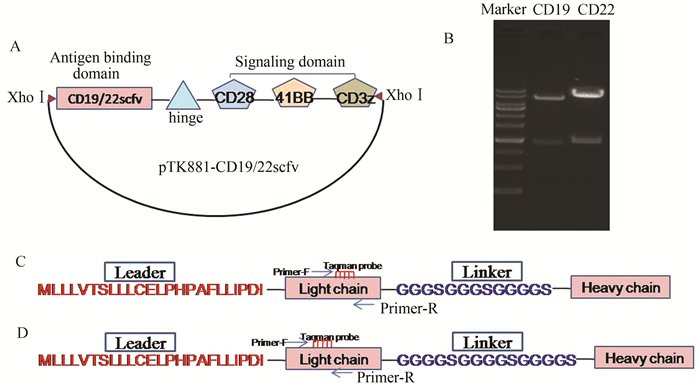
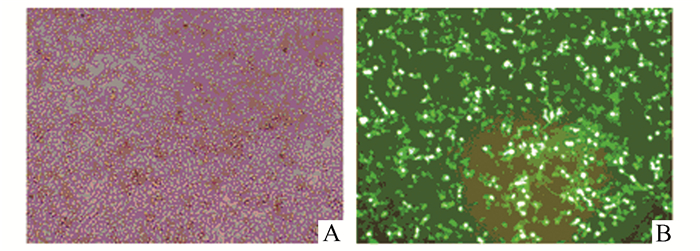
2 结果 2.1 成功构建CD19和CD22 scfv-CAR慢病毒载体本研究选用的第三代CAR包含共刺激分子CD28、41BB和CD3z链(图 1A),能更大程度的激活T细胞[11]。B淋巴细胞白血病相关抗原的抗体scfv区(CD19和CD22)由引导序列(Leader)、抗体轻链(Light chain)、连接序列(Linker)和抗体重链(Heavy chain)组成(图 1C和D),能够特异性的靶向肿瘤细胞。本研究将完整的CAR结构连接至慢病毒载体pTK881上,酶切位点为Xba Ⅰ和Xho Ⅰ,重组载体的双酶切鉴定见图 1B,CD19和CD22的目标序列大小分别为1 554 bp和1 611 bp。此外,为了更直观地检测载体的转染效率,本实验同时将目标片段连接至含EGFP蛋白的pTK642载体上,从图 2可以看出,载体转染效率约80%。重组载体经测序验证正确后,-80 ℃保存备用。
|
图 1 CD19和CD22抗体单链可变区慢病毒载体构建 A:载体构建示意图;B:重组载体酶切验证;C和D分别是CD19和CD22抗体scfv序列结构 |
|
图 2 慢病毒包装检测(×100) A:自然光下的293T细胞;B:蓝光激发下的293T细胞 |
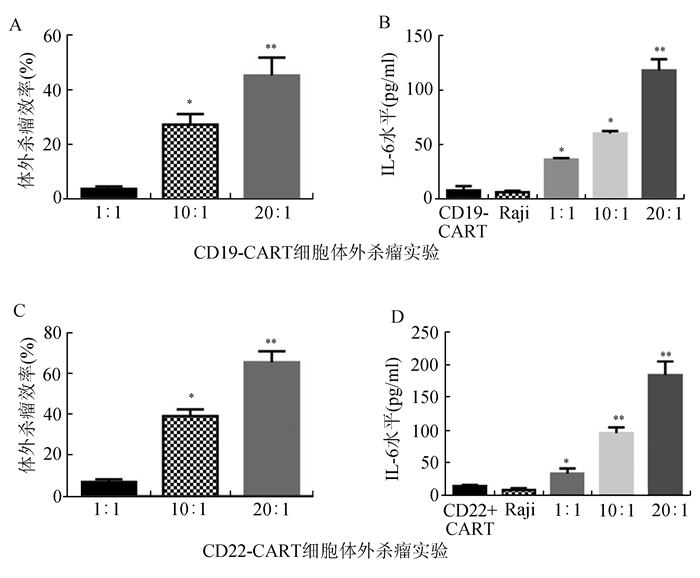
为保证临床治疗效果,本研究在回输前对CART细胞的杀瘤效率进行体外验证。结果如图 3所示,CART细胞与Raji细胞20:1共培养组的杀瘤效率极显著高于1:1培养组(图 3A, 3C,P<0.01),10:1共培养组的杀瘤效率显著高于1:1培养组(图 3A, 3C,P<0.05)。CART细胞与Raji细胞共培养组(1:1, 10:1, 20:1)的IL-6水平显著或极显著高于CART细胞或Raji细胞单独培养组(图 3B, 3D, P<0.05或P<0.01)。由此可见,携带CAR的重编程T细胞在体外具有杀伤瘤细胞、刺激其释放细胞因子的作用。
|
图 3 体外检测CART细胞的杀瘤效率 A:CD19-CART细胞的杀瘤效率;B:CD19-CART组IL-6的释放水平;C:CD22-CART细胞的杀瘤效率;D:CD22-CART组IL-6的释放水平, *P<0.05, **P<0.01 |
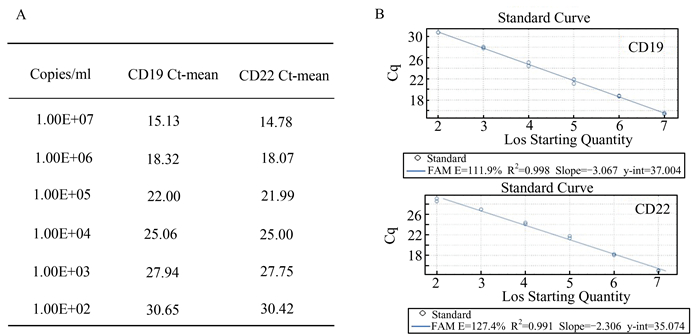
标准曲线的灵敏度检测是TaqMan实时定量PCR技术的关键环节。本研究对系列稀释的标准品(1.0×101-1.0×108 copies/ml)进行测试,结果如图 4所示,CD19和CD22的检测下限均为1.0×102,检测上限设定为1.0×107(可以满足临床样本不同回输时期的检测需求)。相邻浓度梯度之间的Ct值相差3左右,标准曲线斜率在-3.3--3.4之间。
|
图 4 定量PCR标准曲线的灵敏度检测 A:标准品对应的Ct值;B:CD19和CD22的标准曲线 |
为了体外评估TaqMan检测技术,本研究对293T细胞进行不同的转染处理,分为空白对照组、空病毒对照组、空质粒对照组、CD19/CD22慢病毒组和CD19/CD22质粒组,然后检测CD19-CAR和CD22-CAR的病毒拷贝数。结果如图 5所示,转染病毒和质粒组的慢病毒拷贝数均显著高于对照组(P<0.05),其中感染病毒组的拷贝数稍高于质粒组,说明CD19和CD22 CAR均成功嵌合,且TaqMan实时定量技术能够精确地检测慢病毒拷贝数。
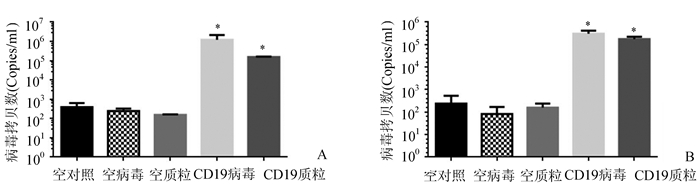
|
图 5 293T细胞中慢病毒拷贝数检测 A:CD19的质粒和慢病毒转染293T细胞的拷贝数检测;B:CD22的质粒和慢病毒转染293T细胞的拷贝数检测 |
本研究入组4名急性B淋巴细胞白血病患者,所有患者接受CD19-CART和CD22-CART序贯治疗。以回输体外培养的CART细胞当天为第0天计算,回输20 min后采集2 ml血液,随后在回输后的第10,15,30,35天分别采集血液样本,提取血浆基因组DNA,检测慢病毒拷贝数,以此反映CART细胞在病人体内的增殖情况,通过持续检测该指标分析CART在体内的存续时间。检测结果如图 6所示,4名患者分别在第0天回输CD19-CART和CD22-CART细胞20 min后,体内病毒拷贝数迅速上升至102-104,且均在第10天急剧上升至104-107,与第0天相比呈现显著升高(P<0.05)。Donor1和Donor2两名患者的CD19-CART在第15,30,35天变化平稳,Donor3和Donor4在第30,35天有所下降,但均显著高于初始回输水平(P<0.05)。Donor1、Donor2和Donor4的CD22-CART病毒拷贝数在第30天达到最高,Donor3在第30,35天有所下降,但均高于初始回输水平。由此可见,通过检测病毒拷贝数有助于临床医生准确掌握携带不同靶点的CART细胞在体内的变化,为制定进一步治疗方案提供科学依据。
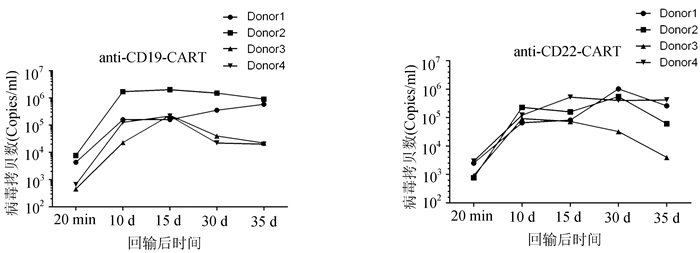
|
图 6 患者回输CART细胞后体内病毒拷贝数监测 |
早期的CART细胞是通过质粒电转获得的,由于转染效率低,体外培养周期长,回输入患者体内后迅速衰减,临床效果极差[10]。随后研究者们利用慢病毒质粒挂载CAR结构,实现T细胞修饰,体外培养周期缩短,CART细胞表现更“年轻”,具有较强的持续扩增潜能[13]。
经修饰的CART细胞回输入患者体内后,与靶细胞相互作用会刺激释放细胞因子(如IL-6),一定水平的细胞因子释放可以反映CART免疫细胞的治疗效果[14]。然而,过度的细胞因子释放会造成严重的不良反应。本研究通过在体外检测CART细胞与Raji瘤细胞共培养时的杀瘤效率和细胞因子IL-6水平,综合反映CART细胞的杀瘤功效。
CART研究初期,科学家们认为CART细胞的输注量与治疗效果直接相关。然而,June等人报道了一例在输注较低量的CART-CD19后,CART细胞在体内扩增了1 000倍,白血病得到很好的控制[15]。由此说明,CART细胞在体内是否有效扩增对于癌细胞的杀伤至关重要,因此,对CART扩增水平的跟踪监测就显得尤为重要。对于单靶点CART疗法,研究者们主要通过流式细胞仪技术,采用通用抗体检测CART在体内的变化[16]。然而,对于多靶点的CART序贯疗法,由于缺乏特异性抗体,流式细胞检测技术受到限制,无法在病人体内区分多种CART细胞。因此,本研究采用TaqMan技术,通过设计特异探针,靶向每种CAR结构中的scfv片段,跟踪监测回输CART后不同时间段慢病毒拷贝数变化。该技术具有快速、准确、成本低等显著优势,能够在CART序贯疗法中准确判断特定CART细胞的增殖情况,为下一步临床干预提供重要依据。
总之,抗肿瘤是一场漫长而艰难的“微观战斗”。CART免疫疗法的临床效果评估需长期的随访和复查。本研究监测了回输CART后患者体内的病毒拷贝数,结果显示,回输后第35天时患者病情仍处于缓解状态。这些结果表明,动态观察CART细胞在体内的变化情况,有助于临床治疗的判断和干预。然而,采用慢病毒挂载CAR结构的安全问题还有待探讨,一些新的技术思路逐渐发展起来并有望应用于临床,如通过电转mRNA制备短期效应的CART、引入自杀基因提高CART在体内的可控性、诱导激活CART等。随着技术的不断优化和改进,CART在实体肿瘤治疗中的也将“崭露头角”,成为肿瘤治疗事业的一个里程碑。
| [1] | Chicaybam L, Sodre AL, Bonamino M. Chimeric antigen receptors in cancer immuno-gene therapy: current status and future directions[J]. Int Rev Immunol, 2011, 30(5-6): 294-311. DOI: 10.3109/08830185.2011.595855. |
| [2] | Ramos CA, Dotti G. Chimeric antigen receptor (CAR)-engineered lymphocytes for cancer therapy[J]. Expert Opin Biol Ther, 2011, 11(7): 855-873. DOI: 10.1517/14712598.2011.573476. |
| [3] | Figueroa JA, Reidy A, Mirandola L, et al. Chimeric antigen receptor engineering: a right step in the evolution of adoptive cellular immunotherapy[J]. Int Rev Immunol, 2015, 34(2): 154-187. DOI: 10.3109/08830185.2015.1018419. |
| [4] | Kochenderfer JN, Wilson WH, Janik JE, et al. Eradication of B-lineage cells and regression of lymphoma in a patient treated with autologous T cells genetically engineered to recognize CD19[J]. Blood, 2010, 116(20): 4 099-4 102. DOI: 10.1182/blood-2010-04-281931. |
| [5] |
韩为东, 魏建树, 罗灿. CART细胞在血液系统恶性肿瘤疾病中的临床转化研究[J].
临床血液学杂志, 2016, 29(4): 547-552.
Han WD, Wei JS, Luo C. Clinical translational research of chimeric antigen receptor modified T cells in hematological malignancies[J]. J Clin Hematol(China), 2016, 29(4): 547-552. |
| [6] | Zhang Y, Zhang W, Dai H, et al. An analytical biomarker for treatment of patients with recurrent B-ALL after remission induced by infusion of anti-CD19 chimeric antigen receptor T (CAR-T) cells[J]. Sci China Life Sci, 2016, 59(4): 379-385. DOI: 10.1007/s11427-016-5035-4. |
| [7] | Zhu Y, Tan Y, Ou R, et al. Anti-CD19 chimeric antigen receptor-modified T cells for B-cell malignancies: a systematic review of efficacy and safety in clinical trials[J]. Eur J Haematol, 2016, 96(4): 389-396. DOI: 10.1111/ejh.2016.96.issue-4. |
| [8] | Jahn L, Hagedoorn RS, van der Steen DM, et al. A CD22-reactive TCR from the T-cell allorepertoire for the treatment of acute lymphoblastic leukemia by TCR gene transfer[J]. Oncotarget, 2016, 7(44): 715 36-71 547. |
| [9] | James SE, Greenberg PD, Jensen MC, et al. Antigen sensitivity of CD22-specific chimeric TCR is modulated by target epitope distance from the cell membrane[J]. J Immunol, 2008, 180(10): 7 028-7 038. DOI: 10.4049/jimmunol.180.10.7028. |
| [10] | Jensen MC, Popplewell L, Cooper LJ, et al. Antitransgene rejection responses contribute to attenuated persistence of adoptively transferred CD20/CD19-specific chimeric antigen receptor redirected T cells in humans[J]. Biol Blood Marrow Transplant, 2010, 16(9): 1 245-1 256. DOI: 10.1016/j.bbmt.2010.03.014. |
| [11] | Gargett T, Brown MP. Different cytokine and stimulation conditions influence the expansion and immune phenotype of third-generation chimeric antigen receptor T cells specific for tumor antigen GD2[J]. Cytotherapy, 2015, 17(4): 487-495. DOI: 10.1016/j.jcyt.2014.12.002. |
| [12] | Puig M, Mihalik K, Yu MY, et al. Sensitivity and reproducibility of HCV quantitation in chimpanzee sera using TaqMan real-time PCR assay[J]. J Virol Methods, 2002, 105(2): 253-263. DOI: 10.1016/S0166-0934(02)00119-2. |
| [13] | Maude SL, Frey N, Shaw PA, et al. Chimeric antigen receptor T cells for sustained remissions in leukemia[J]. N Engl J Med, 2014, 371(16): 1 507-1 517. DOI: 10.1056/NEJMoa1407222. |
| [14] | Ataca P, Arslan O. Chimeric Antigen Receptor T Cell Therapy in Hematology[J]. Turk J Haematol, 2015, 32(4): 285-294. DOI: 10.4274/tjh. |
| [15] | Porter DL, Levine BL, Kalos M, et al. Chimeric antigen receptor-modified T cells in chronic lymphoid leukemia[J]. N Engl J Med, 2011, 365(8): 725-733. DOI: 10.1056/NEJMoa1103849. |
| [16] | Brentjens RJ, Riviere I, Park JH, et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias[J]. Blood, 2011, 118(18): 4 817-4 828. DOI: 10.1182/blood-2011-04-348540. |
 2018, Vol. 39
2018, Vol. 39


