2. 武汉大学人民医院 麻醉科 湖北 武汉 430060
2. Dept. of Anesthesiology, Renmin Hospital of Wuhan University, Wuhan 430060, China
腹腔镜手术因能够减少患者痛苦、缩短住院时间、手术切口小等优点逐渐取代传统开放手术。随着腹腔镜技术的日臻成熟,许多肾脏疾病的治疗逐渐进入微创时代,然而越来越多的研究及临床观察发现,建立手术操作空间所必须的二氧化碳气腹会对肾脏乃至全身各个系统产生一定的影响[1]。但是目前几乎所有的相关研究都是基于正常的肾脏进行,而许多需要进行手术治疗的患者,其肾脏往往合并有不同程度的积水,气腹对于这些肾脏的影响却少有报道。因此,研究二氧化碳气腹对不同程度积水肾的损伤情况可以进一步丰富人们对腹腔镜技术的认识,利于手术创伤的最小化。
本研究在成功建立积水肾动物模型的实验基础上,进一步建立不同压力二氧化碳气腹压对不同程度积水肾的损伤模型,并借助形态学及生物化学等实验研究手段来探讨气腹压对积水肾的损伤作用。所获研究成果可以为肾脏腹腔镜手术中的二氧化碳气腹压力掌控提供科学依据。
1 材料与方法 1.1 材料无特定病原体(SPF)级新西兰大白兔,雌雄不拘,体重约2 kg,购于武汉大学动物研究中心,饲养温度19-21℃,保持通风,正常标准饮食。全自动酶标仪Multiskan MK3(Thermo scientific公司);多功能电热锅CRJ-130D-1(广州PHEPELI公司);丙二醛(MDA)测试试剂盒A003-1,乳酸测试试剂盒A019-2,活性氧(ROS)测试试剂盒E004(南京建成生物工程研究所);TUNEL检测试剂盒(瑞士罗氏公司);正置显微镜(Nikon 80i).
1.2 动物模型的制作及分组 1.2.1 实验分组SPF级新西兰大白兔54只随机均分为3组造模,分别为假手术组(N组),轻度积水组(M组),重度积水组(S组),每组再分为3个亚组,每组6只,分别对应气腹压力0,10,15 mmHg,气腹作用时间为1 h, 编号依次为N0,N1,N2,M0,M1,M2,S0,S1,S2。
1.2.2 肾积水模型建立取1%戊巴比妥钠(45 mg/kg)沿耳缘静脉注射麻醉大白兔,仰卧位固定。备皮,取左侧腹直肌外侧缘切口,逐层切开至腹腔,显露左侧输尿管上段,将输尿管自肾下极水平至髂血管一段游离出。将一段长约2 cm聚乙烯导管(周长7 mm)纵向剖开,套扎于输尿管距离肾脏下极2-4 cm处。关闭腹腔,给予80 U/kg青霉素耳缘静脉注射以预防感染。操作过程中应尽量避免挤压或牵扯肾脏,以免造成人为损伤。正常组仅行腹部切口,不行输尿管套扎,轻度积水组术后3 d,重度积水组术后7 d行B超检查。套扎以上输尿管,肾盂积水扩张者为造模成功。
1.2.3 气腹压损伤模型建立积水肾造模成功后,相同方法再次手术开腹,松开聚乙烯导管,解除输尿管梗阻。于脐旁插入气腹针,连接气腹机,闭合腹部伤口,建立气腹,各组接受对应气腹压处理(正常组仅连接气腹针,不行气体灌注),持续时间1 h。
1.3 标本留取气腹作用2 d后,沿耳缘静脉取静脉血10 ml行血清肌酐(Cr)及尿素氮(BUN)检测,然后处死动物,取实验侧肾脏,用冷生理盐水充分冲洗,一部分立即行4%多聚甲醛固定,另一部分-80 ℃冻存,用于检测ROS, MDA, 乳酸(LD)。
1.4 ROS,MDA, LD检测准确称取组织重量,按重量(g):体积(ml)加入9倍体积生理盐水匀浆,2 500 r/min离心10 min,取上清作为待测样品, 行BCA蛋白定量。采用化学荧光法测定ROS含量,硫代巴比妥酸法(TBA法)测定MDA含量,比色法测肾组织LD含量。
1.5 HE染色取兔肾组织,4%多聚甲醛溶液固定后取部分组织石蜡包埋,切片,苏木素-伊红(HE)染色,正置显微镜下200倍视野观察肾组织病理学改变。
1.6 TUNEL检测细胞凋亡及坏死取石蜡包埋组织,切片,按TUNEL试剂盒步骤行肾小管细胞凋亡及坏死检测,正置显微镜下200倍视野观察染色情况。通过比较不同组的阳性细胞比例来判断肾脏细胞凋亡及坏死的情况。
1.7 肾功能检测处死动物前沿耳缘静脉取静脉血10 ml,查血清肌酐及尿素氮含量。
1.8 统计学方法所有数据以均数±标准差表示,并应用SPSS 15.0统计软件分析。通过方差分析比较数据之间的差异,以P<0.05为差异有统计学意义。
2 结果 2.1 ROS, MDA, LD含量对于假手术组和轻度积水组,气腹压在0 mmHg和10 mmHg时,ROS, MDA, LD的含量差异不明显,无统计学意义(P>0.05);当气腹压为15 mmHg时,ROS, MDA, LD的含量明显上升,差异有统计学意义(P<0.05);而对于重度积水组,气腹压在10 mmHg和15 mmHg下,ROS, MDA, LD的含量较S0组均发生了明显的上升,差异有统计学意义(P<0.05)(图 1)。
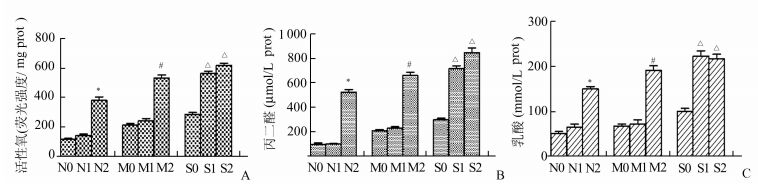
|
图 1 正常、轻度积水、重度积水的肾脏在不同大小气腹压力下活性氧、丙二醛、乳酸的含量 A-C:分别为活性氧、丙二醛、乳酸的数据图。条带高度代表数据的均数±标准差,* vs N0, P<0.05;# vs M0, P<0.05;△ vs S0, P<0.05 |
光镜下除N0,N1组外,其他各组均可见不同程度的肾小球肾小管细胞水肿,肾小管扩张,蛋白管型及炎性细胞浸润。每高倍镜视野随机选择8个肾小管,采用Paller法评分,正常肾小管为0分,肾小管明显扩张为1分;可见细胞扁平或肿胀为1分;刷状缘损伤为1分,脱落为2分;管型2分,肾小管管腔内有脱落或坏死的细胞为1分。分别对各组肾脏损伤情况进行评分,结果显示:N0组(1.0±0.3) 分;N1组(1.3±0.5) 分;N2组(15.0±2.8) 分;M0组(11.0±2.5) 分;M1组(13.0±3.8) 分;M2组(33.0±4.3) 分;S0组(20.0±2.2) 分;S1组(39.0±4.8) 分;S2组(45.0±5.4) 分。N2组与N0组比较差异有统计学意义(P<0.05),N1与N0比较差异无统计学意义(P>0.05);M2组与M0组比较差异有统计学意义(P<0.05),M1与M0比较差异无统计学意义(P>0.05);S1和S2分别与S0比较,差异均有统计学意义(P<0.05)(图 2)。
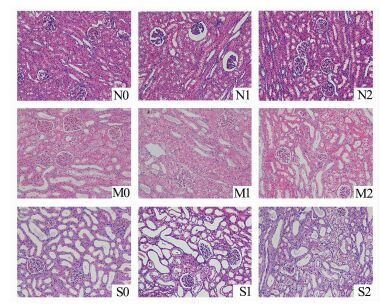
|
图 2 不同程度积水肾脏在不同气腹压力作用下HE染色图片(×200) |
凋亡的细胞核内有特异的3-OH末端,在TUNEL试剂盒作用下,可使凋亡细胞核呈棕黄色,细胞核形态不规则,大小不一致,而正常细胞核被苏木素复染成蓝色。正置显微镜下仔细观察每组切片TUNEL染色结果并计算出凋亡指数(每张TUNEL切片选取5个阳性细胞数最多的高倍视野(×400),计算出阳性细胞所占百分比)。本实验中,假手术组和轻度积水组,气腹压为15 mmHg时,凋亡指数明显增加(P<0.05)。在重度积水组,气腹压达到10 mmHg时,凋亡指数即有明显增加(P<0.05)(图 3)。
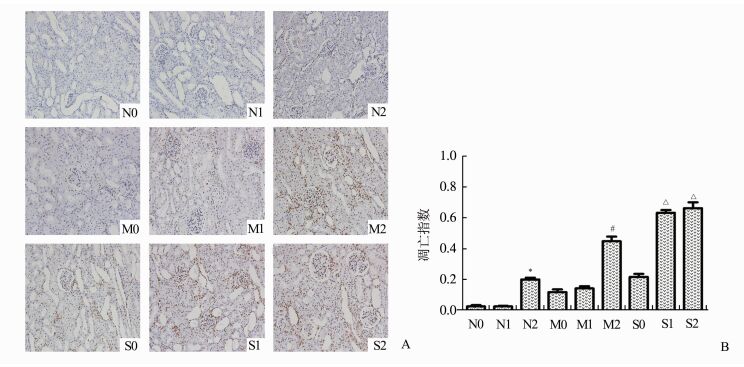
|
图 3 肾小管细胞凋亡评价 A:各组肾脏TUNEL染色图片(×200);B:各组对应凋亡指数。条带代表凋亡指数±标准差,* vs N0, P<0.05;# vs M0, P<0.05;△ vs S0, P<0.05 |
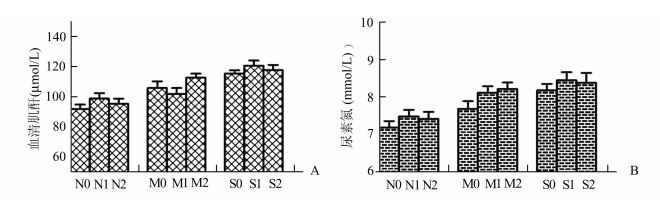
|
图 4 不同程度积水肾在不同气腹压作用下血肌酐及尿素氮水平 A:血肌酐水平; B:血尿素氮水平 |
同一气腹压下,随积水程度增加,血肌酐和尿素氮有升高趋势,但差异无统计学意义(P>0.05)。同一积水程度下行不同气腹压,肌酐及尿素氮的水平差异亦无统计学意义(P>0.05)。
3 讨论目前有许多研究表明,在腹腔镜手术过程中过高的气腹压(大于12 mmHg)以及长时间的气腹压会作用于腹腔及胸腔脏器,从而对呼吸、消化、泌尿、循环乃至中枢系统产生不良影响。因而在保证手术操作不受影响的情况下,应尽可能使用低的气腹压,并缩短手术时间[2, 3]。肾脏作为非常重要的实质器官,气腹对它的作用自然不可忽视[4],研究发现气腹对肾脏的影响主要是会引起肾脏血流的变化[5],Wiesenthal等的研究发现,当气腹压由0升高到15 mmHg时,肾脏血流量会减少66.7%,造成肾脏的缺血,当气腹压解除时,肾脏血流灌注恢复,从而造成缺血-再灌注损伤[5]。但是这些研究大多都是基于功能正常的肾脏。然而临床上有许多需要行肾脏腹腔镜手术的病人往往合并有不同程度的肾积水,对于这种功能已经受损的肾脏再行二氧化碳气腹的报道却少之又少[6]。积水肾脏的皮质变薄,可能合并有感染,其血流灌注已经较差,如果再给予一定的气腹压力,缺血及再灌注可能会使损伤进一步加重。因而我们研究气腹压力对积水肾脏的影响就变的很有意义。
肾组织缺血缺氧会对肾小球血管内皮细胞的生成和修复产生影响,造成内皮细胞的肿胀,内皮细胞内空泡形成和溶解[7, 8]。缺氧也会导致组织活性氧(ROS)表达升高并激活足细胞还原型尼克酰胺腺嘌呤二核苷酸磷酸氢化酶产生更多的ROS,最终再通过一系列的途径诱导细胞发生凋亡[9, 10]。丙二醛(MDA)是膜脂过氧化的主要产物之一,其含量大小反映了膜脂受活性氧伤害的程度。当肾脏缺氧时,葡萄糖发生无氧氧化,乳酸脱氢酶表达量增加,催化丙酮酸生成乳酸,使得乳酸含量上升。
通过上述实验结果我们可以发现对于正常及轻度积水的肾脏,在0 mmHg及10 mmHg气腹压力作用下,各个检测指标并无明显差别,但当压力达到15 mmHg时,LD含量明显升高,说明在此压力下组织缺氧及细胞无氧呼吸程度增加;ROS, MDA明显升高说明组织氧化损伤程度明显加重;HE染色示肾小管细胞水肿程度,肾小管扩张程度,蛋白管型及炎性细胞浸润程度均有不同程度的增加;TUNEL法检测细胞凋亡示凋亡细胞比例也有明显增加;说明正常及轻度积水的肾脏在气腹压力达15 mmHg肾损伤明显加重。而对于重度积水的肾脏,当气腹压力到达10 mmHg时,以上指标就已经发生明显改变,即重度积水的肾脏在气腹压力为10 mmHg时肾损伤就已经明显增加。另外,我们可以看到不同组的血清Cr及BUN值并无类似的趋势,这可能是因为肾脏具有强大的代偿功能,一个肾脏的积水不足以导致整个机体肾功能的改变。所以我们得出结论:气腹压可以对积水肾脏造成损伤,而且积水越严重的肾脏,越容易受到气腹压的影响,也就是说积水越严重的肾脏对气腹压的耐受能力也越差。对积水肾脏行腹腔镜手术时应当适当减小气腹的压力大小[11]。
| [1] | Cekic B, Geze S, Ozkan G, et al. The Effect of Dexmedetomidine on oxidative stress during pneumoperitoneum[J]. Biomed Res Int, 2014, 2014: 1-5. |
| [2] | Wever KE, Bruintjes MHD, Warlé MC, et al. Renal perfusion and function during pneumoperitoneum: A systematic review and meta-analysis of animal studies[J]. PloS One, 2016, 11(9): e163419. |
| [3] | Hassoun HT, Lie ML, Grigoryev DN, et al. Kidney ischemia-reperfusion injury induces caspase-dependent pulmonary apoptos[J]. Am J Physiol Renal Physiol, 2009, 297(1): F125-F137. DOI: 10.1152/ajprenal.90666.2008. |
| [4] | Sodha S, Nazarian S, Adshead JM, et al. Effect of pneumoperitoneum on renal function and physiology in patients undergoing robotic renal surgery[J]. Curr Urol, 2016, 9(1): 1-4. DOI: 10.1159/000442842. |
| [5] | Wiesenthal JD, Fazio LM, Perks AE, et al. Effect of pneumoperitoneum on renal tissue xxygenation and blood flow in a rat model[J]. Urology, 2011, 77(6): 1508-1509. |
| [6] | Li W, Cao Z, Xia Z, et al. Acute kidney injury induced by various pneumoperitoneum pressures in a rabbit model of mild and severehydronephrosis[J]. Urol Int, 2015, 94(2): 225-233. |
| [7] | Cekic B, Geze S, Ozkan G, et al. The effect of dexmedetomidine on oxidative stress during pneumoperitoneum[J]. Biomed Res Int, 2014, 2014: 1-5. |
| [8] | Khoury W, Schreiber L, Szold A, et al. Renal oxidative stress following CO2 pneumoperitoneum-like conditions[J]. Surg Endosc, 2009, 23(4): 776-782. DOI: 10.1007/s00464-008-0054-2. |
| [9] | Zalk R, Israelson A, Garty ES, et al. Oligomeric states of the voltage-dependent anion channel and cytochrome c release from mitochondria[J]. Biochem J, 2005, 386(Pt 1): 73-83. |
| [10] | Khoury W, Jakowlev K, Fein A, et al. Renal apoptosis following carbon dioxide pneumoperitoneum in a rat model[J]. J Urol, 2008, 180(4): 1554-1558. DOI: 10.1016/j.juro.2008.06.008. |
| [11] | zdemir-van Brunschot DM, van Laarhoven KC, Scheffer GJ, et al. What is the evidence for the use of low-pressure pneumoperitoneum? A systematic review[J]. Surg Endosc, 2016, 30(5): 2049-2065. DOI: 10.1007/s00464-015-4454-9. |
 2017, Vol. 38
2017, Vol. 38

 ,
,