2. 武汉大学中南医院骨科 湖北 武汉 430071
2. Dept. of Orthopaedics, Zhongnan Hospital of Wuhan University, Wuhan 430071, Hubei, China
神经细胞是不可再生细胞,神经损伤后对神经提供营养的血供同时损伤,以及局部生理环境的改变,胶质瘢痕的形成,使得神经修复非常困难。负压封闭引流技术(vacuum sealing drainage,VSD)应用医用多孔泡沫材料(vacuseal)包裹有多侧孔的引流管,将vacuseal置于开放性创面,用半透性薄膜密闭创面,将引流管通过引流瓶连接负压源,将负压传导到创面进行持续负压吸引。VSD能促进创面的血管化,显著减轻创周水肿,促进损伤组织中血管内皮细胞生长因子的生成等优点,而VSD对血管、肉芽组织修复的这种作用和机理有可能促进周围神经的修复。因此本实验设计兔坐骨神经损伤模型,应用VSD治疗坐骨神经损伤,拟初步探讨VSD对外周神经损伤修复有无促进作用。
1 材料与方法 1.1 材料新西兰大白兔(由湖北省武汉市万千佳兴生物科技公司提供)24只,体重2.5-3.0 kg,雌雄不限,实验前至少在恒温环境标准化饲养1周。戊巴比妥钠、青霉素均为国产药物。脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)单抗(圣克鲁斯生物技术公司,美国)。动物手术设施、器械均由武汉大学中南医院动物实验中心提供。
1.2 实验动物分组及手术过程将24只新西兰大白兔随机分成两组,每组12只。实验组用3%戊巴比妥钠溶液行耳缘静脉全身麻醉(30 mg/kg),麻醉成功后取俯卧位,四肢固定。手术前先用剪刀将手术区(后肢)兔毛剪去,尽量剪短而保持皮肤完整,兔毛留约2-3 mm长,再用8%Na2S溶液(按Na2S 8 g、蒸馏水100 ml比例配制)行手术区化学脱毛备皮。消毒、铺单。大腿后正中切口,长约3 cm,切开皮肤、皮下组织沿肌肉间隙进入,显露坐骨神经,截断1 cm后,一期用6-0无创伤缝线采用神经外膜缝合法原位吻合坐骨神经,再用局部肌肉覆盖神经,要保证肌肉厚度不超过0.5 cm,且将神经完整的覆盖。局部vacuseal修剪、覆盖,并将vacuseal用缝线固定在伤口,防止脱落。黏贴半透膜,VSD接负压吸引机持续吸引,半透膜封闭良好,无漏气。术后肌注青霉素(40万U/次)抗炎3 d,单只置自制笼内饲养,防止其将VSD脱出及撕咬。VSD每7-10d更换一次。对照组将神经吻合后,不用VSD覆盖,直接缝合伤口。两组大白兔饲养到术后第4周和第8周时分别用空气栓塞处死6只。
1.3 观察指标 1.3.1 大体观察观察实验组和对照组动物术后的精神状态、伤口情况、足部溃疡情况。取材时观察神经吻合段与周围组织有无粘连、有无神经瘤形成。
1.3.2 神经电生理检测采用上海海神NDI-200P+型神经电图仪,于手术后第4或8周,将两组各6只兔用3%戊巴比妥钠麻醉后,对手术侧的坐骨神经进行神经电生理检测。
1.3.3 组织学观察分别切取两组神经吻合段坐骨神经,经4%甲醛固定后,石蜡包埋,横形切片行1%甲苯胺蓝染色。光镜下观察神经再生情况。
1.3.4 免疫组化采用BDNF单抗对坐骨神经进行免疫组化检测。将标本石蜡切片脱蜡,PBS漂洗后,切片置于EDTA缓冲液中微波修复,自然冷却后PBS冲洗。切片放入3%过氧化氢溶液,室温下孵育10min,5% BSA封闭20 min。去除BSA液,每张切片加入50 μl稀释的一抗(1:250)及二抗,PBS冲洗后,DAB显色。苏木素复染,脱水干燥,二甲苯透明,中性树胶封片。由两名独立的实验者在光学显微镜下对切片进行观察评估。采用图像分析仪分析吸光度(A)值并计算染色强度。
1.3.5 小腿三头肌恢复率检测自小腿三头肌起止点两端完整切取健侧和患侧的肌肉,用滤纸吸取附着在肌肉上的血液后用电子天平分别称重,计算患侧小腿三头肌的重量相对于健侧的百分比,算出肌肉湿重恢复率。
1.4 统计学分析比较两组小腿三头肌患侧与健侧肌肉恢复率、神经电传导速度,应用SPSS 17.0统计软件分析,采用单因素方差分析处理各组实验指标间的差异。数据以均数±标准差表示。
2 结果 2.1 大体观察约1-2周时,手术侧足部均出现不同程度的红肿和溃疡。4周时实验组可见神经表面光滑,神经外膜见血管分布;对照组神经表面血管分布较少。8周时,实验组神经粗细与正常相仿,外表无明显差别,神经与周围肌肉及肉芽组织结合紧密;对照组较实验组神经较细,表面血管分布较4周时明显增多。
2.2 神经干电传导速度检测术后4, 8周两组动物神经传导速度均有所恢复,实验组恢复程度明显优于对照组(P<0.05),见图 1。
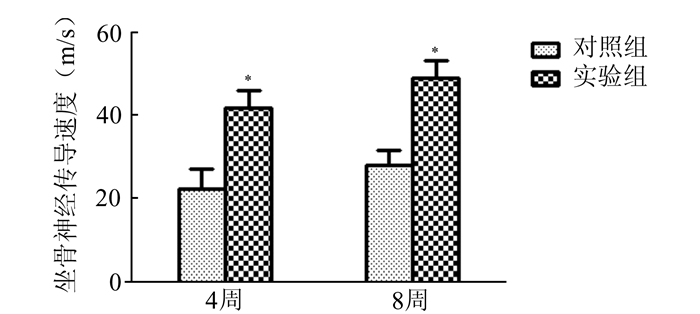
|
图 1 各组坐骨神经传导速度 与对照组比较,*P<0.05 |
术后4,8周两组动物体质量基本相近。第4、8周两组术侧小腿三头肌湿质量明显降低,但实验组恢复程度明显优于对照组(P<0.05),见图 2。
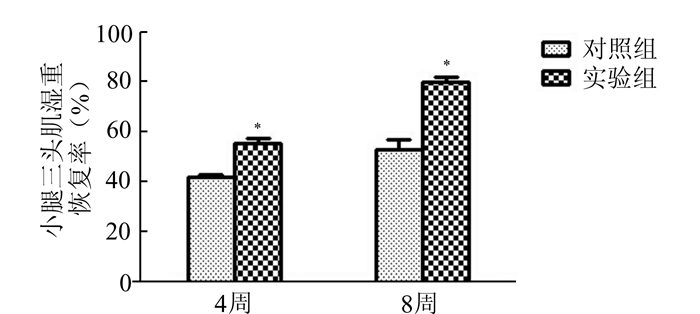
|
图 2 各组小腿三头肌湿重恢复率 与对照组比较,*P<0.05 |
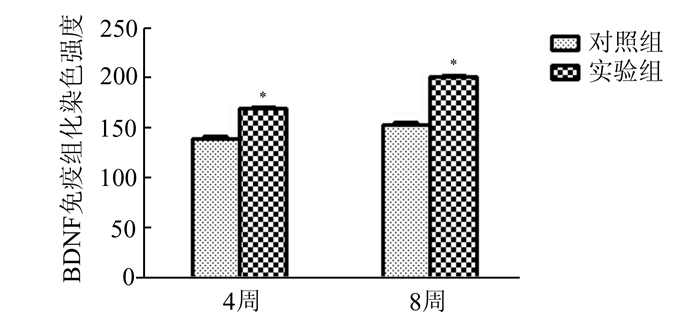
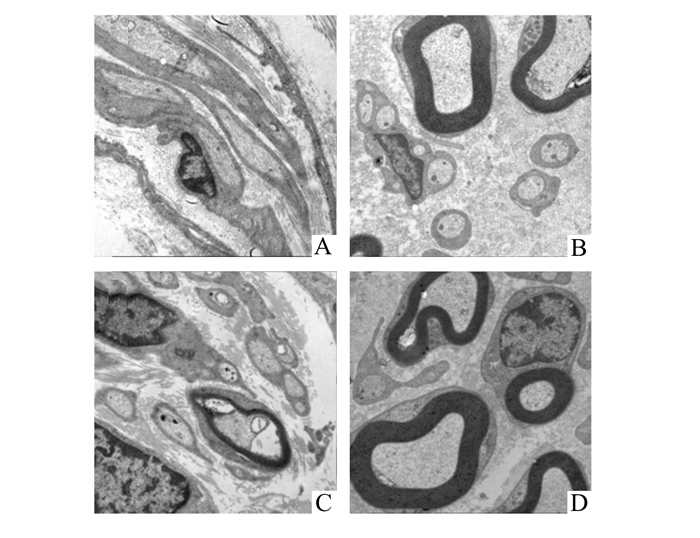
甲苯胺蓝染色观察见4周时实验组与对照组均可见神经纤维,但对照组神经纤维排列较实验组紊乱,且大小不一(图 3A-D)。经免疫组化染色可见,实验组和对照组BDNF均有不同程度的表达,但对照组4周和8周时表达的程度均较实验组低(图 4A-D),差异有统计学意义(图 5)。电镜观察可见,对照组微丝排列较紊乱,线粒体较大且肿胀、中空,有髓神经较少,且髓鞘较薄、片层结构排列较松散,有较多的无髓神经纤维(图 6A,C)。实验组微管排列较整齐,线粒体较对照组小、无明显肿胀、较实密,有髓神经纤维明显较对照组多,且髓鞘较厚、厚度基本一致、片层结构排列整齐(图 6B,D)。
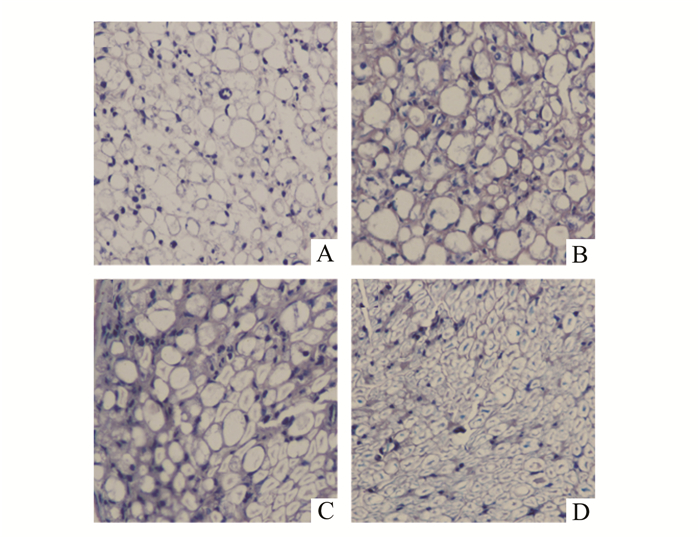
|
图 3 坐骨神经甲苯胺蓝染色照片(×400) A.对照组4周;B.实验组4周;C.对照组8周;D.实验组8周 |
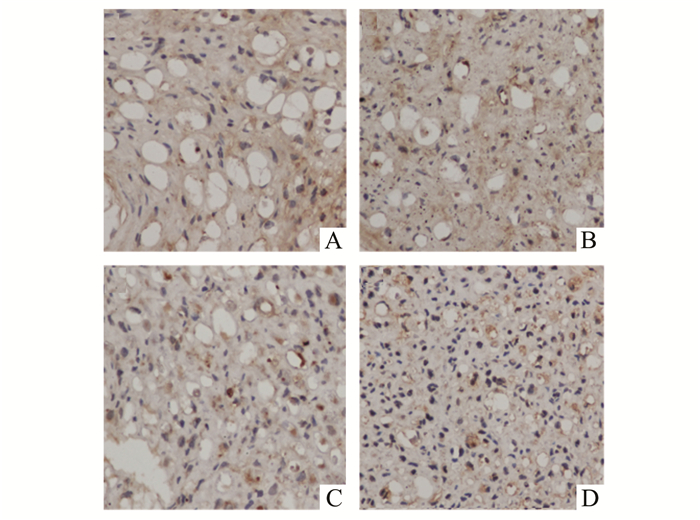
|
图 4 坐骨神经BDNF免疫组化照片(×400) 1.对照组4周;B.实验组4周;C.对照组8周;D.实验组8周 |
|
图 5 BDNF染色强度 与对照组比较,*P<0.05 |
|
图 6 坐骨神经电镜观察(×2 500) A.对照组4周见无髓神经纤维,排列较为紊乱;B.实验组4周见有髓神经纤维和无髓神经纤维,排列较为整齐;C.对照组8周见有髓神经纤维和无髓神经纤维,髓鞘较薄,有髓神经纤维较少;D.实验组8周见有髓神经纤维排列整齐,髓鞘较厚 |
神经损伤后由于局部的生理环境的变化,胶质瘢痕的形成,使得神经无法穿越损伤区域,以及神经元的凋亡、神经细胞的迁移和轴突的生长缺乏靶向性、局部存在抑制轴突的因素等原因,使得神经再生困难。
封闭负压引流基本工作原理是以vacuseal材料作为引流管与创面的中介,通过负压装置接引流管达到全创面引流,使创面渗出物及时被清除。随着学者对VSD的研究日益增多,其更多的优点也被逐步发现并证实[1, 2]:①VSD能明显提高创面微循环血流速度,扩张微血管,从而增加创面血供,改善血循环。②VSD能显著减轻创周水肿,从而有利于创面的愈合。③密闭敷料为免疫功能细胞发挥吞噬、杀灭细菌提供了良好的局部环境,进而有利于创面感染的预防。④VSD能促进损伤组织中血管内皮细胞生长因子(vascular endothelial cell growth factor,VEGF)的生成。⑤CD34在VSD治疗后表达的微血管密度明显增强,从而推断VSD能明显增强在创缘组织真皮浅层血管内皮细胞、成纤维细胞的增殖和微血管密度,促进慢性创面肉芽组织生长等优点。
虽然VSD能够促进创面愈合的确切作用机制尚不完全清楚,但是通过大量的实验可以证实VSD对局部血流的增加、局部水肿的消除、积聚的创面渗液减少、保持创面及创周组织的湿润环境、减轻创伤后免疫抑制、抑制创面细菌的生长、调节胶原酶及明胶酶的活性、促进细胞增殖和肉芽组织的生长等多个方面起到了综合作用[3]。
经过实验证明,VSD能使微血管口径扩大,降低微血管通透性[4],增加周围神经末梢分泌P物质以及降钙素相关基因肽的表达以影响内源性表皮生长因子的表达[5, 6]。说明VSD能够影响毛细血管的结构和血管周围的活性分子的表达。毛细血管床的开放和毛细血管的生成提高了组织的血液灌流,改善了局部的氧供,为组织修复提供有利环境。该实验中,我们通过新西兰大白兔修复的坐骨神经检测其神经传导速度、通过测量小腿三头肌恢复率以及HE染色及免疫组化可以看出,对照组和实验组之间有统计学差异,说明使用VSD对神经损伤修复起到一定的促进作用。结合大量动物实验研究,已经初步从细胞分子生物学水平阐述了使用VSD对加快创面愈合和促进创面肉芽组织生长的机制。Morykwas等[7]报道VSD组较对照组创面愈合快,并且血小板衍生生长因子(platelet derived growth factor,PDGF)和肿瘤生长因子-β(tumor growth factor-β,TGF-β)等表达显著增加。另外,改善微循环可以促进神经的修复。因此,推测其促进神经修复的原理可能与以下几点有关:①VSD能够增加毛细血管床的开放和毛细血管的生长,提高了局部的氧供,促进了神经的血管化;②VSD能够促进周围神经的活性物质的分泌,其能促进神经轴突的再生生长;③VSD能够减轻局部的炎症反应,促进局部的修复和生长。
BDNF是神经营养因子家族中的一员,其在大脑中生成并维护神经元轴突扮演着重要的角色。近年来,其在周围神经中作用也被发现。周围神经损伤时,BDNF能在体外增强轴突再生[8],并且促进近侧神经断端向失神经支配的远侧断端出芽[9]。因此,本实验选取BDNF作为本实验免疫组化的对象,结果显示,VSD能促进兔坐骨神经神经损伤后BDNF表达增高。
有研究表明,-80 mmHg下对血流的影响与-125 mmHg负压下无明显差异,因此建议,在患处疼痛或局部软组织缺血情况下,可适当降低负压;其研究还指出,在-50、-75和-125 mmHg负压状态下,对收缩伤口的作用无明显差异[10]。目前在临床上将负压值设定为-(75-100) mmHg,因此,我们将负压控制在-75 mmHg左右。并且,我们在预实验中,对4只大白兔进行坐骨神经截断并原位缝合后,分为两组,每组两只,分别采用一期缝合伤口、-75 mmHg负压吸引4周后发现,两组伤口均无红肿渗出;同时,对神经进行甲胺蓝染色发现,两组均有少许神经纤维生长,部分纤维排列整齐,其中,-75 mmHg组中的神经纤维比一期缝合组生长更快。因此我们认为,-75 mmHg左右强度的负压对神经损伤修复可能具有促进作用,而对神经无明显损伤作用。但具体维持多大的负压值对兔坐骨神经损伤的修复作用最明显及最安全,我们尚不清楚。这需要在以后继续研究。
此外,由于VSD的禁忌证之一为直接贴附于神经、血管表面,因此,我们取神经吻合处周围的肌肉置于vacuseal材料与坐骨神经之间,既避免了vacuseal材料直接接触坐骨神经,又保证了神经吻合处的负压状态。本实验仅证明了置于vacuseal材料与神经之间的肌肉厚度在不超过0.5 cm的情况下,VSD能促进坐骨神经损伤修复,因为我们考虑肌肉过厚,可能会影响神经吻合处的负压压力。但填塞于该处的肌肉、软组织的厚度具体如何影响神经周围的压力值,我们尚不清楚,这需要在以后的研究中继续深入探讨。另外,由于兔很难耐受长期持续负压吸引,部分动物在实验后期出现食欲差、精神差,因此,我们未进行长期实验,在4周或8周时即处死动物对标本取材。而且,本实验样本量不够充足,需对实验结果保持谨慎态度。本实验并不是严格按照5-7 d更换一次VSD,根据每次查看动物的情况决定时间更换VSD。另外,本次实验是初步探讨封闭负压吸引对外周神经损伤修复的影响,至于其作用机制,负压的大小、持续的时间等对外周神经修复的影响,还需要进一步实验研究。
| [1] | 张强, 高伟, 张抒, 等. 显微外科手术配合负压封闭吸引治疗慢性骨髓炎16例[J]. 中华显微外科杂志, 2010, 33(1): 78-79. |
| [2] | Zhang YG, Yang Z, Zhang H, et al. Negative pressure technology enhances bone regeneration in rabbit skull defects[J]. BMC Musculoskelet Disord, 2013, 14: 76. DOI: 10.1186/1471-2474-14-76. |
| [3] | Deng K, Yu AX, Xia CY, et al. Combination of negative pressure wound therapy with open bone grafting for bone and soft tissue defects[J]. Mol Med Rep, 2013, 8(2): 468-472. |
| [4] | 刘兴邦, 余国荣, 陶圣祥, 等. 封闭负压引流对肉芽成纤维细胞生物学行为的影响[J]. 中华实验外科杂志, 2010, 27(11): 1599-1601. |
| [5] | Malmsjö M, Gustafsson L, Lindstedt S, et al. Negative pressure wound therapy-associated tissue trauma and pain: a controlled in vivo study comparing foam and gauze dressing removal by immunohistochemistry for substance P andcalcitonin gene-related peptide in the wound edge[J]. Ostomy Wound Manage, 2011, 57(12): 30-35. |
| [6] | Younan G, Ogawa R, Ramirez M, et al. Analysis of nerve and neuropeptide patterns in vacuum-assisted closure-treated diabetic murine wounds[J]. Plast Reconstr Surg, 2010, 126(1): 87-96. DOI: 10.1097/PRS.0b013e3181da86d0. |
| [7] | Argenta LC, Morykwas MJ. Vacuum-assisted Closure: a new method for wound control and treatment : clinical experience: Clinical Experience[J]. Ann Plast Surg, 1997, 38(6): 563-577. DOI: 10.1097/00000637-199706000-00002. |
| [8] | Wong WK, Cheung AW, Yu SW, et al. Hepatocyte growth factor promotes long-term survival and axonal regeneration of retinal ganglion cells after optic nerve injury: comparison with CNTF and BDNF[J]. CNS Neurosci Ther, 2014, 20(10): 916-929. DOI: 10.1111/cns.2014.20.issue-10. |
| [9] | Tseng TC, Hsu SH. Substrate-mediated nanoparticle/gene delivery to MSC spheroids and their applications in peripheralnerve regeneration[J]. Biomaterials, 2014, 35(9): 2630-2641. DOI: 10.1016/j.biomaterials.2013.12.021. |
| [10] | Kasai Y, Nemoto H, Kimura N, et al. Application of low-pressure negative pressurewound therapy to ischaemic wounds[J]. J Plast Reconstr Aesthet Surg, 2012, 65(3): 395-398. DOI: 10.1016/j.bjps.2011.08.010. |
 2016, Vol. 37
2016, Vol. 37

 ,
,