Conduit Repairs Defects of Sciatic Nerve in Rats
周围神经损伤是临床常见病、多发病和难治性疾病。很多学者尝试使用血管、筋膜管、硅胶管、聚乳酸管以及自体或异体神经移植来修复周围神经缺损,但其效果不尽如人意[1, 2]。由于组织工程技术的研究日益成熟,组织工程化合成材料神经导管为周围神经损伤的患者提供了新的治疗方案,但目前的组织工程化人工神经普遍缺乏有效营养血管,以致损伤部位神经再生的效果十分有限[3]。因此,探索具有促神经血管化功能的组织工程化纳米复合材料人工神经导管成为当前研究的热点。血管内皮生长因子对自体神经移植后的周围神经修复有明显促进作用[4]。Zor等[5]研究表明人工神经导管局部应用血管生长因子基因 (pHVEGF16) 能明显促进周围神经再生。本研究用n-HAP/PRGD/PDLLA/VPA复合材料神经导管桥接大鼠缺损15 mm坐骨神经,同时导管内注入pHVEGF16,考察其对再生神经血管化的有效性,为该复合材料神经导管在后期临床使用提供理论依据。
1 材料与方法 1.1 材料及仪器健康雄性SPF级SD大鼠60只,体重300-350 g,由武汉大学实验动物中心提供。pHVEGF16由武汉大学基础医学院免疫实验室提供,PDLLA/PRGD/HAP/VPA神经导管由武汉理工大学生物材料与工程研究中心提供,锇酸、戊二醛、环氧树脂、亚甲基蓝-品红染液和磷钨酸苏木素染液、光学显微镜、透射电子显微镜 (Hitachi公司,日本) 由武汉大学人民医院电镜中心提供;步态分析盒 (自制),Powerlab生理记录仪 (ADInstruments公司),Image J分析软件 (Bethesda公司,美国);显微器械、缝线、硅胶管由武汉大学人民医院骨科提供。
1.2 动物模型制备大鼠用异氟醚麻醉后俯卧在手术板上橡皮筋固定、消毒,均在右后肢作切口,游离坐骨神经后在10倍手术显微镜下离犁状肌下孔10 mm切断坐骨神经,并于切口远端15 mm再次截断,制成坐骨神经缺损15 mm的动物模型。A、B组用20 mm长的PDLLA/PRGD/HAP/VPA神经导管,D组用长约20 mm的硅胶管套入神经近、远断端各2 mm,C组不改变方向直接原位缝合两断端切口作自体神经移植,均在显微镜下用7-0显微尼龙缝线无创缝合3-4针,A组当即向套管内注入pHVEGF165 500 μg,总量为0.5 ml,止血、缝合。常规喂养12周。
1.3 检测指标 1.3.1 坐骨神经功能指数 (SFI)用Inserra等[6]描述的方法进行运动功能评估,制作长50 cm、宽20 cm、高40 cm的模具,用80 g与模具底同等大小的白纸铺于模具内面。红色染料浸染大鼠双后肢踝关节以上,使其从模具的一端向另一端爬行,双后肢在白纸上染5-6个足印,取用清晰的足迹测量正常足 (N) 和伤足 (E) 相关指标。PL (足印长度):从足尖到足跟的最大距离。TS (足趾宽度):第1趾到第5趾的距离。IT (中间足趾宽度):第2趾到第4趾的距离。结果精确到0.1 mm。SFI计算公式:SFI=118.9×(ETS-NTS)/NTS-51.2×(EPL-NPL)/NPL-7.5。神经功能正常SFI=0,神经功能完全丧失SFI=-100。
1.3.2 电生理检测术后12周麻醉大鼠,暴露术侧坐骨神经,Powerlab生理记录仪测定各组术侧运动神经传导速度。
1.3.3 腓肠肌湿重检测分别于术后4、8和12周,分离并迅速切取双侧腓肠肌,立即称取术侧腓肠肌湿重。
1.3.4 组织学观察在缝合端近远端各5 mm处取一定长度的神经组织,磷钨酸苏木素染色切片后,400倍光镜下观察有髓神经纤维连续和中断情况。亚甲基蓝-碱性品红染色作半薄切片 (1 μm),每组取5张切片,每张切片400倍镜下取5个视野,采用Image J软件计数轴突,结果取均值。
1.3.5 透射电镜观察每组大鼠在距导管缝合处近端10 mm取材,每组取5张切片,每张切片取5个视野,用Image J软件计算髓鞘总数、厚度及轴突直径,结果取平均值。
1.4 统计分析采用SPSS 19.0统计软件包进行分析。所得数据用x±s表示。组间比较采用单因素方差分析,两两比较采用LSD检验。P<0.05为差异有统计学意义。
2 结果 2.1 坐骨神经功能指数测量结果各组大鼠每隔半月走一次足印,直至术后3个月。结果发现,A组术后运动功能恢复较快,8周后SFI恢复不显著,10周以后运动功能优于其他各组,具有统计学意义 (P<0.05);B组4周时SFI开始恢复,此后恢复趋势不明显,B组各时间SFI的恢复差于A组 (P<0.05),与C组相比无统计学意义 (P>0.05);C组术后4周SFI恢复较明显,C组各时间SFI恢复均优于D组 (P<0.05),C组与B组比较无统计学意义 (P>0.05),C组与A组SFI比较前8周无统计学意义 (P>0.05),10周开始C组SFI差于A组,其差异有统计学意义 (P<0.05);D组术后各时间SFI均恢复不明显,各时期运动功能均差于A组和C组 (P<0.05)。见表 1。
| 表 1 坐骨神经功能指数SFI结果 (x±s,n=5) |
术后12周,各组均有肌电图,A、C组间坐骨神经传导速度无统计学意义 (P>0.05),但A组检测结果优于B、D组,差异有统计学意义 (P<0.05),见表 2。
| 表 2 术后12周电生理检测 (x±s,n=5) |
术后8周开始,A组腓肠肌湿重测定均优于B组和D组,差异具有统计学意义 (P<0.05),A组和C组比较,差异无统计学意义。见表 3。
| 表 3 腓肠肌湿重检测 (x±s,n=5,mg) |
光镜下,大鼠坐骨神经磷钨酸苏木素染色切片蓝色为神经纤维,红棕色为胶原纤维和网状纤维染,浅红棕色为胞质。AC两组神经纤维分布致密较整齐,形状和大小规则,较少变性坏死,神经纤维的连续性显著优于B、D组。B、D组神经纤维排列较A、C两组杂乱无序,可见正常神经纤维结构破坏,较多连续性中断现象,见图 1。亚甲基蓝-碱性品红染色显示A、C组再生神经纤维形成大小基本相当的纤维束,神经纤维髓鞘化明显,已趋近成熟,髓鞘变性少见;B、D两组轴突分布较A组和C组稀疏不均匀且新生不成熟轴突和脱髓鞘及变性改变较多见 (见图 2)。A组轴突计数显著多于其他三组,比较差异有统计学意义 (P<0.05)。B组优于D组,比较差异有统计学意义 (P<0.05),见表 4。
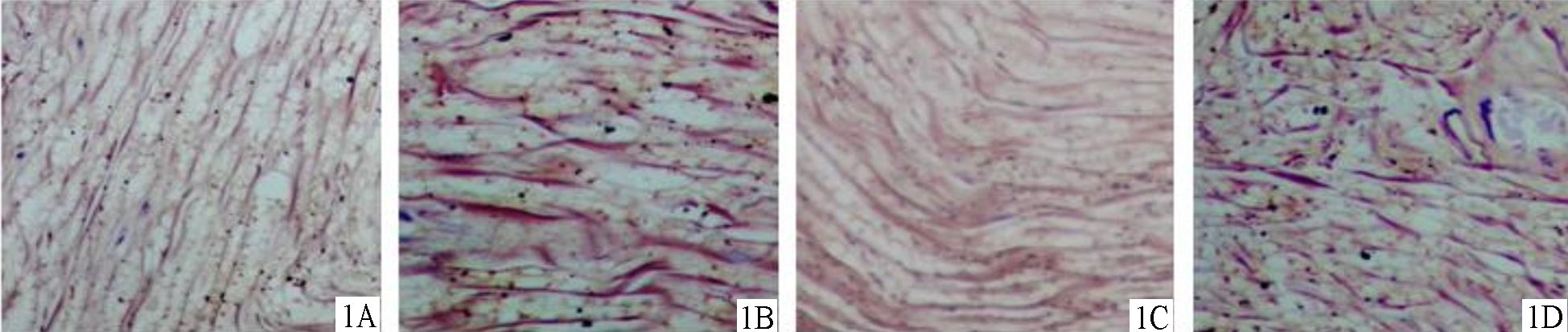
|
图 1 12周时各组大鼠坐骨神经纤维的束状分布情况 (磷钨酸苏木素染色×400) 1A.神经导管桥接+局部注射组; 1B.单纯神经导管桥接组; 1C.自体神经移植组; 1D.硅胶管桥接组 |
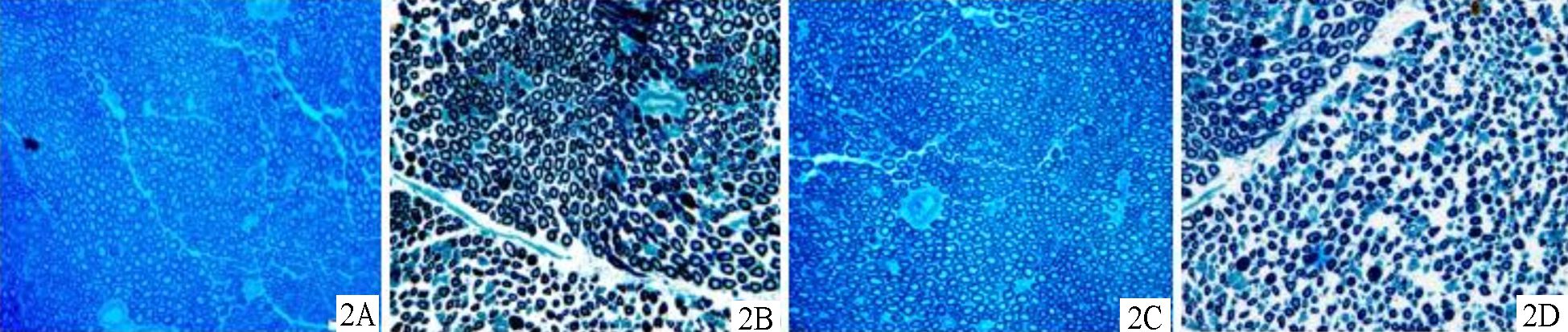
|
图 2 12周时各组大鼠坐骨神经纤维神经纤维再生情况 (亚甲基蓝-碱性品红染色光镜×400) 2A.神经导管桥接+局部注射组;2B.单纯神经导管桥接组;2C.自体神经移植组;2D.硅胶管桥接组 |
| 表 4 各组组织学及透射电镜测量指标比较 (x±s,n=5) |
术后12周,各组均有有髓和无髓纤维再生,A、C组髓鞘较厚,排列整齐且大多数髓鞘结构发育良好,脱髓鞘改变较少,神经纤维基本成熟,B、D组髓鞘厚度明显小于A、C组,有较多脱髓鞘改变,见图 3。A组轴突直径显著高于B、D组,差异有统计学意义 (P<0.05),与C组比较差异无统计学意义 (P>0.05)。A组髓鞘厚于B、C、D组,差异有统计学意义 (P<0.05);B组与C组比较,差异无统计学意义 (P>0.05),见表 4。
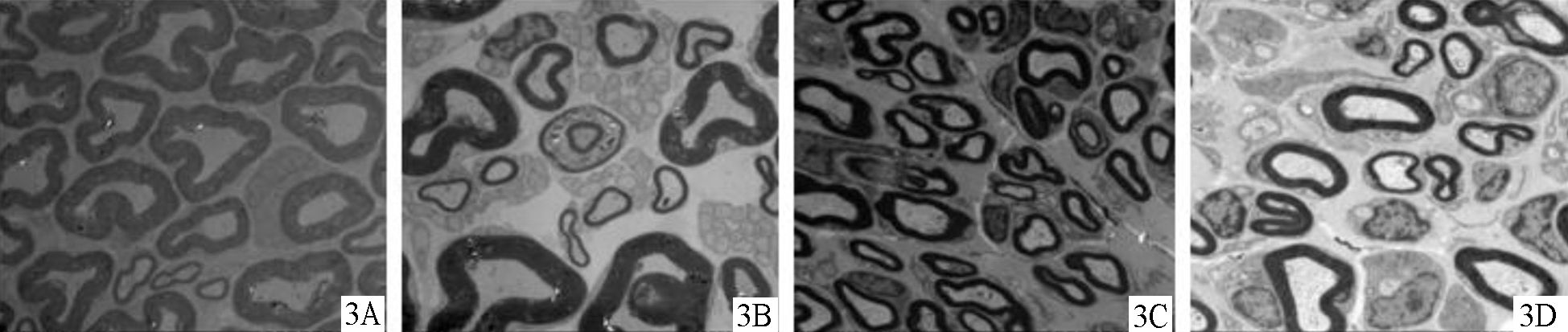
|
图 3 12周时各组大鼠坐骨神经轴突和髓鞘电镜下形态 (×1 000) 3A.神经导管桥接+局部注射组;3B.单纯神经导管桥接组;3C.自体神经移植组;3D.硅胶管桥接组 |
自体神经移植目前仍被认为是周围神经缺损治疗的金标准[7]。但因供体神经数量不足,受区神经不匹配及供区功能障碍受到很大限制[8]。组织工程技术兴起促使组织工程化神经导管越来越多被用于神经缺损的治疗。Li等[9]用PRGD/PDLLA神经导管局部加用睫状神经营养因子修复大鼠坐骨神经10 mm神经缺损实验表明PRGD/PDLLA导管为轴突创造了有效再生微环境,但促进血管形成效果不明显。Azizi等[10]用α-硫辛酸装载壳聚糖导管桥接大鼠10 mm长坐骨神经损伤,只营造了神经再生的一般微环境,未能重建有效营养血管,因而神经再生效果受到限制。Rui等[11]发现血管内皮生长因子 (VEGF) 不仅有助于血管生成,还通过抑制细胞凋亡的直接影响神经元和神经胶质细胞,在神经再生中起间接作用。Zhu等[12]将银杏叶提取物 (EGb761) 应用于大鼠15 mm坐骨神经缺损自体神经移植术后,促进新生神经有效血管形成,神经再生情况较好;Zor等[5]在缝合端局部应用血管内皮生长因子基因pHVEGF16促进大鼠损伤坐骨神经再生与修复,显示出较好的疗效。
本次实验用PDLLA/PRGD/HAP/VPA神经导管联合局部注射pHVEGF16治疗大鼠坐骨神经15 mm缺损。采用的神经导管有如下优点:①PDLLA/PRGD/HAP/VPA材料为纳米复合材料,有很好的生物相容性。②材料中n-HAP能提高孔隙率,增加细胞与支架接触面,调节pH值,延缓降解;PDLLA具备较好的生物相容性和可降解吸收性,PRGD材料能引导细胞增殖、分化和迁移;丙戊酸钠 (VPA) 对损伤的周围神经再生作用明显,能诱导SCs增殖。③本次实验应用的导管能有效促进神经血管化,弥补了以往组织工程导管没有的功能,显著促进了神经功能的恢复。
综上所述,运用n-PDLLA/VPA/PRGD/HAP复合材料神经导管联合局部注射pHVEGF16对大鼠15 mm坐骨神经缺损显示出了良好的神经修复效果,说明人工神经导管血管化的重要性和此种复合材料神经导管对于损伤神经再生的有效性,而局部注射pHVEGF16的适宜浓度和毒性作用有待进一步研究。
| [1] | Sabongi RG, Fernandes M, Dos SJ. Peripheral nerve regeneration with conduits: use of vein tubes[J]. Neural Regen Res, 2015, 10(4): 529-533. DOI: 10.4103/1673-5374.155428. |
| [2] | Shapira Y, Tolmasov M, Nissan M, et al. Comparison of results between chitosan hollow tube and autologous nerve graft in reconstruction of peripheral nerve defect: An experimental study[J]. Microsurgery, 2016, 36(8): 664-671. DOI: 10.1002/micr.v36.8. |
| [3] | Ebenezer GJ, Mcarthur JC, Polydefkis M, et al. SIV-induced impairment of neurovascular repair: a potential role for VEGF[J]. J Neurovirol, 2012, 18(3): 222-230. DOI: 10.1007/s13365-012-0102-5. |
| [4] | Hoben G, Yan Y, Iyer N, et al. Comparison of acellular nerve allograft modification with Schwann cells or VEGF[J]. Hand (NY), 2015, 10(3): 396-402. DOI: 10.1007/s11552-014-9720-0. |
| [5] | Zor F, Deveci M, Kilic A, et al. Effect of VEGF gene therapy and hyaluronic acid film sheath on peripheral nerve regeneration[J]. Microsurgery, 2014, 34(3): 209-216. DOI: 10.1002/micr.v34.3. |
| [6] | Inserra MM, Bloch DA, Terris DJ. Functional indices for sciatic, peroneal, and posterior tibial nerve lesions in the mouse[J]. Microsurgery, 1998, 18(2): 119-124. DOI: 10.1002/(ISSN)1098-2752. |
| [7] | Walocko FM, Khouri RJ, Urbanchek MG, et al. The potential roles for adipose tissue in peripheral nerve regeneration[J]. Microsurgery, 2016, 36(1): 81-88. DOI: 10.1002/micr.v36.1. |
| [8] | Burks SS, Levi DJ, Hayes S, et al. Challenges in sciatic nerve repair: anatomical considerations[J]. J Neurosurg, 2014, 121(1): 210-218. DOI: 10.3171/2014.2.JNS131667. |
| [9] | Li B, Qiu T, Iyer KS, et al. PRGD/PDLLA conduit potentiates rat sciatic nerve regeneration and the underlying molecular mechanism[J]. Biomaterials, 2015, 55: 44-53. DOI: 10.1016/j.biomaterials.2015.03.028. |
| [10] | Azizi S, Heshmatian B, Amini K, et al. Alpha-lipoic acid loaded in chitosan conduit enhances sciatic nerve regeneration in rat[J]. Iran J Basic Med Sci, 2015, 18(3): 228-233. |
| [11] | Rui J, Dadsetan M, Runge MB, et al. Controlled release of vascular endothelial growth factor using poly-lactic-co-glycolic acid microspheres: in vitro characterization and application in polycaprolactone fumarate nerve conduits[J]. Acta Biomater, 2012, 8(2): 511-518. DOI: 10.1016/j.actbio.2011.10.001. |
| [12] | Zhu Z, Zhou X, He B, et al. Ginkgo biloba extract (EGb 761) promotes peripheral nerve regeneration and neovascularization after acellular nerve allografts in a rat model[J]. Cell Mol Neurobiol, 2015, 35(2): 273-282. DOI: 10.1007/s10571-014-0122-1. |
 2017, Vol. 38
2017, Vol. 38

 ,
,