心肌肥厚是心脏对压力、容量负荷及激素等多种刺激因素产生的适应性反应,主要表现为心肌细胞肥大,胶原沉积增加,最终可导致心脏扩张。心肌肥厚是各种心血管疾病发展为心力衰竭的必经阶段,持续心肌肥厚不能逆转会使心律失常、心源性猝死发生率显著升高[1]。然而心肌肥厚的发病机制尚不明晰,目前临床药物仍不能有效防治。大量实验表明丝裂原激活的蛋白激酶(mitogen activated protein kinase,MAPK)信号通路参与了心肌肥厚的发生与发展。因此,寻找抑制MAPK信号通路的药物可为心肌肥厚临床防治提供新的思路。
心肌肥厚发生时,在压力负荷刺激下心肌细胞体积增大,为了维持心肌结构与功能的稳定,心肌启动凋亡通路诱发受损心肌细胞凋亡[2]。在长期的压力负荷刺激下,心肌肥厚由代偿期向失代偿期转化,心肌细胞凋亡增加导致心肌收缩细胞数目减少,心脏收缩功能受损,进而心功能下降,加速心肌肥厚向心力衰竭的发展[3, 4]。因此,发现减少心肌细胞凋亡的药物可能会延缓心肌肥厚向心力衰竭的发展。
柚皮素(Naringenin)是一种在芸香科植物中广泛存在的二氢黄酮类化合物。已有研究表明,柚皮素可以通过MAPK信号通路参与多种疾病的发生发展[5-7]。此外,研究表明柚皮素与细胞凋亡密切相关[8, 9]。但柚皮素是否可以通过以上机制影响心肌肥厚尚不明晰。本实验使用血管紧张素Ⅱ(Angiotensin Ⅱ, Ang Ⅱ)刺激原代大鼠心肌细胞建立心肌肥大模型,经柚皮素干预后探讨其对心肌肥厚作用机制。
1 材料与方法 1.1 实验试剂柚皮素购于上海融禾医药科技发展有限公司。Ang Ⅱ购于Sigma(上海)公司。本实验所用抗JNK,P-JNK,ERK,P-ERK,P38,P-P38,BCL-2,BAX以及GAPDH抗体均购买自Cell Signaling Technology公司。α-actinin购于Abcam公司。实验所用二抗均购于LI-COR Biosciences公司。细胞凋亡-Hoechst染色试剂盒购于碧云天生物技术公司。
1.2 原代大鼠心肌细胞培养分离纯化的原代大鼠心肌细胞(Neonatal Rat Ventricular Cardiomyocytes,NRVMs)用15%FBS DMEM/F12培养基(GIBCO,C11995),置于5%CO2的37 ℃培养箱(SANYO18M)中培养12 h。0.1 μmol/L溴脱氧尿苷用于抑制成纤维细胞生长,并给予链霉素(100 mg/ml)和青霉素(100 U/ml)。随后,NRVMs分别接种至6孔板和24孔板中,用0.5%FBS的DMEM/F12饥饿培养12 h后,分别给予Ang Ⅱ(10-6mol/L)和柚皮素(100 μmol/L)刺激。Cell Counting Kit (CCK-8) 方法检测心肌细胞的活性。
1.3 实验分组本实验分为Vehicle组、Naringenin组、AngⅡ组和AngⅡ+Naringenin组。
1.4 心肌细胞横截面积检测通过细胞免疫荧光染色法染细胞骨架α-actinin检测心肌细胞横截面积。将NRVMs接种于24孔板上的细胞爬片,分别给予AngⅡ和柚皮素刺激48 h后,4%多聚甲醛固定,0.1%Triton X-100通透,α-actinin(1:100稀释)抗体孵育,常规进行α-actinin免疫荧光染色后,倒置荧光显微镜(尼康)下观察心肌细胞面积的变化。拍照后用Image-Pro Plus 6.0(IPP)软件进一步测量分析心肌细胞横截面积。
1.5 RT-PCR检测基因表达水平采用TRIzol抽提试剂裂解提取NRVMs中的总RNA,反转录试剂盒(Rcho)将2 μg RNA进行反转录后,应用LightCycler 480 SYBR Green Ⅰ Master试剂盒(Roche Diagnostics GmbH)对cDNA进行扩增。扩增条件如下:95 ℃预变性2 min,95 ℃变性10 s,59 ℃退火10 s,72 ℃延伸15 s,共45个循环。目的基因以GAPDH为内参对其表达量进行校正,本实验所用引物序列如表 1。
| 表 1 RT-PCR所用引物序列 |
按每毫升含720 μl RIPA,100 μl complete,100 μl Phos-stop,50 μl NaF,20 μl PMSF,以及10 μl Na3VO4的比例,配制蛋白裂解液提取NRVMs总蛋白后行SDS-PAGE凝胶电泳,蛋白转膜、封闭后一抗孵育4 ℃过夜。TBST洗涤后室温下二抗孵育1 h,应用Odyssey Infrared Imaging System软件对蛋白进行半定量分析。目的蛋白以GAPDH为内参蛋白对其表达量进行校正。
1.7 心肌细胞凋亡检测根据细胞凋亡-Hoechst染色试剂盒说明书对NRVMs进行免疫荧光染色。先后经固定液固定,Hoechst 33258染色液及抗荧光淬灭染色封片后,在倒置荧光显微镜下观察,比较心肌细胞凋亡水平变化并拍照。正常细胞胞核呈正常的蓝色,凋亡细胞胞核呈致密浓染,或呈碎块状致密浓染。
1.8 统计学方法利用SPSS 19.0软件进行统计学分析。实验结果均以均数±标准差(x±s)表示,多组间比较采用单因素方差(one-way ANOVA)分析。P<0.05表示差异具有统计学意义。
2 结果 2.1 柚皮素能减轻AngⅡ诱导的心肌细胞肥大为了确定柚皮素干预浓度,利用CCK8试剂盒检测心肌细胞活性(图 1A),当柚皮素浓度大于100 μmol/L时,AngⅡ组心肌细胞活性较PBS组明显降低,因此本实验中确定柚皮素对NRVMs干预浓度为100 μmol/L。与Vehicle组、Naringenin组相比,AngⅡ刺激48 h后心肌细胞横截面积明显增加,但同时给予柚皮素干预后心肌细胞面积减小(图 1B-C)。单纯给予柚皮素处理的心肌细胞横截面积与Vehicle组相比无明显差异。RT-PCR检测心肌细胞肥大标志物ANP及BNP的mRNA表达,结果显示AngⅡ刺激组ANP、BNP的mRNA水平较Vehicle组明显升高,而同时给予柚皮素干预后ANP、BNP mRNA表达水平下调(图 1D)。在未给予AngⅡ刺激两组中,柚皮素处理并不能改变ANP、BNP的mRNA表达水平。
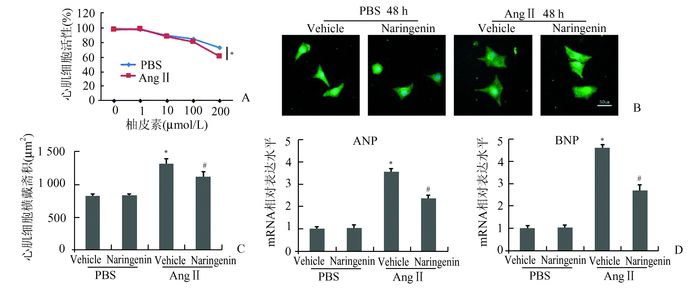
|
图 1 柚皮素能减轻AngⅡ诱导的心肌细胞肥大 AngⅡ组与其他三组比较,*P<0.05;AngⅡ组与AngⅡ+Naringenin组比较,#P<0.05 |
为了探讨柚皮素减轻AngⅡ诱导心肌细胞肥大的可能机制,利用Western Blot检测心肌细胞中MAPK信号通路蛋白表达水平。结果显示,与对照组相比,AngⅡ刺激48 h后P-JNK,P-ERK,P-P38蛋白表达水平均明显上调。而与AngⅡ组相比,AngⅡ+Naringenin组的P-ERK,P-P38蛋白表达水平则显著降低,P-JNK蛋白表达水平则无明显差异(图 2A-2B)。Naringenin组与Vehicle组相比,各蛋白表达水平无明显差异。
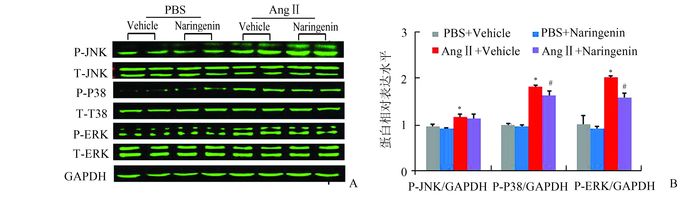
|
图 2 柚皮素通过抑制MAPK信号通路发挥心肌保护作用 AngⅡ组与其他三组比较,*P<0.05;AngⅡ组与AngⅡ+Naringenin组比较,#P<0.05 |
为检测柚皮素对心肌细胞凋亡水平的影响,采用细胞凋亡-Hoechst染色试剂盒对NRVMs进行免疫荧光染色。结果显示,与PBS对照组相比,AngⅡ刺激48 h后心肌细胞凋亡数目显著增加;而同时给予柚皮素干预后,心肌细胞凋亡水平较AngⅡ组则有明显改善(图 3A),而PBS+Vehicle组与PBS+Naringenin组细胞凋亡无明显差异。Westren-Blot进一步检测细胞凋亡相关蛋白BAX及BCL-2蛋白水平,结果显示柚皮素可以降低AngⅡ刺激导致BAX水平上调,而抗凋亡蛋白BCL-2蛋白表达水平在AngⅡ+Naringenin组表达增加(图 3B)。对蛋白进行半定量后计算BAX/BCL-2比值,结果显示,与对照组相比AngⅡ组BAX/BCL-2比值明显增加,而AngⅡ+Naringenin组下调(图 3C)。上述结果说明柚皮素可以减轻AngⅡ刺激诱导的心肌细胞凋亡。
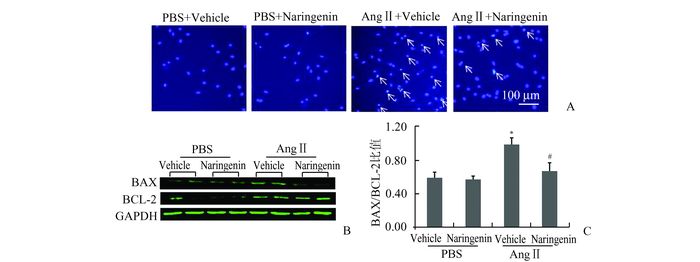
|
图 3 柚皮素可以减轻AngⅡ刺激诱导的心肌细胞凋亡 AngⅡ组与其他三组比较,*P<0.05;AngⅡ组与AngⅡ+Naringenin组比较,#P<0.05 |
本实验结果显示,柚皮素可以减轻AngⅡ诱导的心肌细胞肥大,可以抑制AngⅡ刺激所引起的P-P38和P-ERK表达水平上调,并减少AngⅡ诱导的心肌细胞凋亡。上述结果提示,柚皮素可能通过抑制P-P38和P-ERK信号通路及抑制心肌细胞凋亡对AngⅡ刺激NRVMs诱导的心肌肥大发挥保护作用。
心肌肥厚是心脏对各种刺激产生的适应性反应,主要表现为心肌细胞体积增大及心脏质量增加。本实验利用AngⅡ诱导心肌细胞肥大以模拟构建体外心肌肥厚模型。研究表明,AngⅡ可以激活MAPK信号通路,包括ERK、P38及JNK。更重要的是,ERK、P38和JNK均为心肌肥厚的重要调节因子,目前已有大量的文献表明,该三种基因参与了心肌肥厚发生与发展。Kehat等研究表明,当心肌细胞接受外界的肥厚刺激时ERK可以被激活,而特异性敲除心脏中的ERK导致心肌肥厚反应恶化[10]。Wang等研究表明,P38在压力负荷诱导的心肌肥厚时表达激活;在体外培养的心肌细胞中过表达P38时肥厚反应加重[11]。同样,JNK在压力刺激的心肌细胞或在体心脏中也可以被迅速激活[12]。此外,有研究表明,柚皮素可以通过影响MAPK信号通路来参与多种疾病的发生发展。柚皮素可以通过ERK1/2信号转导通路诱导胚滋养层细胞的迁移[5],也可以通过抑制ERK1/2、P38以及JNK保护脂多糖诱导的正常人支气管上皮细胞损伤[6]。但柚皮素是否可以通过ERK、P38或JNK MAPK来影响心肌肥厚仍然不得而知。本实验中,我们通过Western Blot检测心肌细胞中以上三种蛋白的磷酸化水平,发现柚皮素处理后,AngⅡ诱导的NRVMs ERK和P38的磷酸化水平明显下调,但JNK的磷酸化水平无明显变化。这提示我们,柚皮素可能通过抑制ERK和P38的磷酸化水平从而起到抑制心肌肥厚的作用。但本实验中并没有给予MAPK通路的抑制剂或进行基因敲除阻断该通路进行反证,因此会在将来实验中进一步验证。
心肌细胞凋亡对于维持心脏组织的相对稳定至关重要,是心脏由代偿性心肌肥厚向病理性转化的细胞学基础。心肌肥厚发生过程中,心肌细胞凋亡比率过高导致心肌收缩细胞数目减少,心肌收缩能力受损。以往研究发现柚皮素可以通过调节细胞凋亡保护紫外线诱导的人胶质细胞损伤[9]。此外,柚皮素可以促进人类肿瘤细胞凋亡并且调控凋亡基因的表达[10]。因此我们推测,柚皮素是否也可以通过调节心肌细胞凋亡发挥保护作用。本实验应用Hoechst细胞凋亡染色以及检测凋亡相关基因BCL-2和BAX的蛋白表达观察其对心肌细胞凋亡的作用。结果发现,柚皮素能够减少AngⅡ诱导的原代大鼠心肌细胞凋亡,同时与AngⅡ组相比,凋亡相关蛋白BAX/BCL-2比值在AngⅡ+Naringenin组降低。结果提示,柚皮素可以调节心肌细胞凋亡从而起到减轻心肌肥厚的作用。
综上所述,柚皮素可以减轻AngⅡ刺激引起的心肌细胞肥大,其保护作用可能与抑制MAPK信号通路以及减轻心肌细胞凋亡有关,但其具体机制仍需要我们深入研究,为心肌肥厚的临床干预提供新的思路。
| [1] | Go AS, Mozaffarian D, Roger VL, et al. Heart disease and stroke statistics--2013 update: a report from the American Heart Association[J]. Circulation, 2013, 127: e6-e245. |
| [2] |
薛锋, 薛明明, 张琪, 等. 塞来昔布对心肌肥厚大鼠TNF-α与心肌细胞凋亡的影响[J].
河北医科大学学报, 2016, 37(7): 749-752.
Xue F, Xue MM, Zhang Q, et al. The effect of celecoxib on TNF-α and apoptosis in myocardial hypertrophy in rats[J]. Journal of Hebei Medical University, 2016, 37(7): 749-752. |
| [3] | van Empel VP, Bertrand AT, Hofstra L, et al. Myocyte apoptosis in heart failure[J]. Cardiovasc Res, 2005, 67(1): 21-29. DOI: 10.1016/j.cardiores.2005.04.012. |
| [4] | Sun B, Huo R, Sheng Y, et al. Bone morphogenetic protein-4 mediates cardiac hypertrophy, apoptosis, and fibrosis in experimentally pathological cardiac hypertrophy[J]. Hypertension, 2013, 61(2): 352-360. DOI: 10.1161/HYPERTENSIONAHA.111.00562. |
| [5] | Lim W, Song G. Naringenin-induced migration of embrynoic trophectoderm cells is mediated via PI3K/AKT and ERK1/2 MAPK signaling cascades[J]. Mol Cell Endocrinol, 2016, 428: 28-37. DOI: 10.1016/j.mce.2016.03.018. |
| [6] | Yu DH, Ma CH, Yue ZQ, et al. Protective effect of naringenin against lipopolysaccharide-induced injury in normal human bronchial epithelium via suppression of MAPK signaling[J]. Inflammation, 2015, 38(1): 195-204. DOI: 10.1007/s10753-014-0022-z. |
| [7] | Lim W, Park S, Bazer FW, et al. Naringenin-induced apoptotic cell death in prostate cancer cells is mediated via the PI3K/AKT and MAPK signaling pathways[J]. J Cell Biochem, 2017, 118(5): 1 118-1 131. DOI: 10.1002/jcb.v118.5. |
| [8] | El-Mahdy M, Zhu Q, Wang Q, et al. Naringenin protects human keratinocytes against UVB-induced damage: Role of cellular apoptosis and DNA repair[J]. Cancer Research, 2007, 67(9 suppl): 4 592. |
| [9] | Abaza MS, Orabi K, Alattiyah RA, et al. Naringenin, a major bioactive lead of Thymus vulgaris, inhibits growth, induces apoptosis and modulates cell cycle and apoptosis-regulatory gene expression in human cancer cells (657.18)[J]. Faseb Journal, 2014, 28(1 Suppl): 657.18. |
| [10] | Kehat I, Molkentin JD. Extracellular signal-regulated kinase 1/2 (ERK1/2) signaling in cardiac hypertrophy[J]. Ann N Y Acad Sci, 2010, 1 188: 96-102. |
| [11] | Wang Y, Huang S, Sah VP, et al. Cardiac muscle cell hypertrophy and apoptosis induced by distinct members of the p38 mitogen-activated protein kinase family[J]. J Biol Chem, 1998, 273(4): 2161-2168. DOI: 10.1074/jbc.273.4.2161. |
| [12] | Yano M, Kim S, Izumi Y, et al. Differential activation of cardiac c-jun amino-terminal kinase and extracellular signal-regulated kinase in angiotensin Ⅱ-mediated hypertension[J]. Circ Res, 1998, 83(7): 752-760. DOI: 10.1161/01.RES.83.7.752. |
 2017, Vol. 38
2017, Vol. 38

