在全球人口不断增长和老龄化的情况下,前列腺癌发病率持续地增长[1]。目前,对于晚期前列腺癌和复发性前列腺癌主要是雄激素剥夺治疗。然而这些治疗方式可能会使得前列腺癌细胞雄激素受体失活,使得前列腺癌细胞对雄激素剥夺治疗不敏感,最终导致去势抵抗性前列腺癌[2]。
溴化结构蛋白4(bromodomain-containing protein 4, BRD4)是一种包含溴结构域的蛋白质,属于溴结构域和超末端结构(bromodomain and extraterminal domain, BET)蛋白家族中的一员[3]。通过与组蛋白赖氨酸结合,BRD4可以促使染色质重塑因子和转录因子等相关蛋白富集于特定的基因转录位点,改变RNA聚合酶Ⅱ的活性,调控基因的表达,参与细胞生长、细胞周期等一系列重要生物活动过程[4]。BET蛋白家族的致癌功能首次在睾丸核蛋白中线癌中证实,BRD4与睾丸核蛋白结合形成致癌蛋白,导致恶性睾丸核蛋白中线癌的发生[5]。随后众多文献报道,BRD4在肝癌、肾癌等肿瘤组织及癌细胞中为高表达,通过促进下游癌基因C-MYC的表达及抑制促凋亡基因BIM的表达,促进肿瘤的发生和发展[6, 7]。
目前,已报道了多种BET蛋白家族小分子抑制剂,JQ1作为其中一种抑制剂可以竞争性的与BRD4溴结构域相结合,使BRD4蛋白从染色质的乙酰化赖氨酸上置换下来,从而干扰BRD4发挥生物学功能[8]。在多种癌症的研究中,JQ1都有效地抑制了BET溴结构,抗癌作用显著[9]。JQ1可以使c-Myc的表达显著下降,而c-Myc在前列腺癌中发挥了重要的促癌和维持前列腺癌干细胞活性的作用[10],提示应用JQ1治疗前列腺癌具有广阔的应用前景。本文旨在探讨JQ1对前列腺癌细胞增殖的影响及其可能机制。
1 材料与方法 1.1 主要材料人前列腺癌细胞DU145购买于上海生命科学院细胞库,JQ1购买于Selleck,用二甲基亚砜(Dimethyl sulfoxide,DMSO)溶解后,配成溶度为50 mmol/L的储存浓度;CCK8试剂购置于同仁化工上海双达生物有限公司;磷脂结合蛋白-异硫氰酸荧光素/碘化丙啶(annexin V -fluorescein isothiocyanate/propidium iodide,Annexin V-FITC/PI)凋亡试剂盒凋亡试剂盒、PI周期试剂盒购置联科公司;兔抗C-MYC购置于ABCAM公司(AB39688),兔抗GAPDH购置于杭州贤至生物有限公司(AB-P-R 001),HRP标记羊抗兔二抗购置于武汉博士德生物工程有限公司(BA1054)。
1.2 方法 1.2.1 细胞培养前列腺癌细胞株DU145用含10%的胎牛血清的RPMI 1640的培养基,置于含5%的CO2、37 ℃、饱和湿度培养箱中培养。
1.2.2 CCK8法检测JQ1对前列腺癌细胞株的增殖活性影响调整DU145细胞浓度至5×103个/100 μl,以每孔100 μl将细胞接种于96孔板中。待细胞贴壁,弃去培养基,分别加入不同浓度的JQ1。处理24,48,72 h后,弃去培养基,每孔加入含100 μl培养基和10 μl的CCK8试剂,2 h后用酶标仪测于450 nm波长处读取吸光度值(OD值)。JQ1对细胞存活率的影响(%)=[(实验孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)],上述实验重复3次(实验孔含JQ1、细胞、培养基、CCK8试剂;对照孔含细胞、培养基、CCK8试剂;空白孔含培养基、CCK8试剂)。
1.2.3 流式细胞术检测细胞凋亡DU145细胞接种于6孔板中,待贴壁后加入DMSO、10,20 μmol/L的JQ1,48 h后收集各组细胞悬液,预冷的磷酸盐缓冲液(phosphate buffered solution, PBS)洗涤2遍,加入250 μl结合缓冲液(Binding Buffer)重悬细胞。取100 μl的细胞悬液于5 ml流式管中,加入5 μl Annexin V-FITC和10 μl PI溶液。室温避光孵育15 min,最后在反应管中加入400 μl PBS,流式细胞仪分析,上述实验重复3次。
1.2.4 流式细胞术检测细胞周期DU145细胞接种于6孔板中,待贴壁后加入DMSO、10,20 μmol/L的JQ1,48 h后0.25%胰酶消化并收集各组细胞悬液,加入70%的乙醇溶液4 ml过夜,之后加入PI和RNAseA(核糖核酸酶)室温避光孵育30 min,流式细胞仪分析,并用modfit LT2.0软件分析细胞周期,上述实验重复3次。
1.2.5 划痕实验检测JQ1对DU145迁移影响DU145接种在6孔板,含10%血清的培养基培养24 h后,分别加入20 μmol/L JQ1与DMSO继续培养24 h,用200 μl的移液枪头划痕。之后弃上层培养基,分别加入无血清的培养基继续培养,倒置显微镜观察并拍照不同时间点划痕的宽度。
1.2.6 Western Blot法检测JQ1对DU145中C-MYC蛋白表达的调控作用DU145细胞接种于6孔板,待细胞生长融合度达80%-90%,加入DMSO、10,20 μmol/L的JQ1,48 h弃去培养基,提取总蛋白并测量蛋白浓度,SDS-PAGE凝胶电泳分离后转移至PVDF膜上,用含5%脱脂奶粉的TBST室温封闭1.5 h,一抗4 ℃封闭过夜,以HRP标记的羊抗兔二抗室温孵育1.5 h,ECL发光液显影。
1.3 统计学方法每组实验均重复3次,采用SPSS 20.0统计软件分析,数据以均数±标准差(x±s)来表示,多组数据采用单因素方差分析,两组资料之间比较采用t检验法,P<0.05被认为差异有统计学意义。
2 结果 2.1 JQ1抑制DU145细胞株的增殖JQ1抑制前列腺癌细胞的增殖,在本研究中首先采取了浓度分别为0.016,0.08,0.4,2,10,20,50 μmol/L的JQ1处理DU145细胞株,72 h后采用CCK8实验计算各组的增殖率,得出JQ1对DU145细胞株的IC50值为15.94 μmol/L(图 1A)。因此之后的实验我们选取了JQ1浓度分别为10,20 μmol/L进行实验。JQ1对DU145的活性有明显的抑制作用,在浓度为10-20 μmol/L之间,随作用时间延长细胞活性逐渐降低(图 1B)。因此JQ1可呈时间和浓度依赖的方式抑制DU145的增殖。
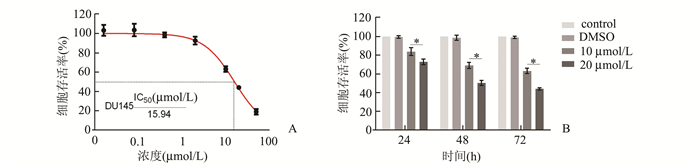
|
图 1 JQ1抑制DU145细胞的增殖 A:不同浓度JQ1处理DU145后细胞存活率;B:10,20 μmol/L的JQ1处理DU145细胞24,48,72 h后细胞存活率;与对照组比较,*P<0.05(n=3) |
JQ1促进DU145的凋亡,本实验中采用了JQ1浓度为10,20 μmol/L处理DU145细胞,48 h后收集细胞并用流式细胞仪分析周期,结果显示与对照组相比,JQ1处理过的DU145细胞株凋亡细胞明显增多,且随浓度增加而逐渐增多。差异有统计学意义(图 2A、2B)。

|
图 2 JQ1诱导前列腺癌细胞凋亡 A:流式细胞技术测定细胞凋亡;B:细胞凋亡的百分比数;与对照组比较, *P<0.05(n=3) |
为了验证JQ1对DU145细胞周期的影响,JQ1浓度为10,20 μmol/L处理DU145细胞,48 h后收集细胞并用流式细胞仪分析周期,结果(图 3A、3B)显示与对照组相比,JQ1处理过的DU145细胞株G0/G1期细胞比例明显增多,且随浓度增加而增多,提示JQ1阻滞细胞于G0/G1期,P < 0.05,差异有统计学意义。

|
图 3 JQ1阻滞前列腺癌细胞于G0/G1期 A:流式细胞技术测定细胞周期;B:细胞所处周期的百分比;与对照组比较,*P<0.05(n=3) |
验证JQ1是否对前列腺癌细胞的迁移能力有影响,浓度为20 μmol/L的JQ1处理DU145细胞株24 h,对照组采用DMSO处理24 h,结果(图 4)显示在不同的时间点,JQ1抑制DU145的迁移。

|
图 4 JQ1降低DU145的迁移能力 |
分别选取浓度为10,20 μmol/L的JQ1处理DU145细胞株,48 h后收集细胞并用Western blot法检测JQ1对C-MYC的表达量的影响。结果如图所示(图 5A、5B):经JQ1处理后的DU145细胞C-MYC表达量下降,并且随着JQ1浓度的增加蛋白表达量逐渐下降。
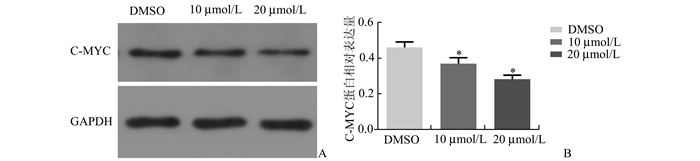
|
图 5 JQ1下调C-MYC蛋白表达量 A:Western Blot检测C-MYC表达量;B:C-MYC蛋白相对表达量;与对照组比较,*P<0.05(n=3) |
前列腺癌是一种异质性并在男性中高发的肿瘤,近年来,由于血清前列腺特异性抗原(PSA)以及Gleason评分等应用推广,使得早期前列腺癌检出率增加,然而晚期前列腺癌患者易发生转移并最终死亡[11]。目前对于晚期前列腺癌缺乏有效的根治疗法,许多文献证实BRD4抑制剂JQ1可以抑制肿瘤的发生发展。揭示JQ1在前列腺癌中的生物作用可能会为前列腺癌治疗提供一种新的治疗方式。
表观遗传调控近年来成为肿瘤研究的热点,肿瘤存在表观遗传调控异常逐渐得到证实。针对表观遗传调控药物已在临床实验应用并且非常有前景[12]。BET家族作为表观遗传识别蛋白通过结合组蛋白尾部赖氨酸、调控基因的表达参与细胞周期、细胞生长等一系列重要生物活动过程,并且与肿瘤的发生发展有关。JQ1与BRD4溴结构域相结合,使BRD4蛋白从染色质的乙酰化赖氨酸上置换下来,从而干扰BET蛋白的表达。此外,在细胞及动物实验中都证实JQ1可以通过C-MYC依赖途径和非C-MYC依赖途径产生抗肿瘤效应[13]。本研究结果表明随着JQ1浓度的增加,JQ1抑制前列腺癌细胞的增殖,并且随着作用时间的延长,前列腺癌细胞活性逐渐降低,证实JQ1可呈时间和浓度依赖的方式抑制前列腺癌细胞增殖。接着流式细胞技术检测JQ1对前列腺癌的作用,结果显示JQ1通过促进前列腺癌细胞凋亡,阻滞细胞于G0/G1期产生抗癌作用。
BET蛋白抑制剂抗癌效应的具体机制尚未完全揭示,目前较为明确的机制是JQ1可以调节C-MYC的表达。C-MYC影响着许多细胞生物学功能,包括细胞增殖、凋亡等。C-MYC表达的下调导致细胞增殖受到抑制,甚至诱导抗凋亡基因如Bcl-XL和Bcl-2表达的降低从而导致细胞凋亡增多[14, 15]。然而在有些肿瘤细胞中,JQ1通过非C-MYC途径产生抗癌效应[16]。本实验结果证实JQ1通过作用C-MYC达到抗前列腺癌的效应,并且随着浓度的增加,C-MYC表达量逐渐下降。提示了Q1在前列腺癌中抗癌效应可能与C-MYC表达减少有关。
综上所述,BRD4抑制剂JQ1抑制前列腺癌细胞增殖及迁移,促进前列腺癌细胞凋亡,阻滞细胞于G0/G1期,其机制与降低C-MYC的表达有关。
| [1] | Dy GW, Gore JL, Forouzanfar MH, et al. Global Burden of Urologic Cancers, 1990-2013[J]. Eur Urol, 2017, 71(3): 437-446. DOI: 10.1016/j.eururo.2016.10.008. |
| [2] | Wyatt AW, Gleave ME. Targeting the adaptive molecular landscape of castration-resistant prostate cancer[J]. EMBO Mol Med, 2015, 7(7): 878-894. DOI: 10.15252/emmm.201303701. |
| [3] | Hu Y, Zhou J, Ye F, et al. BRD4 inhibitor inhibits colorectal cancer growth and metastasis[J]. Int J Mol Sci, 2015, 16(1): 1928-1948. DOI: 10.3390/ijms16011928. |
| [4] | Filippakopoulos P, Knapp S. Targeting bromodomains: epigenetic readers of lysine acetylation[J]. Nat Rev Drug Discov, 2014, 13(5): 337-356. DOI: 10.1038/nrd4286. |
| [5] | Matzuk MM, McKeown MR, Filippakopoulos P, et al. Small-molecule inhibition of BRDT for male contraception[J]. Cell, 2012, 150(4): 673-684. DOI: 10.1016/j.cell.2012.06.045. |
| [6] | Li GQ, Guo WZ, Zhang Y, et al. Suppression of BRD4 inhibits human hepatocellular carcinoma by repressing MYC and enhancing BIM expression[J]. Oncotarget, 2016, 7(3): 2462-2474. |
| [7] | Wu X, Liu D, Gao X, et al. Inhibition of BRD4 Suppresses Cell Proliferation and Induces Apoptosis in Renal Cell Carcinoma[J]. Cell Physiol Biochem, 2017, 41(5): 1947-1956. DOI: 10.1159/000472407. |
| [8] | Ferri E, Petosa C, McKenna CE. Bromodomains: Structure, function and pharmacology of inhibition[J]. Biochem Pharmacol, 2016, 106: 1-18. DOI: 10.1016/j.bcp.2015.12.005. |
| [9] | Jung M, Gelato KA, Fernandez-Montalvan A, et al. Targeting BET bromodomains for cancer treatment[J]. Epigenomics, 2015, 7(3): 487-501. DOI: 10.2217/epi.14.91. |
| [10] | Vyas AR, Moura MB, Hahm ER, et al. Sulforaphane Inhibits c-Myc-Mediated Prostate Cancer Stem-Like Traits[J]. J Cell Biochem, 2016, 117(11): 2482-2495. DOI: 10.1002/jcb.v117.11. |
| [11] | Huang L, Chen K, Cai ZP, et al. DEPDC1 promotes cell proliferation and tumor growth via activation of E2F signaling in prostate cancer[J]. Biochem Biophys Res Commun, 2017, 490(3): 707-712. DOI: 10.1016/j.bbrc.2017.06.105. |
| [12] | Gaddis M, Gerrard D, Frietze S, et al. Altering cancer transcriptomes using epigenomic inhibitors[J]. Epigenetics Chromatin, 2015, 8: 9. DOI: 10.1186/1756-8935-8-9. |
| [13] | Kanno T, Kanno Y, LeRoy G, et al. BRD4 assists elongation of both coding and enhancer RNAs by interacting with acetylated histones[J]. Nat Struct Mol Biol, 2014, 21(12): 1047-1057. DOI: 10.1038/nsmb.2912. |
| [14] | Mertz JA, Conery AR, Bryant BM, et al. Targeting MYC dependence in cancer by inhibiting BET bromodomains[J]. Proc Natl Acad Sci U S A, 2011, 108(40): 16669-16674. DOI: 10.1073/pnas.1108190108. |
| [15] | Kelly PN, Grabow S, Delbridge AR, et al. Endogenous Bcl-xL is essential for Myc-driven lymphomagenesis in mice[J]. Blood, 2011, 118(24): 6380-3686. DOI: 10.1182/blood-2011-07-367672. |
| [16] | Baker EK, Taylor S, Gupte A, et al. BET inhibitors induce apoptosis through a MYC independent mechanism and synergise with CDK inhibitors to kill osteosarcoma cells[J]. Sci Rep, 2015, 5: 10120. DOI: 10.1038/srep10120. |
 2018, Vol. 39
2018, Vol. 39


