2. 长江大学文理学院 湖北 荆州 434023;
3. 湖北省鄂州市中医院公共卫生科 湖北 鄂州 436000
2. Yangtze University College of Arts and Sciences, Jingzhou 434023, Hubei, China;
3. Ezhou Hospital of Traditional Chinese Medicine, EZhou 436000, Hubei, China
沙利度胺(反应停, thalidomide, THD)在临床上治疗难治性、复发性、多发性骨髓瘤(multiple myeloma, MM)已取得良好的疗效[1], 正在开展的Ⅱ、Ⅲ期临床试验显示沙利度胺对某些实体瘤也有一定效果[2]。沙利度胺通过靶向抑制肿瘤细胞内血管生成[3],促进肿瘤细胞凋亡效应,已经得到证实,但有关沙利度胺是否诱导结直肠癌细胞自噬发生及其作用机制,目前国内外尚未见报道。细胞自噬作为细胞生存的一种机制在很多生理、病理过程中发挥着重要作用,化疗药物或靶向药物在抗瘤过程中可能引发肿瘤细胞的自噬反应,而这种自噬反应往往促进肿瘤细胞存活和导致药物抵抗[4],抑制自噬则能提高肿瘤细胞对药物的敏感性,增强治疗效果。因此,自噬靶向策略可能会成为肿瘤治疗的重要辅助手段。
1 材料与方法 1.1 细胞培养结直肠癌细胞系HCT116由华中科技大学同济医学院馈赠。HCT116细胞培养于含有10%胎牛血清、100 U/ml青霉素、100 μg/ml链霉素的DMEM培养液中,置于含5%CO2、37 ℃的培养箱中,2-3 d换液传代一次。
1.2 沙利度胺诱导结直肠癌细胞自噬情况检测 1.2.1 利用外源性转染GFP-LC3后,沙利度胺诱导结直肠癌细胞内自噬斑形成情况培养结直肠癌细胞系HCT116,通过转染外源性GFP-LC3质粒,设立实验组和对照组(实验组利用不同浓度的沙利度胺处理结直肠癌细胞,对照组用DMSO处理),在荧光显微镜下观察胞内自噬斑形成情况。
1.2.2 利用免疫印迹法检测沙利度胺诱导HCT116内LC3-Ⅱ转化生成情况培养结直肠癌细胞HCT116,利用不同浓度的沙利度胺处理结直肠癌细胞24 h (HCT116细胞分别用0,50, 100及150 μg/L沙利度胺处理),收集细胞,利用免疫印迹法检测HCT116细胞内LC3-Ⅱ转化生成情况。
1.3 抑制细胞自噬,检测沙利度胺抗瘤效应 1.3.1 3-MA抑制沙利度胺诱导结直肠癌细胞产生的细胞自噬后,利用MTT实验检测沙利度胺诱导HCT116细胞增殖抑制情况培养结直肠癌细胞系HCT116,分别用沙利度胺(100 μg/L)、沙利度胺(100 μg/L)+ 3-MA处理HCT116细胞24 h后,用MTT法检测细胞增殖情况。
1.3.2 3-MA抑制沙利度胺诱导结直肠癌细胞产生的细胞自噬后,利用TUNEL实验检测沙利度胺诱导HCT116细胞凋亡情况培养结直肠癌细胞系HCT116,设立对照组(Control组、3-MA组、100 μg/L沙利度胺组)和实验组(3-MA+100 μg/L沙利度胺组), 分别加药后,细胞继续培养24 h。按照TUNEL试剂盒的说明书分别处理对照组和实验组HCT116细胞,通过荧光显微镜分别检测HCT116细胞凋亡情况。
2 结果 2.1 沙利度胺诱导结直肠癌细胞自噬效应利用荧光显微镜观察显示(图 1),外源性转染GFP-LC3质粒进入HCT116结肠癌细胞后,沙利度胺诱导HCT116细胞胞内自噬斑形成较对照组明显增多。
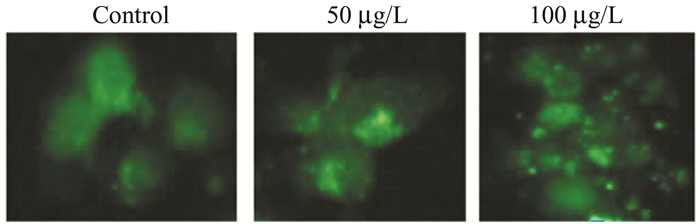
|
图 1 荧光显微镜下观察HCT116细胞中自噬斑形成情况 |
利用Western Blot检测结果显示沙利度胺诱导结直肠癌HCT116细胞内LC3-Ⅱ转化生成明显较对照组增多,且具有沙利度胺浓度依赖性(图 2)。以上结果表明沙利度胺可诱导结直肠癌细胞发生细胞自噬现象。
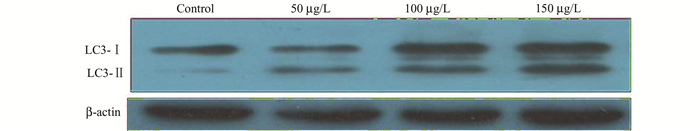
|
图 2 Western Blot检测结直肠癌细胞HCT116中LC3-Ⅱ转化生成情况 |
MTT实验结果显示,沙利度胺明显抑制结直肠癌细胞增殖,并具有剂量依赖性(图 3);利用3-MA抑制沙利度胺诱导结直肠癌细胞发生的自噬现象后,MTT实验显示沙利度胺明显增强结直肠癌细胞增殖抑制情况。
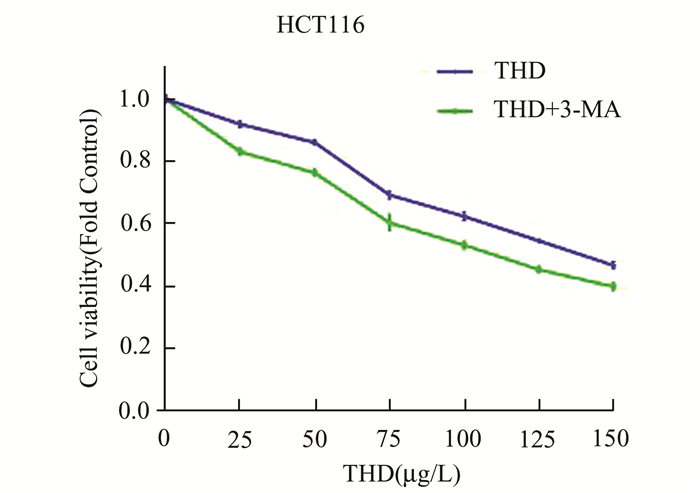
|
图 3 利用MTT法检测HCT116细胞增殖情况 |
TUNEL实验结果表明(图 4),通过3-MA抑制沙利度胺诱导的细胞自噬后,实验组(3-MA+沙利度胺组)能明显提高HCT116细胞凋亡率。本实验说明沙利度胺诱导的细胞自噬对其抗瘤效应起到拮抗作用,提示细胞自噬在沙利度胺抗结直肠癌过程中起到保护性效应。
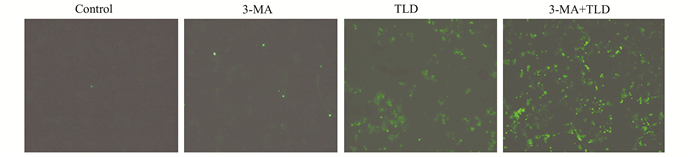
|
图 4 利用Dead EndTM TUNEL荧光检测试剂盒检测HCT116细胞凋亡情况 |
20世纪50年代, 沙利度胺作为一种镇静剂进入欧洲市场,然而因其致畸作用于1961年被停止使用。研究发现沙利度胺致畸的原因是其抑制血管生成所致, 也正是该作用使其具有了抗肿瘤潜能[5],沙利度胺正是通过靶向抑制肿瘤细胞内血管生成,促进肿瘤细胞凋亡效应。沙利度胺因其抗癌谱广、毒副作用小、价格便宜,是一种具有良好应用前景的靶向抗肿瘤药物,但沙利度胺的抗药性是目前研究的热点。据报道[4],许多化疗药物诱导肿瘤细胞发生的细胞自噬往往会促进肿瘤细胞存活,导致肿瘤细胞产生药物抵抗。据Das[6]等报道,细胞自噬可能是肿瘤细胞对化疗药物产生耐药的因素之一。但沙利度胺是否诱导结直肠癌细胞发生细胞自噬及诱导产生的细胞自噬是否为沙利度胺发生抗药的主要原因,目前国内外尚无报道。
细胞自噬是一种高度保守的代谢过程,在细胞的生理和病理过程中发挥着重要作用。细胞自噬与肿瘤的发生、发展关系密切,对化疗药物的抗瘤效应可起到促进或抑制的双重效应,但是不同的化疗药物、不同的肿瘤类型,细胞自噬的作用机制可能不同。本论文通过外源性转染GFP-LC3质粒后,荧光显微镜下观察到沙利度胺处理的结直肠癌HCT116细胞胞内自噬斑形成较对照组明显增多;Western Blot检测结果显示沙利度胺诱导结直肠癌细胞内LC3-Ⅱ转化生成明显较对照组增多。这些实验结果表明沙利度胺在抗结直肠癌细胞的同时诱导结直肠癌细胞发生细胞自噬。为阐明细胞自噬在沙利度胺抗结直肠癌过程中的作用机制,本论文分别利用MTT实验、TUNEL实验检测显示,细胞自噬抑制剂3-MA抑制结直肠癌细胞自噬后沙利度胺的抗瘤效应明显增强。综合上述实验结果显示,沙利度胺在抗癌过程中能同时诱导结直肠癌细胞发生细胞自噬和细胞凋亡,且沙利度胺诱导发生的细胞自噬拮抗其抗瘤效果,对结直肠癌细胞起到保护作用,说明细胞自噬可能与沙利度胺产生抗药性密切相关。
本论文阐明了细胞自噬在沙利度胺抗结直肠癌过程中的作用,为结直肠癌的治疗策略提供了新的思路。沙利度胺诱导的细胞自噬可能是其产生耐药的主要因素,抑制细胞自噬可加强沙利度胺的抗结直肠癌效果。本文的实验结果为提高沙利度胺的抗癌效果以及全新的联合治疗方案提供了理论基础及用药依据。
| [1] | Slawinska-Brych A, Zdzisinska B, Mizerska-Dudka M, et al. Induction of apoptosis in multiple myeloma cells by a statin-thalidomide combination can be enhanced by p38 MAPK inhibition[J]. Leuk Res, 2013, 37(5): 586-594. DOI: 10.1016/j.leukres.2013.01.022. |
| [2] | Young RJ, Tin AW, Brown NJ, et al. Analysis of circulating angiogenic biomarkers from patients in two phase Ⅲ trials in lung cancer of chemotherapy alone or chemotherapy and thalidomide[J]. Br J Cancer, 2012, 106(6): 1 153-1 159. DOI: 10.1038/bjc.2012.50. |
| [3] | El-Aarag BY, Kasai T, Zahran MA, et al. In vitro anti-proliferative and anti-angiogenic activities of thalidomide dithiocarbamate analogs[J]. Int Immunopharmacol, 2014, 21(2): 283-292. DOI: 10.1016/j.intimp.2014.05.007. |
| [4] | Bhardwaj M, Cho HJ, Paul S, et al. Vitexin induces apoptosis by suppressing autophagy in multi-drug resistant colorectal cancer cells[J]. Oncotarget, 2017, 9(3): 3 278-3 291. |
| [5] | Liu Q, Yin T, Wang G, et al. Vascular endothelial growth receptor 1 acts as a stress-associated protein in the therapeutic response to thalidomide[J]. Exp Ther Med, 2017, 14(5): 4 263-4 271. |
| [6] | Das CK, Linder B, Bonn F, et al. BAG3 overexpression and cytoprotective autophagy mediate apoptosis resistance in chemoresistant breast cancer cells[J]. Neoplasia, 2018, 20(3): 263-279. DOI: 10.1016/j.neo.2018.01.001. |
 2018, Vol. 39
2018, Vol. 39

