2. 发育源性疾病湖北省重点实验室 湖北 武汉 430071
2. Hubei Provincial Key Laboratory of Developmentaly Originated Disease, Wuhan 430071, China
环境内分泌干扰物如多氯联苯类(polychlorinated biphenyls,PCBs)与不孕的相关性是研究的热点[1]。胚胎着床失败是不孕的关键因素,表观遗传学被认为在胚胎发育中发挥重要作用[2]。近期,我们采用小鼠启动子区+CpG岛甲基化芯片(Nimblegen Mouse DNA Methylation 385K Promoter Plus CpG Island Array,瑞士Roche)筛选出孕前慢性PCB118暴露后小鼠着床期子宫内膜基因组中发生异常甲基化的启动子区,其中包括与胚胎着床相关的基因,如原钙黏蛋白PCDH17、整合素ITGB8、FRAS1相关的细胞外基质蛋白FREM2及纤维母细胞生长因子FGF4。本实验拟通过甲基化DNA免疫共沉淀-实时定量PCR(MeDIP-qPCR)进一步验证PCDH17、ITGB8、FREM2及FGF4基因的甲基化水平,同时利用Real-time PCR分析甲基化水平差异对其基因表达的影响。
1 材料与方法 1.1 实验动物及分组SPF级3周龄CD-1雌鼠40只(北京华阜康生物技术有限公司),适应性喂养1周后随机分为4组:PCB118大剂量组,中剂量组,小剂量组,空白对照组。每组10只。
1.2 实验动物模型构建及取材PCB118 (AccuStandard, USA)以芝麻油进行溶解稀释配制。适应性喂养后每日上午8点至9点实验组按小鼠体重依次以1, 10, 100 μg/kg PCB118进行灌胃,空白对照组灌以等体积的芝麻油。灌胃1个月后于晚17:00行雄雌小鼠2:1合笼,次日清晨8:00前检查雌鼠阴栓,见到阴栓记为妊娠第0.5天。于妊娠第4.5天经尾静脉行胎盘蓝染色鉴定胚胎着床模型,处死小鼠,留取子宫内膜标本。
1.3 MeDIP-qPCR验证特定基因的甲基化水平将每组小鼠子宫内膜样本分别进行混合,最终每组各混合成2个样本进行检测。采用DNA提取试剂盒DNeasy Blood & Tissue Kit(德国Qiagen公司)提取子宫内膜组织DNA,用超声破碎仪(比利时Diagenode公司)将基因组DNA打断成200-1 000 bp片段;取1 μg打断的DNA片段在95 ℃度加热10 min变性,将变性后的单链DNA样品分成两份,其中一份DNA样品加入鼠源性5′-甲基化胞嘧啶抗体(比利时Diagenode公司),并用标记有小鼠IgG的磁珠分离样品中甲基化DNA片段抗体复合物,即MeDIP DNA,另一份DNA样品作为Input。得到的MeDIP DNA采用MinElute columns(德国Qiagen公司)进行纯化。MeDIP DNA纯化后采用1 mmol/LTrisHCl(pH 8.0),5 mmol/L EDTA(pH 8.0) 和10%十二烷基磺酸钠(sodiumdodecyl sulfate,SDS)配制成的洗脱液;65 ℃洗脱15 min; 酚氯仿法提取MeDIP-DNA和实验参照DNA;用NanodropND-1000测定其质量和浓度。
根据甲基化芯片结果筛选出4个与生殖相关的差异基因PCDH21、ITGB8、FREM2、FGF4,利用Primer 5.0及beacon designer 7.0设计引物,引物序列见表 2, 我们分别选择GAPDH启动子和TSH2B的启动子作为阴性和阳性对照来控制MeDIP特异性。PCR反应使用SYBR Premix Ex TaqTM试剂盒按其说明书进行,反应条件如下:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。启动子甲基化水平计算公式如下:IP/Input =2-Ct×[Con (Input)/Con(IP)]=2-[Ct(IP)-Ct(Input)]×[Con(Input)/Con(IP)。
| 表 2 小鼠启动子区+CpG岛甲基化芯片筛选与细胞黏附相关的差异甲基化基因 |
利用Trizol法提取小鼠子宫内膜组织RNA,逆转录cDNA后根据SYBR Premix Ex TaqTM(Takara公司)试剂盒进行PCR反应如下:10 μl 2×SYBR Premix Ex Taq,0.4 μl上游引物(10 μmol/L),0.4 μl下游引物(10 μmol/L)0.4 μl,ROX Reference Dye Ⅱ,1 μl cDNA产物和7.8 μl双蒸水。反应条件如下:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环。引物序列见表 1。利用MX3 000 P PCR仪(Stratagene公司)进行PCR反应,数据采用2-△△CT法进行分析。
| 表 1 MeDIP-PCR及Real-time qPCR的引物序列 |
数据采用SPSS 19.0进行统计分析,组间比较采用ANOVA方差及t检验,P<0.05为差异有统计学意义。
2 结果 2.1 孕前PCB118慢性暴露胚胎着床模型鉴定合笼后,小鼠于孕4.5 d清晨自尾静脉注射台盼蓝,对着床位点进行染色鉴定胚胎着床模型。我们选取空白对照组小鼠进行鉴定,见图 1,证实我们的模型是构建成功的。
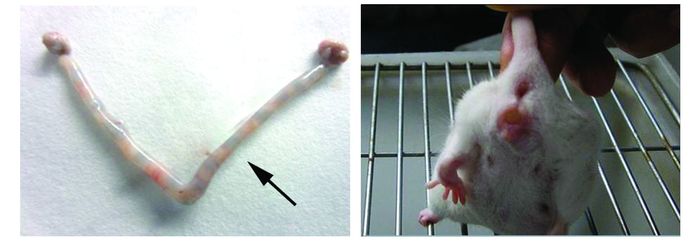
|
图 1 台盼蓝染色鉴定孕4.5 d小鼠胚胎着床情况(左)及孕0.5 d小鼠阴栓观察(右) 黑色箭头代表胚胎着床位点 |
将空白对照组及各剂量组提取的子宫内膜组织DNA进行Nanodrop检测,OD260/ OD280均大于1.8,DNA纯度高。琼脂糖凝胶电泳见图 2A,总DNA条带清晰,DNA完整度好,未有降解,可用于后续实验。进行MeDIP-PCR的DNA样本需要进行超声片段化处理,用Nanodrop检测,分析不同片段大小的DNA分布情况,通常标准的分布范围应该在200-1 000 bp。本实验中,超声后的DNA基本符合范围标准,见图 2B。

|
图 2 琼脂糖凝胶鉴定DNA质量 A:DNA完整性鉴定;B:超声后DNA片段化鉴定。条带从左到右依次为空白对照组(1-2);1 μg/kg PCB118暴露组(3-4);10 μg/kg PCB118暴露组(5-6),100 μg/kg PCB118暴露组(7-8) |
前期芯片结果根据peak length(>300)、peak score(>3) 在基因启动子区筛选出4个可信度高的差异甲基化基因PCDH17、ITGB8、FREM2及FGF4,见表 2。结果显示,空白对照组的启动子甲基化水平明显低于各剂量组(P<0.05),见表 3。挑选的差异甲基化基因的启动子甲基化变化趋势和前期芯片结果一致。
| 表 3 MeDIP-qPCR验证基因的甲基化水平 |
实时定量PCR结果显示,相对于空白对照组,PCDH17、ITGB8、FREM2及FGF4基因的mRNA表达在剂量组均明显下调(P<0.05),与甲基化水平呈负相关,见图 3。
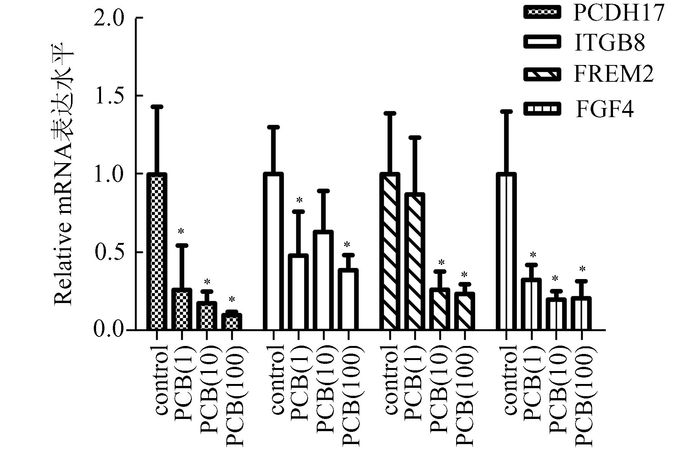
|
图 3 Real-time PCR检测PCDH17、ITGB8、FREM2、FGF4的mRNA表达水平 相对于空白对照组,*P<0.05 |
PCBs是最常见的环境内分泌干扰物之一,是一类以联苯为原料,在金属催化剂作用下形成的氯代芳烃化合物, 被作为变压器的冷却剂和润滑剂、阻燃剂及树脂、橡胶、涂料等的添加剂应用于电力电气、塑料加工和化工印刷等领域[3]。PCBs因其脂溶性、远处迁移性广泛存在于人类的生存环境中,并通过食物链在人体富集,发挥其毒性作用[4]。近些年来,流行病学调查发现,在人体血液、尿液,甚至在母体乳汁、羊水、胎儿脐带血中都可检测到PCBs的存在[5, 6]。大量数据显示PCBs与生殖不孕密切相关。尽管体外受精和胚胎移植技术在治疗不孕不育取得了一定的成功,但是胚胎植入成功率只有25%左右,其部分原因是子宫内膜处于一种不接受胚胎植入的状态[2]。王子一等研究[7]表明环境内分泌干扰物可干扰E-钙黏蛋白表达,引起MMP/TIMP表达失衡,进而影响子宫内膜增殖、凋亡等过程,具体机制不明。表观遗传机制如DNA甲基化与子宫内膜相关疾病的研究是关注热点。本课题组刘腾、李斐等研究[8, 9]提示DNA甲基化调控参与子宫内膜容受性建立的重要过程中。本实验前期研究提示PCB118慢性暴露可引起HOXA10基因启动子发生高甲基化,进而影响HOXA10、ITGB3等基因的表达,干扰子宫内膜容受性的建立。但同时实验表明,HOXA10启动子甲基化模式改变只是调控子宫内膜容受性的分子之一。子宫内膜容受性是一个极其复杂,涉及众多基因调控的过程,对该过程进行全基因组甲基化改变的分析研究具有重要意义。本次研究中我们建立PCB118慢性暴露孕鼠模型,从全基因组甲基化芯片角度对着床期子宫内膜组织进行基因启动子区甲基化筛选和分析,并从中挑选出4个特异基因进行验证和表达水平分析,为子宫内膜容受性的分子机制研究提供了新的思路和角度。
Jacinto等[10]于2008年报道了一种通过免疫沉淀捕获甲基化DNA的方法,其原理是利用5-甲基胞苷的多克隆抗体与甲基结合而使甲基化DNA沉淀。该方法结果可重复性高,价格便宜,得到了广泛应用。前期我们应用该方法免疫沉淀捕获甲基化DNA与高通量芯片进行杂交,检测了胚胎着床期整个基因组甲基化状态,本次试验我们选择MeDIP与qPCR结合的方法对芯片筛选出的特定基因进行甲基化水平检测。DNA超声片段化处理是MeDIP过程中的关键步骤,要求满足片段大小在200-2 000 bp范围内。本实验中,小鼠DNA超声后片段大小满足该要求,为后续试验数据可靠性提供了保障。
子宫内膜容受性建立与细胞分化、黏附、迁移相关。在本研究中,我们着重对与细胞黏附相关基因的启动子区DNA甲基化水平进行了筛选和验证,并从中筛选出原钙黏蛋白PCDH17、整合素ITGB8、FRAS1相关的细胞外基质蛋白FREM2、纤维母细胞生长因子FGF4。通过MeDIP-PCR验证显示,相对于空白对照组,上述基因的DNA甲基化水平在剂量组明显升高(P<0.05)。PCDH17是一种钙依赖性跨膜蛋白,研究报道[11]PCDH17是一个肿瘤特异性的肿瘤抑制因子,PCDH17高甲基化与泌尿系肿瘤密切相关,其参与细胞黏附、信号转导和生长调控。ITGB8是一种氨基酸多肽,研究[12, 13]证实它可以调控血管生成、系膜细胞分化、细胞-基质的黏附和迁移。FREM2是一种细胞外基质蛋白,它主要参与维持包膜的稳定,促进胚胎发育过程中上皮细胞与间质细胞的结合[14];FGF4是由胚胎外胚层产生的纤维母细胞生长因子,研究发现[15, 16]它参与调控胚胎发育过程中内胚层与外胚层的比例,并调节着床过程中外胚层与滋养层细胞的对话。可见这4个基因均可能参与到生殖发育、胚胎着床的过程中。而Real-time PCR结果显示以上4个基因在PCB118暴露后其mRNA表达量是下调的,与甲基化程度呈负相关。这一方面表明了PCB118慢性暴露引起了特定基因的高甲基化,诱导了基因表达沉默,另一方面也显示PCB118慢性暴露有引起胚胎着床受损、生殖功能下调的可能,PCDH17高甲基化亦有早期肿瘤触发的可能性。这些或许是解释慢性PCB118暴露致疾病发生的原因。
综上所述,PCBs作为环境内分泌干扰物,通过一系列复杂的途径影响了子宫内膜容受期DNA甲基化水平。胚胎着床过程并不是单一分子的作用事件,而是由一系列分子通过相互协调作用,构建信号网络来完成的。其中涉及复杂调控网络的变化,具体机制仍待进一步研究。
| [1] | Gregoraszczuk EL, Ptak A. Endocrine-Disrupting Chemicals: Some Actions of POPs on Female Reproduction[J]. Int J Endocrinol, 2013, 2013: 828532. |
| [2] | Singh M, Chaudhry P, Asselin E. Bridging endometrial receptivity and implantation: network of hormones, cytokines, and growth factors[J]. J Endocrinol, 2011, 210(1): 5-14. DOI: 10.1530/JOE-10-0461. |
| [3] | Barrett JR. PCBs may impede IVF success: failed embryo implantation linked to exposure[J]. Environ Health Perspect, 2011, 119(7): A307. |
| [4] | Crinnion WJ. Polychlorinated biphenyls: persistent pollutants with immunological, neurological, and endocrinological consequences[J]. Alternative Medicine Review: A Journal of Clinical Therapeutic, 2011, 16(1): 5-13. |
| [5] | Suzuki G, Nakano M, Nakano S. Distribution of PCDDs/PCDFs and Co-PCBs in human maternal blood, cord blood, placenta, milk, and adipose tissue: dioxins showing high toxic equivalency factor accumulate in the placenta[J]. Biosci Biotechnol Biochem, 2005, 69(10): 1836-1847. DOI: 10.1271/bbb.69.1836. |
| [6] | Nomiyama K, Yonehara T, Yonemura S, et al. Determination and characterization of hydroxylated polychlorinated biphenyls (OH-PCBs) in serum and adipose tissue of Japanese women diagnosed with breast cancer[J]. Environ Sci Technol, 2010, 44(8): 2890-2896. DOI: 10.1021/es9012432. |
| [7] | Wang ZY, Lu J, Zhang YZ, et al. Effect of Bisphenol A on invasion ability of human trophoblastic cell line BeWo[J]. International Journal of Clinical & Experimental Pathology, 2015, 8(11): 14355-14364. |
| [8] |
刘腾, 瞿鑫兰, 王子一, 等. 多氯联苯暴露对着床期子宫内膜组织中组蛋白甲基化转移酶的影响[J].
武汉大学学报:医学版, 2015, 36(6): 849-852.
Liu T, Ju XL, Wang ZY, et al. Effect of Chronic Exposure to Polychlorinated Biphenyls on the Expression of Histone Methylation Transferase During Implantation Period in CD-1 Mice[J]. Medical Journal of Wuhan University, 2015, 36(6): 849-852. |
| [9] | Li F, Zhang M, Zhang Y, et al. GnRH analogues may increase endometrial Hoxa10 promoter methylation and affect endometrial receptivity[J]. Molecular Medicine Reports, 2015, 11(1): 509-514. |
| [10] | Jacinto FV, Ballestar E, Esteller M. Methyl-DNA immunoprecipitation (MeDIP): hunting down the DNA methylome[J]. Biotechniques, 2008, 44(1): 35, 37, 39. |
| [11] | Wang XB, Lin YL, Li ZG, et al. Protocadherin 17 promoter methylation in tumour tissue from patients with bladder transitional cell carcinoma[J]. J Int Med Res, 2014, 42(2): 292-299. DOI: 10.1177/0300060513504364. |
| [12] | Lakhe-Reddy S, Khan S, Konieczkowski M, et al. Beta8 integrin binds Rho GDP dissociation inhibitor-1 and activates Rac1 to inhibit mesangial cell myofibroblast differentiation[J]. J Biol Chem, 2006, 281(28): 19688-19699. DOI: 10.1074/jbc.M601110200. |
| [13] | Xu Z, Wu R. Alteration in metastasis potential and gene expression in human lung cancer cell lines by ITGB8 silencing[J]. Anat Rec (Hoboken), 2012, 295(9): 1446-1454. DOI: 10.1002/ar.v295.9. |
| [14] | Pavlakis E, Chiotaki R, Chalepakis G. The role of Fras1/Frem proteins in the structure and function of basement membrane[J]. Int J Biochem Cell Biol, 2011, 43(4): 487-495. DOI: 10.1016/j.biocel.2010.12.016. |
| [15] | Krawchuk D, Honma-Yamanaka N, Anani S, et al. FGF4 is a limiting factor controlling the proportions of primitive endoderm and epiblast in the ICM of the mouse blastocyst[J]. Dev Biol, 2013, 384(1): 65-71. DOI: 10.1016/j.ydbio.2013.09.023. |
| [16] | Valdez MG, Rodriguez A, Zhang H, et al. Paracrine effects of embryo-derived FGF4 and BMP4 during pig trophoblast elongation[J]. Dev Biol, 2014, 387(1): 15-27. DOI: 10.1016/j.ydbio.2014.01.008. |
 2017, Vol. 38
2017, Vol. 38

