2. 华中科技大学附属梨园医院 湖北 武汉 430077
2. Liyuan Hospital, Huazhong University of Science and Technology, Wuhan 430077, China
植物药黄连的有效化学单体成分小檗碱(berberine, BBR)能较好地改善糖脂代谢紊乱,广泛用于临床治疗2型糖尿病,但由于其口服利用率低[1],不足以解释口服黄连类制剂吸收后的降糖调脂功效。小檗碱改善肠黏膜屏障功能可能是其治疗2型糖尿病及其并发症的一个有效环节。已有实验证明了脂多糖(lipopolysaccharide, LPS)能介导肠上皮细胞膜上TLR4和CD14表达来增加肠黏膜紧密连接通透性[2, 3]。但是从体外肠上皮细胞研究小檗碱对肠黏膜屏障的保护作用很少被报道。因此,我们提出假设:小檗碱能改善LPS引起的肠黏膜紧密连接通透性增加,是通过小檗碱增加肠上皮细胞间紧密连接蛋白的表达实现的,其作用机制可能与抑制TLR4,MyD88,NF-κB的激活相关。实验以caco-2细胞作为研究对象,以LPS作为损伤肠黏膜屏障的刺激因子,观察小檗碱对肠黏膜屏障损伤的修复作用及对其作用机制的初步探讨。
1 材料与方法 1.1 主要试剂DMEM高糖培养基、青链霉素、胰蛋白酶均购于武汉奥斯丹生物有限公司,胎牛血清、非必需氨基酸(NEEA)购于Gibco公司,蛋白裂解液、FITC-Dextran(4 kU)购于武汉谷歌生物有限公司,Hank's缓冲溶液、Cocktail均购于罗氏生物科技有限公司,BCA试剂盒购于碧云天生物技术公司,抗zo-1抗体(invitrogen)购于优宁维公司,抗occludin、claudin1、caspase12抗体购于美国Abcam公司,荧光标记的羊抗兔二抗购于Odyssey公司。
1.2 细胞培养caco-2细胞购于武汉大学细胞典藏中心,caco-2细胞(20-30代)生长在含有DMEM高糖培养基、10%FBS、1%非必须氨基酸(NEEA)、1%谷氨酰胺(Gln)和1%双抗的完全培养基中,在5%CO2、37 ℃条件下培养。将消化重悬后的caco-2细胞以1×105个/cm2种于24孔transwell小室内,上室下室分别加入100 μl含细胞的培养基和600 μl培养基,隔天换液,培养基替换成相同体积的Hank’s缓冲溶液,用EVOM电阻仪测量跨膜电阻TEER(每孔重复3次),当TEER稳定的达到250 Ω·cm2以上提示好的紧密连接单层形成。TEER(Ω·cm2)=(实验组电阻-空白孔电阻)×膜面积。
1.3 实验分组根据不同浓度的LPS(0-100 μg/ml)或BBR(0-80 μmol/L)对细胞的毒性检验,综合其对细胞紧密单层通透性的影响选择合适的药物浓度。实验分为三组:细胞正常培养组(Con组)、DMEM+10 μg/ml的LPS(实验组,LPS组)、DMEM+10 μg/ml的LPS+10 μmol/L的BBR(干预组,BBR组)。实验组中药物浓度均指终浓度,用DMEM稀释成相应的浓度。BBR组用20 μg/ml的LPS与20 μmol/L的BBR等体积混合,于24 h收样Western Blot检测zo-1、occludin、claudin1、TLR4、MyD88以及NF-κB等蛋白表达变化。于24 h在荧光显微镜下观察zo-1和claudin1的分布情况。
1.4 主要方法 1.4.1 药物对细胞的毒性检验caco-2细胞(20-30代)以1×104细胞/孔种于96孔板中,培养板中细胞回归正常形态后,加入DMEM培养基稀释的不同浓度LPS或者BBR作用24 h后(每个浓度设置6个复孔),每孔加入10 μl 5 mg/ml的MTT溶液,培养箱中孵育4 h,然后吸干净孔中的液体,每孔加入100 μl的DMSO后置于摇床上10 min,酶标仪在570 nm处测定吸光度(OD值)。
1.4.2 FITC-Dextran的透过率(Papp)当TEER≥250 Ω·cm2时,在transwell上室中加入配好的相应浓度的LPS或(和)BBR,下室加入完全培养基,作用24 h后用Hank’s缓冲溶液漂洗3次,上室中加入100 μl含1 mg/ml的FITC-Dextran(40 kU)的Hank’s缓冲溶液,下室中加600 μl Hank’s缓冲溶液,于37 ℃恒温培养箱中放置2 h,取下室中100 μl液体至96孔板中,于全能酶标仪上测定吸光度(激发波长480 nm,发射波长530 nm)。Papp=dQ/dt/AC(dQ是dt时间内FITC-dextran通过的量=浓度×体积;A指膜的面积(0.33 cm2); C指起始浓度1 mg/ml)。
1.4.3 Western Blot检测蛋白表达水平将培养瓶中细胞消化重悬后,以5×105/孔种于6孔板中,待细胞完全铺满时,药物刺激6孔板中的caco-2细胞相应时间,预冷的PBS漂洗2次,用ripe裂解液+cocktail(50:1)在冰上裂解细胞30 min后,细胞刮刀刮下贴壁的细胞,移取每孔中的细胞裂解物至1.5 ml EP管中,高速离心机中以12 000 r/min,4 ℃条件下离心15 min,吸取上清液,用BCA试剂盒检测蛋白浓度,蛋白液中加入loading buffer煮沸10 min,蛋白样品加入SDS-PAGE凝胶中电泳,然后转移至PVDF膜上,在5%的牛血清白蛋白(BSA)中封闭1 h,分别孵上兔抗zo-1、兔抗occludin、兔抗claudin1、兔抗TLR4、兔抗MyD88、兔抗NF-κB、兔抗caspase12、鼠抗tublin、兔抗GAPDH、兔抗actin抗体4 ℃过夜,膜上相应地孵上荧光标记的羊抗兔二抗、荧光标记的羊抗鼠二抗室温避光孵育1 h。每次抗体孵育后用TBST溶液洗涤3次,每次5 min。洗膜后于双色红外激光成像系统扫描。
1.4.4 免疫荧光检测caco-2细胞以3×104/孔均匀铺于24孔transwell小室中,至测量跨膜电阻直至达到250 Ω·cm2以上(3次重复测量),transwell上室中加入相应的药物作用24 h,设2个复孔及空白对照组。弃去培养基后用预冷的PBS漂洗2次,4%多聚甲醛固定10 min,0.3%triton-100常温透膜5-10 min,5%的TBST配制的BSA封闭1 h,去除封闭液后孵育兔抗zo-1抗体(1:50)、兔抗claudin1抗体(1:50)4 ℃过夜。1:500稀释的Dylight488标记的山羊抗兔抗体避光孵育1 h,DAPI染核10 min(每个步骤后均用PBS漂洗3次),置于荧光倒置显微镜下观察蛋白zo-1和claudin-1的表达分布情况。
1.5 统计学分析文中所有的计量资料用平均差±标准差表示,用SPSS 19.0进行统计学分析,图表用Graphpad Prism5制作。不同组之间的统计学比较用单因素ANOVA分析(两两之间的比较:方差齐用LSD检验,方差不齐用Dunnett’s检验),P<0.05或P<0.01表示有统计学差异。
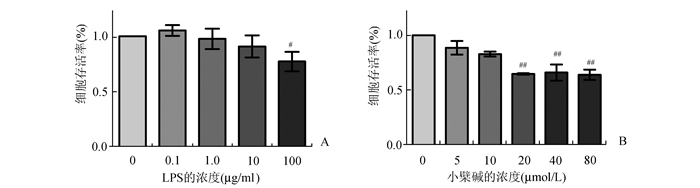
2 结果 2.1 LPS与小檗碱分别对caco-2细胞增殖的抑制作用100 μg/ml的LPS实验组与对照组(0 μg/ml)比较,细胞存活率明显下降(P<0.05),而0-10 μg/ml的LPS对caco-2细胞增殖无明显抑制作用(图 1A);0-10 μmol/L的小檗碱对caco-2细胞增殖无抑制作用(P>0.05),而10 μmol/L以上的小檗碱对caco-2细胞增殖有明显抑制作用(P<0.05)(图 1B)。
|
图 1 不同处理因素对caco-2细胞存活率的影响 不同浓度LPS对caco-2细胞存活率的影响;B:不同浓度的小檗碱对caco-2细胞存活率的影响,n=4-6(#P<0.05,与0 μmol/L组比较; ##P<0.01, 与0 μmol/L组比较) |
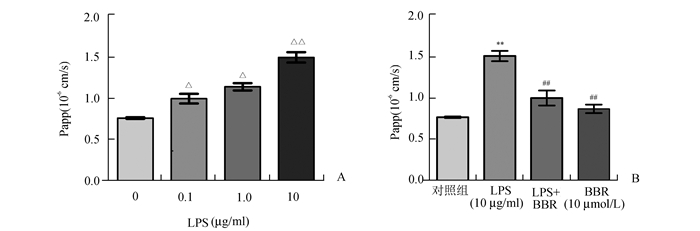
FITC-Dextran的透过率在LPS(0-10 μg/ml)范围内呈浓度依赖性增加,尤其是10 μg/ml的LPS使caco-2细胞紧密单层通透性达到最高,且与对照组比较有明显统计学差异(P<0.01)(图 2-A)。实验以10 μg/ml的LPS为模型组, LPS(10 μg/ml)+BBR(10 μmol/l)作为干预组,作用24 h后检测FITC-Dextran(40 kU)的透过率(Papp)的结果如图 2-B所示:与对照组比较,模型组通透性明显升高(P<0.01),而与模型组比较,小檗碱干预组通透性显著下降(P<0.01)。
|
图 2 不同处理因素对肠上皮通透性的影响 A:LPS对肠上皮通透性(Papp)的影响,随着LPS浓度的升高,Papp也逐渐增加。△P<0.05,与0 μmol/L组比较;△△P<0.01,与0 μmol/L组比较;B:小檗碱对肠上皮通透性(Papp)的影响,**P<0.01,与对照组比较;##P<0.01,与LPS组(10 μg/ml)比较 |
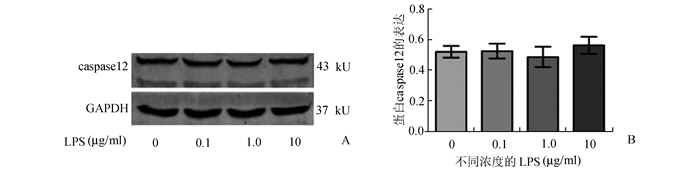
为了验证LPS诱导caco-2细胞紧密单层通透性升高是通过细胞旁路途径(紧密连接蛋白)而非跨细胞途径(细胞凋亡)引起,Western Blot检测0-10 μg/ml的LPS是否改变凋亡相关蛋白caspase12的表达。如图 3-A、B所示,0-10 μg/ml的LPS未能改变蛋白caspase12表达,差异无统计学意义(P>0.05),说明10 μg/ml浓度以下的LPS引起caco-2细胞紧密单层通透性增加与肠上皮细胞凋亡无关,仅由紧密连接异常所致。
|
图 3 不同浓度LPS对caspase 12表达的影响 浓度在0-10 μg/ml范围内的LPS对caspase 12表达无明显影响(P>0.05) |
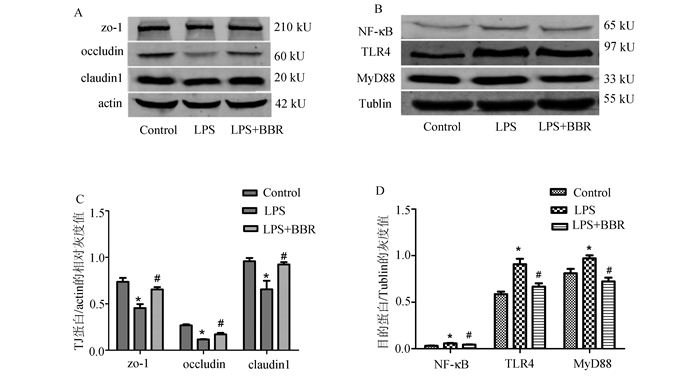
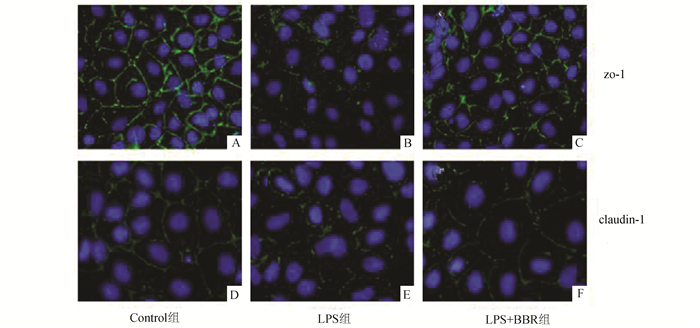
Western Blot检测结果如图 4-A、C所示:与对照组比较,LPS组紧密连接蛋白zo-1、occludin、claudin1的表达均减少,差异均有统计学意义(P<0.05);与LPS组比较,BBR干预组蛋白zo-1、occludin、claudin1的表达均有显著增加(P<0.05)。免疫荧光检测结果如图 5所示:对照组紧密连接蛋白zo-1和claudin1呈蜂窝状均匀分布在细胞膜上(图 5A、D);LPS组细胞膜上蛋白zo-1和claudin1表达明显减少,且有锯齿状断痕(图 5B、E);小檗碱干预组蛋白zo-1和claudin1表达均有所增加(图 5C、F)。
|
图 4 小檗碱对TJ蛋白(A、C)及TLR4、MyD88、NF-κB表达(B、D)的影响 *P<0.05,与对照组比较, #P<0.05,与LPS比较;n=3 |
|
图 5 BBR对LPS引起TJ蛋白zo-1和claudin1分布的影响(×400) |
LPS作用于caco-2细胞引起蛋白TLR4、MyD88、NF-κB表达增加,与对照组比较差异有统计学意义(P<0.05);而与模型组比较,小檗碱干预组蛋白TLR4、MyD88、NF-κB表达都显著下降(P<0.05)。
3 讨论植物药物黄连在我国应用于临床已有很长时间,从最早用于治疗肠道细菌感染到近年来用于2型糖尿病的治疗。小檗碱为黄连的有效单体成分,能有效提高外周组织对胰岛素的敏感性,改善肝脏、脂肪、肌肉等组织的胰岛素抵抗,还能从保护胰岛β细胞、促胰岛素分泌、增加胰岛素受体的表达、抗炎、抗氧化应激等多个方面发挥降糖调脂的作用,达到有效治疗2型糖尿病的作用[4]。对其药代动力学研究表明小檗碱的生物利用度极低,口服临床有效剂量的小檗碱进入血液中的浓度不足以达到实验中作用于胰岛素靶器官的药物浓度,这似乎不足以用上述机制来解释小檗碱治疗T2DM的有效性。这为小檗碱治疗T2DM的机制研究提供了新的思考方向:小檗碱可能直接作用于肠道发挥治疗T2DM的作用。
近年来,肠道菌群失调在肥胖和2型糖尿病中的作用受到医学界的高度重视[5, 6]。肠道菌群失调导致革兰阴性菌比例增加,肠道菌群失调不仅使产生内毒素(LPS)增加,还能直接破坏肠黏膜屏障,激活低度慢性炎症,促进胰岛素抵抗、β细胞分泌功能受损,进而引起或促进2型糖尿病的发生发展。同样在人体试验中用同位素探针51Cr-EDTA也证明了T2DM病人肠道通透性升高[7]。肠黏膜屏障是人体自身所有屏障中结构和功能最复杂的生理屏障,包含以肠上皮细胞及其紧密连接蛋白为主的机械屏障、以肠黏膜免疫为主的生化屏障和以肠道共生菌为主的生物屏障,而肠上皮细胞间紧密连接蛋白(TJ)由跨膜蛋白occludin,claudin,JAM(连接黏附分子)以及胞质支架蛋白zo-1,zo-2等组成。这些紧密连接蛋白封闭了上皮细胞间的旁路通道,提供了一个阻止病原微生物、内毒素以及其他抗原透过上皮层的生理屏障[8]。
代谢性内毒素血症可通过增加肠道通透性而引起糖尿病的发生,且LPS可能是引起肥胖、2型糖尿病等代谢疾病的触发因子[9]。所以本研究中以LPS作为诱导肠黏膜屏障损伤的刺激因子,caco-2细胞单层模拟完整的肠黏膜屏障。实验结果表明LPS能明显增加肠上皮通透性,减少了肠上皮细胞间紧密连接蛋白zo-1、occludin、claudin1的表达。肠上皮通透性主要由两条途径决定,即跨上皮途径和细胞旁路途径,前者与肠上皮细胞是否凋亡有关,后者受紧密连接蛋白的限制。实验中选用10 μg/ml的LPS作用于Caco-2细胞引起肠上皮通透性增加,却并未引起凋亡相关蛋白caspase12的表达变化,说明该浓度的LPS是通过细胞旁路途径(紧密连接)来影响肠上皮通透性的。而小檗碱干预组能显著降低肠黏膜通透性,明显改善了LPS引起的紧密连接蛋白表达减少的情况。这与动物实验中2型糖尿病大鼠肠道黏膜紧密连接蛋白表达减少,而小檗碱治疗组相比模型组蛋白zo-1、occludin、claudin1的表达明显增加的结果相吻合[10]。
小檗碱能调节肠道菌群,减少肠道内毒素入血从而改善代谢性炎症与胰岛素抵抗[11]。也有研究[12, 13]发现小檗碱能改善内毒素血症模型小鼠中肠上皮紧密连接损伤。我们的实验从体外模拟肠黏膜屏障研究小檗碱对其屏障损伤的修复作用,结果表明小檗碱通过增加肠上皮紧密连接蛋白的表达来改善肠黏膜损伤情况,LPS减少紧密连接蛋白表达与TLR4、MyD88、NF-κB信号通路蛋白的激活有关,这与以往实验中LPS通过TLR4-FAK-MyD88信号通路来调节紧密连接通透性的结果相一致[3]。小檗碱抑制了TLR4、MyD88、NF-κB信号通路蛋白的激活,保护肠上皮细胞间紧密连接蛋白结构不被破坏,增加了TJ蛋白的表达水平,可在一定程度上修复肠黏膜机械屏障功能障碍,避免了肠道细菌来源的内毒素(LPS)移位,TLR4/CD14的介导引起巨噬细胞释放更多的炎症因子,加重胰岛素抵抗的一个恶性循环的发生。因此小檗碱改善受损的肠黏膜屏障功能为小檗碱治疗2型糖尿病的机制研究提供了新的方向。
已有动物实验证实了小檗碱保护肠上皮屏障与其抑制NF-κB、MLCK(肌球蛋白轻链激酶)通路介导的TJ蛋白表达有关[12]。MLCK和磷酸化的MLC被激活后可引起周围骨架蛋白F-actin的重新分布,破坏肠上皮细胞间紧密连接蛋白的结构,通过影响肠上皮旁路途径使肠黏膜屏障受损,肠黏膜通透性增加[14]。免疫荧光检测可直接观察到LPS组紧密连接蛋白zo-1和claudin在细胞膜上的表达明显减少,且有锯齿状断痕,紧密连接被破坏,而小檗碱干预组看明显观察到断裂的紧密连接有所修复,这可能与小檗碱抑制了TLR4、MyD88、NF-κB信号通路蛋白的激活,抑制磷酸化的MLC被激活有密切关系。我们的实验从体外caco-2细胞研究小檗碱对LPS引起的肠黏膜屏障损伤修复作用及其机制探讨尚未见报道。综上所述,小檗碱干预组通过改善紧密连接蛋白的表达和分布从而降低肠黏膜通透性,阻止了肠腔内毒素及抗原透过黏膜屏障进入血液循环,避免更多的炎症因子释放导致胰岛素加重的状况。初步探讨其机制可能与小檗碱抑制了TLR4、MyD88、NF-κB信号通路蛋白的激活相关。但促炎因子与LPS影响紧密连接蛋白的表达和分布可通过肌球蛋白轻链激酶(MLCK)途径、丝裂原活化蛋白激酶(MAPK)和蛋白激酶C(PKC)等多条途径实现[15],而小檗碱抑制NF-κB p65的激活后通过上述哪条途径来改善紧密连接蛋白的表达有待下一步的研究。
| [1] | Chen W, Miao YQ, Fan DJ, et al. Bioavailability study of berberine and the enhancing effects of TPGS on intestinal absorption in rats[J]. AAPS PharmSciTech, 2011, 12(2): 705-711. DOI: 10.1208/s12249-011-9632-z. |
| [2] | Guo S, Al-Sadi R, Said H M, et al. Lipopolysaccharide causes an increase in intestinal tight junction permeability in vitro and in vivo by inducing enterocyte membrane expression and localization of TLR-4 and CD14[J]. Am J Pathol, 2013, 182(2): 375-387. DOI: 10.1016/j.ajpath.2012.10.014. |
| [3] | Guo S, Nighot M, Al-Sadi R, et al. Lipopolysaccharide regulation of intestinal tight junction permeability is mediated by TLR4 signal transduction pathway activation of FAK and MyD88[J]. J Immunol, 2015, 195(10): 4 999-5 010. DOI: 10.4049/jimmunol.1402598. |
| [4] | Dong H, Wang N, Zhao L, et al. Berberine in the Treatment of Type 2 Diabetes Mellitus: A Systemic Review and Meta-Analysis[J]. Evid Based Complement Alternat Med, 2012, 2012: 1-12. |
| [5] | Ridaura VK, Faith JJ, Rey FE, et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice[J]. Science, 2013, 341(6 150): 1 241 214. |
| [6] | Everard A, Cani PD. Diabetes, obesity and gut microbiota[J]. Best Pract Res Clin Gastroenterol, 2013, 27(1): 73-83. DOI: 10.1016/j.bpg.2013.03.007. |
| [7] | Horton F, Wright J, Smith L, et al. Increased intestinal permeability to oral chromium (51Cr)-EDTA in human Type 2 diabetes[J]. Diabetic Medicine, 2014, 31(5): 559-563. DOI: 10.1111/dme.2014.31.issue-5. |
| [8] | Fu Q, Wang H, Xia M, et al. The effect of phytic acid on tight junctions in the human intestinal Caco-2 cell line and its mechanism[J]. Eur J Pharm Sci, 2015, 80: 1-8. DOI: 10.1016/j.ejps.2015.09.009. |
| [9] | Pussinen PJ, Havulinna AS, Lehto M, et al. Endotoxemia is associated with an increased risk of incident diabetes[J]. Diabetes Care, 2011, 34(2): 392-397. DOI: 10.2337/dc10-1676. |
| [10] | Gong J, Hu M, Huang Z, et al. Berberine attenuates intestinal mucosal barrier dysfunction in type 2 diabetic rats[J]. Front Pharmacol, 2017, 8: 42. |
| [11] | Zhang X, Zhao Y, Xu J, et al. Modulation of gut microbiota by berberine and metformin during the treatment of high-fat diet-induced obesity in rats[J]. Sci Rep, 2015, 5: 14 405. DOI: 10.1038/srep14405. |
| [12] | Gu L, Li N, Gong J, et al. Berberine ameliorates intestinal epithelial tight-junction damage and down-regulates myosin light chain kinase pathways in a mouse model of endotoxinemia[J]. J Infect Dis, 2011, 203(11): 1 602-1 612. DOI: 10.1093/infdis/jir147. |
| [13] | Li HM, Wang YY, Wang HD, et al. Berberine protects against lipopolysaccharide-induced intestinal injury in mice via alpha 2 adrenoceptor-independent mechanisms[J]. Acta Pharmacol Sin, 2011, 32(11): 1 364-1 372. DOI: 10.1038/aps.2011.102. |
| [14] | Cao M, Wang P, Sun C, et al. Amelioration of IFN-gamma and TNF-alpha-induced intestinal epithelial barrier dysfunction by berberine via suppression of MLCK-MLC phosphorylation signaling pathway[J]. PLoS One, 2013, 8(5): e61944. DOI: 10.1371/journal.pone.0061944. |
| [15] | Gonzalez-Mariscal L, Tapia R, Chamorro D. Crosstalk of tight junction components with signaling pathways[J]. Biochim Biophys Acta, 2008, 1778(3): 729-756. DOI: 10.1016/j.bbamem.2007.08.018. |
 2018, Vol. 39
2018, Vol. 39


