2. 湖北省妇幼保健院整形美容外科 湖北 武汉 430070
2. Dept. of Plastic and Cosmetic Surgery, Hubei Maternal and Child Health Hospital, Wuhan 430070, China
近来研究发现低剂量外源性一氧化碳(carbon monoxide,CO)具有很好的减轻炎症、抗凋亡和调节免疫反应的作用,具有较大的临床应用前景[1]。一氧化碳释放分子-2(carbon monoxide-releasing molecule-2,CORM-2)是一种金属螯合物,在体内能迅速释放出可控量的CO。相比外源性吸入CO,CORM-2不改变循环中碳氧血红蛋白(COHb)水平,因而更加安全。本研究主要探讨CORM-2对小鼠肾脏缺血再灌注损伤的保护作用及其机制。
高迁移率核蛋白家族1(high-mobility group box 1,HMGB1)最初被发现存在于几乎所有真核细胞核中的一种DNA结合蛋白。HMGB1可以通过细胞受损被动释放或由免疫细胞主动分泌。研究发现HMGB1在炎症反应上游启动中起重要作用。当细胞受到损伤刺激后,HMGB1迅速从细胞核释放到细胞质、循环中,启动炎症反应,是一种“危险”信号。HMGB1迁移释放在器官的缺血再灌注损伤(IRI)中发挥重要作用[2, 3]。
据报道,在肾脏的缺血再灌注损伤中,HMGB1迅速从肾脏肾小管、间质毛细血管及肾小球等部位大量释放,启动早期炎症反应,诱发肾脏实质细胞的凋亡坏死导致缺血再灌注损伤(ischemia-reperfusion injury, IRI),采用HMGB1中和抗体,可以明显减轻这一缺血再灌注损伤[4]。HMGB1迁移释放在器官的IRI的启动中发挥重要作用。本文主要研究CORM-2对肾脏缺血再灌注损伤发挥的保护作用,探讨CORM-2的保护效应与HMGB1的关系。
1 材料与方法 1.1 实验动物与试剂 1.1.1 动物无特定病原体级(specific pathogen free,SPF)BALB/c小鼠,雄性,8周龄,购于斯莱克实验动物有限公司。饲养于武汉大学第一临床学院实验动物中心,标准SPF级实验动物饲养环境下饲养。
1.1.2 试剂CORM-2{[Ru(CO)3Cl2]2; MW=521.02 g/mol}(Sigma-Aldrich);用DMSO溶解CORM-2成质量浓度为20 mg/ml溶液,然后生理盐水稀释,于术前1 h以20 mg/kg剂量给予小鼠尾静脉注射。失活一氧化碳释放分子(inactive CORM-2,iCORM-2)为溶解稀释后的CORM-2常温放置24 h,待一氧化碳分子分解释放,于术前1 h按20 mg/kg剂量给予小鼠尾静脉注射;重组高迁移率族蛋白1(rHMGB1)(Sigma-Aldrich);小鼠高迁移率族蛋白(mouse HMGB1)ELISA试剂盒(上海西唐生物科技有限公司)。
1.2 建立小鼠单侧肾缺血再灌注模型及分组 1.2.1 制备模型小鼠经戊巴比妥钠腹腔注射麻醉,行腹部正中切口,暴露小鼠左侧肾脏,分离左肾肾蒂,用无损伤显微血管夹夹住左肾动静脉,阻断左肾血流,置于32 ℃温箱中,左侧肾脏热缺血50 min,然后松开左肾血管夹,恢复左肾血液灌注,同时切除小鼠右侧肾脏,最后缝合腹部切口肌层和皮肤。
1.2.2 实验分组假手术组(Sham):除了不阻断小鼠左肾血流外,其余与小鼠肾缺血再灌注模型手术操作相同;IRI组:小鼠行肾缺血再灌注损伤实验;iCORM-2组:术前1 h静脉给予iCORM-2,然后行肾缺血再灌注损伤实验;CORM-2组:术前1 h静脉给予CORM-2,然后行肾缺血再灌注损伤实验;rHMGB1组:术前1 h静脉给予CORM-2,经历肾缺血后,再灌注时腹腔注射20 μg rHMGB1。
1.3 检测指标 1.3.1 血肌酐和尿素氮水平检测小鼠经历热缺血再灌注损伤后,取肾脏再灌注24 h后的小鼠下腔静脉全血血浆,通过罗氏自动生化检测分析仪检测肌酐和尿素氮,依据肌酐和尿素氮水平评价肾脏功能。
1.3.2 病理检测取小鼠肾脏缺血再灌注后的肾脏标本,置于4%多聚甲醛固定24 h,取适量组织标本经脱水后石蜡包埋,将石蜡包埋后的组织制成5 μm石蜡切片。切片经脱蜡水化,分别用苏木素和伊红染色,然后脱水透明,中性树脂封片,显微镜下观察并评价肾脏组织损伤情况。
1.3.3 血浆HMGB1 ELISA检测采用小鼠HMGB1 ELISA检测试剂盒,按照试剂盒操作说明书,设置标准品孔、样本孔和空白孔,对待测小鼠血浆样本进行检测,最后在450 nm波长处测定各检测孔的OD值,计算出各血浆样本HMGB1浓度。
1.4 统计学分析采用GraphPad Prism 5.0统计学软件对实验资料进行处理分析,结果以平均数±标准差(x±s)表示,运用独立t检验进行均数比较,P<0.05为差异有统计学意义。
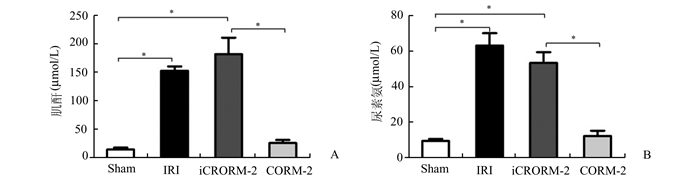
2 结果 2.1 CORM-2对小鼠肾脏缺血再灌注损伤的保护作用小鼠肾脏经历50 min热缺血后,取小鼠肾脏再灌注24 h后的全血血浆,检测肌酐和尿毒氮水平评价其肾功能情况。小鼠肾脏经历热缺血50 min再灌注24 h,血浆肌酐和尿素氮均明显升高,肾功能发生显著损害(IRI组vs Sham组,P < 0.05)。缺血前1 h静脉给予iCORM-2治疗,无明显减轻肾脏的缺血再灌注损伤程度(iCORM-2组vs Sham组,P < 0.05)。然而,于缺血前1 h静脉给予CORM-2治疗,小鼠肾脏经历缺血再灌注损伤后,血浆肌酐和尿毒氮水平升高水平明显减低,与假手术组相比无显著差异(CORM-2 vs Sham组,P>0.05),与IRI组、iCORM-2组相比有显著差异(CORM-2 vs IRI组、iCORM-2组,P < 0.05)(见图 1A,B)。研究表明CORM-2预处理可以显著减轻小鼠肾脏缺血再灌注损伤。
|
图 1 小鼠血浆肌酐(A)和尿素氮(B)水平检测 小鼠经历50 min肾脏热缺血再灌注24 h后血浆肌酐(A)和尿素氮(B)水平显著升高;*P<0.05 |
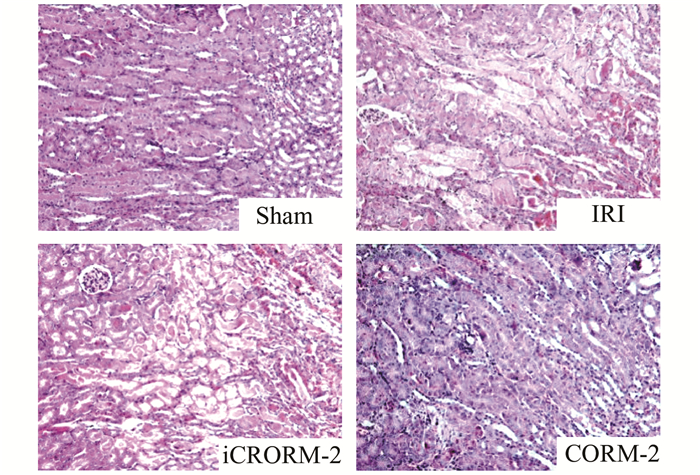
取小鼠肾脏经历热缺血50 min再灌注24 h后的肾脏标本,通过病理HE染色进一步评估肾脏组织损伤程度。研究发现IRI和iCORM-2组肾脏组织皮髓质区出现广泛肾小管坏死、肾小管上皮细胞凋亡脱落,肾脏组织结构遭到破坏严重,同时肾脏组织有广泛出血和炎性细胞浸润。然而,经过CORM-2预处理,CORM-2组小鼠肾脏小管结构完整,肾小管上皮细胞轻度变性,少许肾小管坏死,损伤程度较IRI和iCORM-2组明显减低(见图 2)。通过病理医师对组织标本在肾小管坏死和间质出血方面作半定量评价,光镜下随机选取10个高倍视野(×400),对阳性面积进行评价。分级评分标准:0,< 10%;1,≥10%, < 25%;2,≥25%, < 50%;3,≥50%, < 75%;4,75%-100%(见表 1)。经CORM-2(20 mg/kg)治疗后,其肾小管坏死和间质出血显著减轻,与IRI组、iCORM-2组相比有显著差异(P < 0.05)(见表 1)。
|
图 2 小鼠肾脏热缺血50 min再灌注24 h后HE染色照片及肾脏小管坏死及间质出血等级评分(HE×200) |
| 表 1 肾小管坏死及间质出血情况比较 |
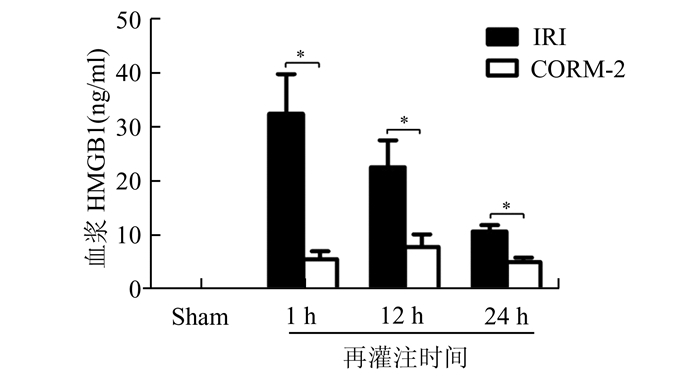
取小鼠肾脏缺血再灌注损伤后1, 12, 24 h的全血血浆,通过ELISA方法检测血浆中HMGB1水平变化情况。我们发现假手术组小鼠血浆中HMGB1为阴性,而在肾脏经历热缺血50 min再灌注1 h的小鼠血浆中,HMGB1水平迅速升高,肾脏中HMGB1迅速从胞核释放至血液循环中(见图 3)。给予CORM-2预处理后可以显著降低小鼠血浆HMGB1水平(CORM-2 vs IRI组,P < 0.05),起到减轻肾脏缺血再灌注损伤的作用。对肾脏缺血再灌注不同时间点的血浆HMGB1水平检测,血浆HMGB1水平在再灌注1 h达到高峰,并逐步下降,表明炎症因子HMGB1在缺血再灌注损伤早期即发生迁移改变,在缺血再灌注损伤炎症反应上游起到早期启动并放大炎症反应的作用。
|
图 3 ELISA检测血浆中HMGB1水平 *P < 0.05 |
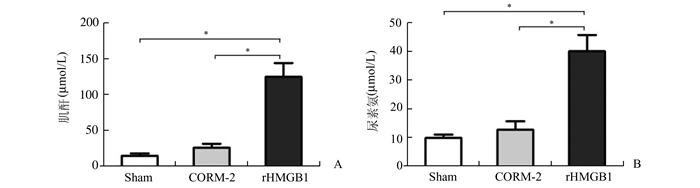
肾脏缺血前1 h给予CORM-2治疗,小鼠肾脏经历热缺血后血浆中HMGB1释放得到明显抑制,并显著减轻了肾脏缺血再灌注损伤(CORM-2 vs IRI,P < 0.05)。然而,CORM-2治疗组的小鼠肾脏经历热缺血损伤后,立即通过小鼠腹腔输注rHMGB1 20 μg,然后取小鼠肾脏再灌注24 h后的全血血浆,检测发现血浆肌酐和尿毒氮水平仍显著升高(rHMGB1组vs sham组、CORM-2组,P < 0.05)。研究表明在肾脏的缺血再灌注损伤中,输注外源性rHMGB1显著减弱了CORM-2的保护作用。
|
图 4 小鼠血浆肌酐和尿素氮水平检测 rHMGB组血浆肌酐(A)和尿素氮(B)水平显著升高; rHMGB1组vs sham组、CORM-2组,*P < 0.05 |
HMGB1是一种在有核细胞胞内均广泛存在高度保守的DNA结合蛋白,主要存在于细胞核内,具有调节基因转录和表达等多种重要功能,HMGB1敲除的小鼠将出现转录调控缺陷而无法生存[5]。长期以来人们仅仅了解HMGB1的核内功能,但近年来研究发现,HMGB1是机体识别损伤、启动修复的非常重要的内源性“危险信号分子”,一旦被释放到胞外,则是一种强大的致炎及趋化细胞因子。当细胞坏死或受损时,核内的HMGB1被动释放至胞外,或由活化的免疫细胞主动分泌至胞核外[6, 7]。胞核外HMGB1通过与其受体TLR-2/4或RAGE结合,激活免疫反应和炎症反应,释放促炎因子,而促炎因子和HMGB1又进一步促进HMGB1的分泌,形成一个正反馈效应,使炎症反应放大。在动物的肾脏、肝脏和心脏等的IRI研究中,也证实HMGB1作为早期的炎性介质介导了器官缺血再灌注的炎症反应和损伤[8]。应用抗HMGB1抗体中和胞外的HMGB1可以显著减轻器官的IRI程度,发挥很好的保护效应。以上研究均提示,HMGB1可能在IRI的早期启动、发生和发展中均发挥重要作用。
立足前期研究发现CORM-2能显著减轻肾脏缺血再灌注损伤,发挥显著的器官保护作用。除此以外,我们还进行了CORM-2的保护效应与HMGB1的关系的研究。我们发现在小鼠的肾脏缺血再灌注损伤模型中,肾脏缺血早期大量HMGB1即由核内释放至胞外启动并放大炎症效应,导致严重的器官缺血再灌注损伤,应用CORM-2可以显著减轻小鼠肾脏缺血再灌注损伤并能有效地阻断核内HMGB1向核外迁移释放,抑制了严重的炎症损伤,从而实现了显著保护效应。
为进一步研究缺血再灌注过程中HMGB1发挥的损伤效应,通过ELISA技术对肾脏缺血再灌注不同时间点的血浆HMGB1水平检测进行监测。我们发现血浆HMGB1水平在肾脏再灌注1 h达到高峰,并逐步下降,实验表明炎症因子HMGB1在缺血再灌注损伤早期即发生迁移释放,在缺血再灌注损伤炎症反应上游起到早期启动并放大炎症反应的作用。进一步研究发现,CORM-2提前干预可以显著抑制缺血再灌注过程中炎症因子HMGB1的迁移释放,对CORM-2实验组总肾脏缺血再灌注不同时间点的血浆HMGB1水平检测,发现HMGB1水平得到有效控制,没有明显升高,这一研究结果与CORM-2肾功能的保护效应一致。我们可以得出CORM-2抑制肾脏缺血再灌注损伤中HMGB1迁移释放发挥保护效应。
为了进一步验证CORM-2在肾脏缺血再灌注损伤中发挥的保护效应与HMGB1相关,我们采用小鼠腹腔输注补充炎症因子拮抗CORM-2的作用。在CORM-2治疗组的小鼠肾脏经历热缺血后,通过腹腔输注r-HMGB1补充释放出的HMGB1,检测缺血再灌注24 h后的血浆肌酐和尿毒氮水平评价其肾功能情况,研究显示输注外源性rHMGB1显著逆转了CORM-2的保护作用。进一步说明,HMGB1在肾脏缺血再灌注损伤中发挥重要作用,而CORM-2发挥的保护效应与HMGB1直接相关。
综上所述,在肾脏缺血再灌注损伤过程中,CORM-2有效阻断了HMGB1迁移释放抑制炎症反应,减轻缺血再灌注损伤发挥保护效应。
| [1] | Otterbein LE, Bach FH, Alam J, et al. Carbon monoxide has anti-inflammatory effects involving the mitogen-activated protein kinase pathway[J]. Nat Med, 2000, 6(4): 422-428. DOI: 10.1038/74680. |
| [2] | Rabadi MM, Kuo MC, Ghaly Y, et al. Interaction between uric acid and HMGB1 translocation and release from endothelial cells[J]. Am J Physiol Renal Physiol, 2012, 302(6): F730-F741. DOI: 10.1152/ajprenal.00520.2011. |
| [3] | Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation[J]. Nature, 2002, 418(7 315): 622. |
| [4] | Li J, Gong Q, Zhong S, et al. Neutralization of the extracellular HMGB1 released by ischaemic damaged renal cells protects against renal ischaemia-reperfusion injury[J]. Nephrol Dial Transplant, 2011, 26(2): 469-478. DOI: 10.1093/ndt/gfq466. |
| [5] | Calogero S, Grassi F, Aguzzi A, et al. The lack of chromosomal protein Hmg1 does not disrupt cell growth but causes lethal hypoglycaemia in newborn mice[J]. Nat Genet, 1999, 22(3): 276-280. DOI: 10.1038/10338. |
| [6] | Lu B, Nakamura T, Inouye K, et al. Novel role of PKR in inflammasome activation and HMGB1 release[J]. Nature, 2012, 488(7413): 670-674. DOI: 10.1038/nature11290. |
| [7] |
周文海, 李建国. MiR205在脓毒症小鼠心脑肾中对HMGB1表达的影响[J].
武汉大学学报:医学版, 2017, 38(3): 350-353.
Zhou WH, Li JG. Influence of miR205 on HMGB1 in the Brains, Hearts and Kidneys of Mice with Sepsis[J]. Medical Journal of Wuhan University, 2017, 38(3): 350-353. |
| [8] | Zhang J, Xia J, Zhang Y, et al. HMGB1-TLR4 signaling participates in renal ischemia reperfusion of the ERK/NF-B pathway[J]. Am J Transl Res, 2016, 8(10): 4 054-4067. |
 2018, Vol. 39
2018, Vol. 39


