脓毒症是指针对感染的失控宿主反应所致的危及生命的器官功能障碍[1]。目前控制感染、液体复苏、器官支持已为脓毒症主要的治疗方案,脓毒症的死亡率也有所下降,但仍是重症监护室的主要死因之一,因此对其发病机制和新型治疗方案的研究十分迫切。越来越多研究表明炎症反应和血液凝固是两个相互重叠和交织在一起的过程[2]。在脓毒症时期两大系统都会被激活,并相互放大,失控的凝血反应会引起广泛的微血栓形成,组织器官缺血缺氧,加重组织器官损伤。严重的患者会发生弥漫性血管内凝血(disseminated intravascular coagulation,DIC),大量的促凝物质的消耗也会引发后期的出血症状。血小板除了我们熟知的凝血止血功能外,同时具有强大的免疫功能,由于其同时具备这两种功能,因此在脓毒症时期,可作为桥梁沟通二者,放大二者[3]。脓毒症患者常常伴随血小板减少,且血小板减少的程度与疾病的严重程度和预后密切相关[4]。目前已有越来越多的人致力于抗血小板治疗在脓毒症中应用的研究,研究结果众说纷纭。胆碱能抗炎通路(cholinergic anti-inflammatory pathway,CAP)[5]是拮抗全身炎性反应作用的通路,已有文献证实血小板上也存在α7亚基烟碱型乙酰胆碱受体(α7nΑCHRs)[6],从“用进废退”的进化论观点出发,血小板表达α7nΑCHRs的能力既然能够在进化中被保留下来,必然有其存在的必要性,即具有特定的生理功能。已有人在冠状动脉粥样硬化模型中,证实α7nΑCHRs基因缺陷的小鼠血小板活化程度和炎性反应更重[7]。因此我们猜想在脓毒症时,通过激活血小板的α7nΑCHRs是否可以抑制炎性反应所致的血小板过度活化,从而减少血小板的消耗,但同时不影响血小板的数量和凝血功能,也不增加出血风险,减轻血小板参与的失控的炎性反应和凝血反应的恶性循环,减轻炎性反应和凝血障碍,缓解炎性损伤、微循环障碍和脏器功能损害,改善预后。本实验拟建立脓毒症模型,并观察激动α7nΑCHRs对脓毒症小鼠血小板的影响。
1 材料与方法 1.1 材料美国Becton Dickison公司FACSCalibur流式细胞仪。迈瑞BC-2800全自动三分群血液细胞分析仪。单抗鼠CD61-FITC、CD62P-PE, 单抗小鼠IgG-PE(同型对照抗体), 以上抗体购自美国Biolegend公司。选用英国Abcam公司的GTS-21选择性激动α7nΑCHRs。
1.2 实验动物及分组SPF级雄性C57BL/6小鼠,8-12周龄(24-28 g),30只,由湖北省疾病预防控制中心提供,在武汉大学A3动物实验中心饲养,自由进食饮水,环境温度24 ℃,12 h明暗周期,适应性饲养1周后开始实验。将30只雄性C57BL/6小鼠按随机数字表法随机分为3组:假手术组(sham组)、盲肠结扎+穿孔组(CLP组)、CLP+α7nΑCHRs激动组(CLP+GTS-21组),每组10只。
1.3 动物模型制备选用腹腔注射10%水合氯醛4 ml/kg进行小鼠麻醉。盲肠结扎+穿孔组(CLP组):腹部常规消毒,腹正中作1 cm切口进入腹腔,游离盲肠,结扎游离盲肠末端约1 cm处。22G针头在结扎端贯通穿刺一次,挤出少许粪便,约1 mm左右,置回腹腔,关腹后,立即腹腔注射生理盐水4 ml/kg,术后6 h后再次腹腔注射生理盐水4 ml/kg。CLP+GTS-21组:盲肠结扎穿孔(CLP)法制备脓毒症小鼠炎症模型, 术闭立即腹腔注射GTS-21,剂量4 mg/kg, 术后6 h后再次腹腔注射4 mg/kg GTS-21。sham组:剖腹后仅分离盲肠远端,不结扎穿孔,关腹后腹腔注射生理盐水4 ml/kg, 术后6 h后再次腹腔注射生理盐水4 ml/kg。3组术毕均进行复苏:予以1 ml生理盐水皮下注射,红外线烤灯复温至麻醉苏醒,自由进食饮水。
1.4 标本采集选用心脏采血,于术后24 h,用1 ml注射器通过心脏穿刺采血(3.8%枸橼酸钠1:9抗凝),尽量减少负压,标本收集后避免物理振荡,30 min内处理标本。
1.5 流式样本制备取4支试管分别为T1,T2,N1,N2分别为试验管2支、样本空白对照管、样本同型对照管,向4支试管中分别加入HBS(Hepes缓冲液)45 μl。T1、T2试管中先各加入2 μl单抗小鼠CD61-FITC抗体, T2试管中再加入2 μl单抗小鼠CD62P-PE抗体;N1试管不加任何抗体,N2试管先加入2 μl单抗小鼠CD61-FITC抗体, 再加入2 μl单抗小鼠IgG-PE(同型对照抗体)。吸取15 μl血标本,加入150 μl HBS稀释血标本,再取稀释后的血标本15 μl分别加入T1,T2,N1,N2试管,常温避光孵育20 min后立即上机检测。
1.6 血小板计数全自动血细胞分析仪检测小鼠血小板计数(PC)。
1.7 统计学处理实验数据采用SPSS 19.0统计软件处理,所有数据进行正态性检验和方差齐性检验。计量资料以均数±标准差(x±s)表示,组间比较采用单因素方差分析(ANOVA),以P<0.05为差异有统计学意义。
2 结果 2.1 激动α7nΑCHRs对CLP小鼠血小板计数的影响CLP组小鼠血小板计数较sham组明显减少[(322.3±105.81)×109/L vs (835.30±86.94)×109/L, P<0.05], CLP+GTS-21组小鼠血小板计数较sham组也明显减少[(447.4±125.78)×109/L vs (835.30±86.94)×109/L, P<0.05],但CLP+GTS-21组小鼠血小板数目较CLP组明显增高[(447.4±125.78)×109/L vs (322.3±105.81)×109/L, P<0.05], 见图 1。
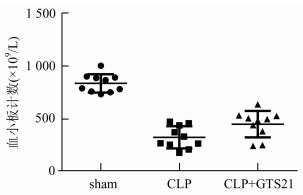
|
图 1 激活α7nΑCHRs对CLP小鼠血小板计数的影响 CLP组与sham组比较,P<0.05;CLP+GTS-21与sham组比较,P<0.05;CLP+GTS-21与CLP组比较,P<0.05 |
当用CD62P的平均荧光强度(MFI)表示血小板的活化时,CLP组与sham组比较: 291.67±119.53 vs 276.06±135.28, P>0.05;CLP+GTS-21与sham组比较:318.41±130.01 vs 276.06±135.28,P>0.05;CLP+GTS-21与CLP组比较:318.41±130.01 vs 291.67±119.53,P>0.05,3组均无显著性差异(图 2,A)。当用CD62P阳性血小板占血小板总数的百分比(CD62P%)表示血小板的活化时,CLP组与sham组比较: 1.78±1.46 vs 1.38±1.13, P>0.05;CLP+GTS-21与sham组比较:1.42±1.13 vs 1.38±1.12,P>0.05;CLP+GTS-21与CLP组比较:1.42±1.13 vs 1.78±1.46,P>0.05,3组也均无显著性差异(图 2,B)。各组间小鼠血小板膜糖蛋白CD62p表达水平均无明显变化。
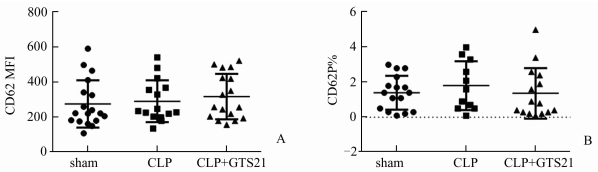
|
图 2 激活α7nΑCHRs对CLP小鼠血小板CD62p表达水平的影响 A. CD62P阳性血小板占血小板总数的百分比(CD62P%); B. CD62P的平均荧光强度(MFI); CLP组与sham组比较,P>0.05;CLP+GTS-21与sham组比较,P>0.05;CLP+GTS-21与CLP组比较,P>0.05 |
我们的研究结果发现脓毒症小鼠存在血小板减少的情况,且激动α7nΑCHRs可以缓解小鼠脓毒症相关血小板减少,但却不会完全逆转脓毒症相关血小板减少。同时我们也证实通过检测所采集的脓毒症小鼠血标本中血小板CD62P的表达,并不能反应脓毒症小鼠体内血小板的活化情况。
脓毒症是指针对感染的失控宿主反应所致危及生命的器官功能障碍[1]。脓毒症患者常常伴发血小板减少,通常认为血小板数低于150 000/μl为血小板减少[8]。有文章提出35%-59%脓毒症患者发生血小板减少[9]。也有研究发现在纳入的105个重症脓毒症或脓毒症休克患者中,53%的患者在纳入时即伴有血小板减少,且血小板减少的发生与预后不良联系紧密[10]。还有研究发现院内血流感染患者中43.2%发生血小板减少,且若将血小板减少至20 000/μl定为极重度血小板减少组,反之则定为轻度血小板减少组,后一组的死亡率为49.3%,而前一组则高达77.8%[11]。
目前越来越多人致力于抗血小板治疗在脓毒症中应用的研究,但是得到的结论却并不一致。有的研究证实在脓毒症时抑制血小板的活化,可改善炎性反应和凝血系统的过度活化,减少微血栓的形成,改善组织灌注、器官损伤和疾病的预后。但也有人研究采用抗血小板表面GPIbα的单克隆抗体使血小板数目急剧下降,反而增加脓毒症的死亡率[12]。之所以会出现两种相反的观点,可能是因为血小板和其他的炎性细胞一样,在机体极度缺乏时,同炎性反应完全被抑制一样,机体防御能力被极大削弱,病原体迅速扩散,死亡率极高。可是脓毒症时期若血小板过度活化却又会使炎性反应和凝血反应失控,加重组织器官损伤,增加死亡率。结合双方的研究,我们认为,可能脓毒症时期,血小板既不过度活化,也不极度缺乏或完全失去功能可能是一个相对较好的状态。
胆碱能抗炎通路是拮抗全身炎性反应作用的通路, 外周的有害刺激能通过体液和神经途径到达中枢神经系统,诱发神经细胞的活性变化,传出神经释放乙酰胆碱,刺激免疫细胞上的α7nΑCHRs[5]。最近的研究表明,免疫细胞上的α7nΑCHRs被激活后,会引发钙离子内流,激活PI3K/AKT通路,促使Nfr2转移到胞核,同时促进HO-1的表达,共同抑制促炎因子的释放,从而发挥抗炎效应[13]。血小板表面也存在α7nΑCHRs已被证实,本实验发现激动小鼠脓毒症体内α7nΑCHRs可以缓解脓毒症相关血小板减少,但不会完全逆转脓毒症相关血小板减少,说明血小板仍有部分被活化、消耗,但活化比例减少,此时体内的血小板可能就是一个相对较好的状态,既不会使机体完全失去防御能力,同时也能减轻炎性反应和凝血反应过度活化造成的组织器官损伤,但这些猜测还需进一步的实验证实。由于针对脓毒症时期活化α7nΑCHRs对血小板的影响尚未有机制方面的研究,我们只能猜测其可能是通过血小板内某一特定的通路,抑制血小板的活化,以及后续的脱颗粒反应,但仍需相关研究证实。
同时本实验也证实通过检测所采集的脓毒症小鼠血标本中血小板表面CD62P的表达,并不能反应脓毒症小鼠体内血小板的活化情况,之前也有相关研究得到类似的结果[14, 15]。原因可能是脓毒症小鼠体内活化的血小板迅速与其他细胞(中性粒细胞、单核细胞、内皮细胞等)发生黏附聚集,或者黏附于血管壁,被扣押在组织器官中,而游离的单个血小板均为未活化状态的血小板,因此流式细胞仪所筛选的单个游离的血小板基本不表达血小板活化标志物CD62P。因此,通过检测血小板表面CD62P的表达来反映体内血小板的活化情况可能并不全都适用,特别是在脓毒症模型中。
本实验的局限性主要有两点。首先由于血小板活化指标检测结果为阴性,因此不能直接证明激动α7nΑCHRs可以减轻脓毒症小鼠血小板的活化,我们只能推断可能是血小板的活化减少,所以血小板的消耗会减少,但还需要进一步的实验来证明推断。其次本实验尚未对激动α7nΑCHRs减轻脓毒症小鼠血小板的消耗是否会改善脓毒症小鼠的预后进行相关研究,也需进一步的试验来证实。
综上,脓毒症小鼠会发生明显的血小板减少,激动α7nΑCHRs可以缓解脓毒症小鼠血小板减少,但不会完全逆转其改变,其具体机制还需进一步的研究。其次,通过检测血小板表面CD62P的表达来反映体内血小板的活化情况可能并不全都适用,特别是在脓毒症模型中。
| [1] | Singer M, Deutschman CS, Seymour CW, et al. The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3)[J]. JAMA, 2016, 315(8): 801-810. |
| [2] | van der Poll T, Levi M. Crosstalk between inflammation and coagulation: the lessons of sepsis[J]. Curr Vasc Pharmacol, 2012, 10(5): 632-638. |
| [3] | McFadyen JD, Kaplan ZS. Platelets are not just for clots[J]. Transfus Med Rev, 2015, 29(2): 110-119. DOI: 10.1016/j.tmrv.2014.11.006. |
| [4] | Gafter-Gvili A, Mansur N, Bivas A, et al. Thrombocytopenia in Staphylococcus aureus bacteremia: risk factors and prognostic importance[J]. Mayo Clin Proc, 2011, 86(5): 389-396. |
| [5] | Tracey KJ. The inflammatory reflex[J]. Nature, 2002, 420(6 917): 853-859. |
| [6] | Schedel A, Thornton S, Schloss P, et al. Human platelets express functional alpha7-nicotinic acetylcholine receptors[J]. Arterioscler Thromb Vasc Biol, 2011, 31(4): 928-934. |
| [7] | Kooijman S, Meurs I, van der Stoep M, et al. Hematopoietic alpha7 nicotinic acetylcholine receptor deficiency increases inflammation and platelet activation status, but does not aggravate atherosclerosis[J]. J Thromb Haemost, 2015, 13(1): 126-135. DOI: 10.1111/jth.12765. |
| [8] | Larkin CM, Santos-Martinez MJ, Ryan T, et al. Sepsis-associated thrombocytopenia[J]. Thromb Res, 2016, 141: 11-16. DOI: 10.1016/j.thromres.2016.02.022. |
| [9] | Aird WC. The hematologic system as a marker of organ dysfunction in sepsis[J]. Mayo Clin Proc, 2003, 78(7): 869-881. |
| [10] | Warkentin TE, Aird WC, Rand JH. Platelet-endothelial interactions: sepsis, HIT, and antiphospholipid syndrome[J]. Hematology Am Soc Hematol Educ Program, 2003, 2003(1): 497-519. |
| [11] | Vandijck DM, Blot SI, De Waele JJ, et al. Thrombocytopenia and outcome in critically ill patients with bloodstream infection[J]. Heart Lung, 2010, 39(1): 21-26. |
| [12] | Xiang B, Zhang G, Guo L, et al. Platelets protect from septic shock by inhibiting macrophage-dependent inflammation via the cyclooxygenase 1 signalling pathway[J]. Nat Commun, 2013, 4: 2 657. DOI: 10.1038/ncomms3657. |
| [13] | Fujii T, Mashimo M, Moriwaki Y, et al. Expression and function of the cholinergic system in immune cells[J]. Front Immunol, 2017, 8: 1 085. DOI: 10.3389/fimmu.2017.01085. |
| [14] | Hurley SM, Lutay N, Holmqvist B, et al. The dynamics of platelet activation during the progression of streptococcal sepsis[J]. PLoS One, 2016, 11(9): e0163531. DOI: 10.1371/journal.pone.0163531. |
| [15] | Andonegui G, Kerfoot SM, McNagny K, et al. Platelets express functional Toll-like receptor-4[J]. Blood, 2005, 106(7): 2 417-2 423. |
 2018, Vol. 39
2018, Vol. 39


