糖尿病心肌病是一种特异性心肌病,临床表现为心肌舒张功能障碍早于收缩功能障碍,最后发展为充血性心力衰竭[1]。糖尿病心肌病的发病机制较为复杂,其中高血糖所导致的过度氧化应激与其发生发展尤为有关[2]。一氧化氮(nitric oxide,NO)是心血管系统极为重要的调节因子,由内皮型一氧化氮合酶(endothelial nitric oxide synthases, eNOS)来源的NO具有重要的心肌保护作用。小窝蛋白-3(Caveolin-3)是心肌细胞质膜小窝结构(caveolae)的特异性标志蛋白,是多种分子信号转导的平台,具有重要的生理作用[3]。研究表明心肌细胞存在caveolin-3/eNOS信号通路,心肌细胞eNOS与Caveolin-3共定位于Caveolae内,Caveolin-3对于eNOS激活及NO释放发挥重要作用[4]。我们前期研究显示, 糖尿病心肌氧化应激水平显著增强,Caveolin-3表达水平明显降低,进一步研究发现糖尿病心肌组织eNOS失偶联从而影响NO的产生,最终引起糖尿病心肌功能障碍[5]。综上所述,我们推测糖尿病心肌氧化应激水平过度增强从而导致Caveolin-3/eNOS/NO信号通路受损是引起糖尿病心肌病发生发展的重要机制。因此,本研究拟用抗氧化剂N-乙酰半胱氨酸(N-acetylcysteine,NAC)治疗糖尿病大鼠,旨在观察其对早期糖尿病大鼠氧化应激状态、心肌Caveolin-3/eNOS/NO信号通路及心功能的影响。
1 材料与方法 1.1 主要试剂与仪器链脲佐菌素(STZ)、NAC购自美国Sigma公司。15-F2t-异前列烷(isoprostane)与总抗氧化物浓度水平检测试剂盒购自美国Cayman公司,超氧化物歧化酶(SOD)、NO检测试剂盒购自南京建成生物科技公司,硝基酷氨酸(Nitrotyrosine)检测试剂盒购自美国Millipore公司。一抗:鼠抗Caveolin-3购自美国Santa Cruz Biotechnoloy, 兔抗eNOS、p-eNOS、GAPDH购自美国Cell Signaling Technoloy。二抗:辣根过氧化物酶标记的羊抗兔抗体购自Cell Signaling Technoloy。器材:高频超声诊断仪(加拿大Visual Sonics公司),奥得赛(Odyssey)红外扫描仪(美国LI-COR Biosciences公司)。
1.2 动物分组及糖尿病心肌病动物模型制作8周龄清洁级健康雄性SD大鼠24只,体重(260±10)g,由武汉大学动物实验中心提供。所有动物实验符合武汉大学实验动物管理条例。实验前适应性喂养7 d,整个实验中自由饮水、饮食。大鼠随机分为3组:对照组(NC组)、糖尿病组(DM组)和糖尿病NAC治疗组(DM+NAC组), 每组8只大鼠。所有大鼠均禁食12 h,DM组与DM+NAC组大鼠腹腔注射苯巴比妥钠65 mg/kg麻醉后从尾静脉一次注射60 mg/kg链脲佐菌素(溶于0.1 mol/L, pH 4.5枸橼酸缓冲液),NC组大鼠注射相当剂量的枸橼酸缓冲液,72 h后测血糖≥16.7 mmol/L的视为糖尿病大鼠。糖尿病模型制备成功1周后,NAC治疗组大鼠给予1.5 g/(kg·d)剂量灌胃[6]。病程中每周监测一次血糖和体重,共观察4周后终止实验,使用苯巴比妥钠65 mg/kg腹腔注射麻醉后,使用超声心动图检测心功能后采集颈动脉血样。快速开胸取心脏,切取心尖部, 石蜡包埋,HE染色,观察心肌形态学变化; 余下心肌组织保存备用。
1.3 超声心动图检测心功能将小鼠左胸前区剃毛,涂抹耦合剂,取左侧卧位或仰卧位对大鼠行超声检查。采用高频超声诊断仪, 频率为17.0 MHz,选取标准左心室乳头肌短轴切面,测量大鼠左室舒张末容积(left ventricular end-diastolic volume, LVVd), 左室收缩末容积(left ventricular end-systolic volume, LVVs),左室后壁舒张末厚度(left ventricular posterior wall dimensions at end diastole,LVPWD),左室后壁收缩末厚度(left ventricular posterior wall dimensions at end systole, LVPWs),左室射血分数(ejection fraction, EF)和每搏量(stroke volume, SV), 心率(heart rate, HR),左室舒张期内径(left ventricular internal diastolic dimension, LVIDd),二尖瓣口舒张早期血流峰值(E)与舒张晚期血流峰值(A)的比值(peak velocity of early filling/late velocity of late filling, E/A),等容舒张时间(isovolumetric relaxsation time, IVRT)。短轴缩短率(left ventricular fractional shortening, FS),(FS, %)=(LVIDd-LVIDs)/LVIDd×100%, 射血分数(EF, %)=(LVVd-LVVs)/LVVd×100%。
1.4 检测血清中15-F2t-isoprostane、SOD水平与总抗氧化物浓度水平将采集的颈动脉血样离心后取血清,试剂盒检测血清15-F2t-isoprostane、总抗氧化物浓度水平及SOD活性,所有操作方法按试剂盒说明书进行。
1.5 检测心肌组织中的15-F2t-isoprostane、超氧阴离子(O2-·), Nitrotyrosine与NO水平将心肌组织匀浆离心后收集上清,BCA法测定上清蛋白浓度,试剂盒检测上清15-F2t-isoprostane、NO与Nitrotyrosine水平,15-F2t-isoprostane水平以μg/kg protein表示,Nitrotyrosine水平以g/kg protein表示, NO水平以mol/kg protin表示;采用分光光度法检测O2-·,其水平以MLU/min/100 μg protein表示,所有操作方法按试剂盒说明书进行。
1.6 Western Blot检测心肌组织蛋白表达取上述部分心肌组织标本,提取组织总蛋白,BCA法测定蛋白浓度,50 μg上样,SDS-PAGE电泳后转移至PVDF膜,5%脱脂牛奶封闭PVDF膜2 h, 洗膜后分别加入鼠抗Caveolin-3, 兔抗eNOS, 兔抗p-eNOS (Ser1177), 兔抗GAPDH抗体,4 ℃孵育过夜。洗膜后加入辣根过氧化物酶标记的二抗,室温孵育2 h,TBST洗膜后按奥得赛(Odyssey)红外扫描仪操作人员手册扫描条带,分析并导出条带灰度值。
1.7 统计学分析所有数据基于内参做标准化处理,计量资料以均数±标准差(x±s)表示,采用GraphPad Prism软件对所有实验数据进行统计学处理,组间采用单因素方差分析,P<0.05为差异具有统计学意义。
2 结果 2.1 各组大鼠一般情况及心功能变化实验进程中糖尿病大鼠均出现血糖升高、多食、多饮及体重降低等表现(P<0.05)。NAC治疗4周能显著降低糖尿病大鼠食物及水的摄取量(P < 0.05),但对血糖水平及体重无明显影响。实验结束后,应用超声心动图评估大鼠心肌功能,与NC组比较,DM组大鼠HR、E/A比值显著下降,IVRT明显增加(P<0.05),而FS、EF与LVPW无统计学改变,这提示早期糖尿病大鼠(5周)心肌舒张功能受损而心肌收缩功能暂未受影响。经NAC治疗4周后,与DM组比较,DM+NAC组IVRT明显降低,而HR与E/A比值显著增加(P<0.05),这表明抗氧化剂NAC可以改善心肌舒张功能,见表 1。
| 表 1 各组大鼠的一般情况及心功能变化(n=8,x±s) |
HE染色结果显示,NC组大鼠心肌组织细胞核呈圆形或椭圆形明显,细胞无肿胀、无肥大,间质结构清晰,横纹清晰,组织纤维排列整齐;DM组大鼠心肌细胞核大小不均匀、心肌细胞肥大、边界不清,心肌组织纤维排列紊乱、扭曲,并可见炎性细胞局部浸润。经NAC治疗4周后,糖尿病心肌组织结构明显好转(图 1)。
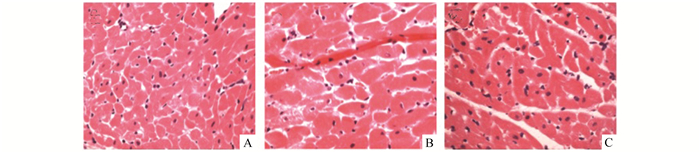
|
图 1 各组大鼠心肌细胞形态学改变(×400) A: NC组;B: DM组;C: DM+NAC组 |
与NC组比较,DM组大鼠血清15-F2t-isoprostane与总抗氧化物浓度水平显著升高(P<0.05),血清SOD水平显著下降(P<0.05)。与DM组比较,NAC治疗后大鼠血清15-F2t-isoprostane与总抗氧化物浓度有所下降(P<0.05),而血清SOD水平明显增加上升(P<0.05),见表 2。
| 表 2 各组大鼠血清15-F2t-isoprostane与总抗氧化物、SOD水平(n=8,x±s) |
与NC组比较,DM组大鼠心肌15-F2t-isoprostane、O2-·与Nitrotyrosine水平显著升高(P<0.05),NO水平显著下降(P<0.05)。与DM组比较,NAC治疗后大鼠心肌15-F2t-isoprostane、O2-·与Nitrotyrosine水平显著降低(P<0.05),NO水平显著升高(P<0.05),见表 3。
| 表 3 各组大鼠心肌组织中15-F2t-isoprostane、O2-·、Nitrotyrosine与NO水平(n=8,x±s) |
各组大鼠心肌组织Caveolin-3、p-eNOS与eNOS蛋白表达变化, 如图 2所示,与NC组比较,DM组大鼠心肌Caveolin-3和p-eNOS表达显著降低(P<0.05), 而eNOS无明显变化,同时NO生成减少,NAC治疗后可以部分恢复糖尿病大鼠Caveolin-3和p-eNOS的表达(P<0.05)(图 2)。
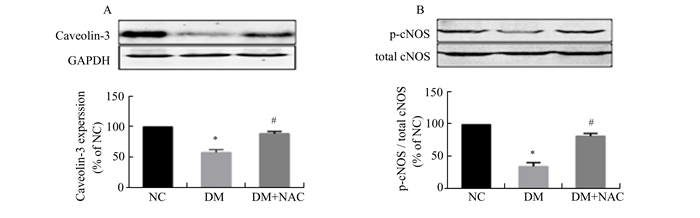
|
图 2 NAC治疗对早期糖尿病大鼠心肌Caveolin-3及p-eNOS表达的影响 A:心肌Caveolin-3表达;B:心肌p-eNOS表达。与NC组比较,*P < 0.05;与DM组比较,#P < 0.05 |
糖尿病是心血管疾病发生发展的重要危险因素。本研究参照前述研究方法[5],采用一次性尾静脉注射STZ破环大鼠胰岛细胞,结果显示STZ诱导3 d后血糖≥16.7 mmol/L,且后续血糖监测水平稳定,这表明大鼠糖尿病模型制备成功。长期高血糖导致的过度氧化应激是糖尿病心血管并发症及心肌功能障碍的主要机制。本研究结果提示,糖尿病大鼠血清脂质过氧化物15-F2t-isoprostane水平显著升高而内源性抗氧化酶SOD活性显著降低,进一步研究发现糖尿病大鼠心肌组织中15-F2t-isoprostane、O2-·、Nitrotyrosine水平明显增高,这表明糖尿病状态下机体氧化与抗氧化系统失衡,从而导致心肌氧化损伤增加。值得注意的是,尽管本研究中也发现血清总抗氧化物浓度水平代偿性增加,但其上调却不足以减轻机体氧化应激所致的氧化损伤。NAC是一种经典的抗氧化剂[6],我们前期研究发现其可以减轻多个脏器的氧化损伤[7]。参照前期研究
结果[6, 7],预实验中分别以0.5,1,1.5 g/(kg·d)三种不同的剂量治疗糖尿病大鼠4周,只有当NAC以1.5 g/(kg·d)剂量时才可以减少糖尿病心肌损伤,因此本研究所采用的NAC剂量是1.5 g/(kg·d)。NAC持续治疗4周后,结果显示糖尿病大鼠总抗氧化物浓度及心肌组织中15-F2t-isoprostane、O2-·及Nitrotyrosine水平明显下降,而血清SOD活性水平明显增加,这表明NAC可以减轻糖尿病所致的氧化应激损伤。
Caveolin-3表达于心肌及其他细胞,是心肌小窝结构发挥生理功能的重要蛋白[8]。研究发现,心脏特异性Caveolin-3基因敲除大鼠心肌细胞中离子通道异常开放,心率减慢,出现明显的心功能障碍及各种心肌疾病,最终发展为心力衰竭,提示Caveolin-3在维持心功能方面发挥重要作用[9]。本研究提示,糖尿病状态下,大鼠心肌氧化应激水平明显增加,超声发现HR、E/A比值显著下降,IVRT明显增加,表明心脏舒张功能障碍。进一步研究发现Caveolin-3与p-eNOS表达减少,且NO生成减少,表明糖尿病心肌Caveolin-3/eNOS/NO信号通路受损。经NAC治疗4周后,心肌氧化应激水平下降,Caveolin-3表达部分恢复,p-eNOS活性增加,且NO生成增加,心脏舒张功能障碍减轻。因此,我们推测抗氧化剂NAC改善糖尿病心功能障碍可能通过减轻氧化应激对Caveolin3/eNOS/NO信号途径的损伤发挥作用。
综上所述,Caveolin-3/eNOS/NO信号通路对维持正常心功能发挥重要作用,早期糖尿病大鼠氧化应激过度增加,使Caveolin-3/eNOS/NO信号通路受损,导致心肌舒张功能受损。N-乙酰半胱氨酸可降低糖尿病心肌氧化应激水平,通过恢复Caveolin-3/eNOS/NO信号通路从而减轻糖尿病心肌舒张功能障碍。
| [1] | Trachanas K, Sideris S, Aggeli C, et al. Diabetic Cardiomyopath:From Pathophysiology to Treatment[J]. Hellenic Journal of Cardiology, 2014, 55(5): 411-421. |
| [2] | Liu Y, Lei S, Gao X, et al. PKCβ inhibition with ruboxistaurin reduces oxidative stress and attenuates left ventricular hypertrophy and dysfunction in rats with streptozotocin-induced diabetes[J]. Clinical Science, 2012, 122(4): 161-173. DOI: 10.1042/CS20110176. |
| [3] | Panneerselvam M, Patel H, Roth D, et al. Caveolins and heart diseases[J]. Adv Exp Med Biol, 2012, 729: 145-156. DOI: 10.1007/978-1-4614-1222-9. |
| [4] | Feron O, Balligand JL. Caveolins and the regulation of endothelial nitric oxide synthase in the heart[J]. Cardiovasc Res, 2006, 69(4): 788-797. DOI: 10.1016/j.cardiores.2005.12.014. |
| [5] | Lei S, Li H, Xu J, et al. Hyperglycemia-induced protein kinase C β2 activation induced diastolic cardiac dysfunction in diabetic rats by impairing caveolin-3 expression and Akt/eNOS signaling[J]. Diabetes, 2013, 62(7): 2318-2328. DOI: 10.2337/db12-1391. |
| [6] | Mao X, Wang T, Liu Y, et al. N-acetylcysteine and allopurinol confer synergy in attenuating myocardial ischemia injury via restoring HIF-1α/HO-1 signaling in diabetic rats[J]. PLoS One, 2013, 8(7): e68949. DOI: 10.1371/journal.pone.0068949. |
| [7] | Lei S, Liu Y, Liu H, et al. Efffects of N-acetylcysteine on nicotinamide dinucleotide phosphate oxidase activation and antioxidant status in heart, lung, liver and kidney in streptozotocin-induce diabetic rats[J]. Yonsei Med J, 2012, 53(2): 294-303. DOI: 10.3349/ymj.2012.53.2.294. |
| [8] | Kim J, Peng D, Schlebach J, et al. Modest effects of lipid modification on the structure of caveolin-3[J]. Biochemistry, 2014, 53(27): 4320-4322. DOI: 10.1021/bi5005238. |
| [9] | Yang Y, Ma Z, Hu W, et al. Caveolin-1/-3: therapeutic targets for myocardial ischemia/reperfusion injury[J]. Basic Res Cardiol, 2016, 111(4): 45. DOI: 10.1007/s00395-016-0561-6. |
 2018, Vol. 39
2018, Vol. 39


