颅脑损伤是一类有着高致残率和高致死率的疾病,它严重威胁着人类的健康和生命安全[1, 2]。研究表明炎症反应以及免疫反应在颅脑损伤后继发性脑损伤中有着重要的作用,在很大程度上决定了颅脑损伤的最终结果[3, 4]。肿瘤坏死因子-α(TNF-α)是颅脑损伤早期就出现增高的一种炎症细胞因子,其由单核巨噬细胞激活后产生,可以通过其受体直接作用于血管内皮使其通透性增加并激活血小板激活因子,由于TNF-α可以增加血脑屏障的通透性,导致例如炎症反应、水肿以及缺血缺氧等反应,对机体有严重的破坏作用[5, 6]。核转录因子-κB (NF-κB)是目前研究的比较多的一个炎症因子,它存在于细胞质中,可以被多种因子激活,同时它也可以调控多种黏附因子、细胞因子以及趋化因子等[7, 8]。有研究表明,NF-κB与颅脑外伤后的炎症反应密切相关,在颅脑损伤后的早期,损伤的神经元以及对损伤有反应的神经胶质细胞可以产生一系列的信号来刺激NF-κB的活性,NF-κB出现活化[9, 10]。本研究通过检测TNF-α和NF-κB通路中的相关因子在颅脑损伤患者脑组织中的表达,初步探讨TNF-α和NF-κB通路在颅脑损伤中发挥的作用以及机制。
1 资料与方法 1.1 动物分组健康成年雄性SD大鼠64只,体重230-310 g,随机分成对照组8只和颅脑损伤组56只,颅脑损伤组在外伤后1 h、3 h、6 h、12 h、24 h、3 d、7 d处死,每组处死8只。
1.2 动物建模颅脑损伤组大鼠以水合氯醛进行腹腔内注射麻醉,麻醉起效后,于右侧颅顶旁正中切口切开皮肤,约3 cm长,逐步分离软组织后剥离骨膜,颅骨开窗并扩大至5 mm×5 mm的正方形骨窗,在操作过程中保持硬脑膜的完整性。以T型撞垫与动物台平行,放置导引管,用25 g砝码沿40 cm高的导引管自由落体撞向大鼠颅脑部,撞击后用碘伏冲洗伤口并缝合头皮。对照组大鼠不予以撞击,其他操作与实验组相同。大鼠苏醒后分笼饲养。
1.3 模型判断标准颅脑损伤组的大鼠在撞击后均有不同程度的意识障碍、瞳孔改变以及肢体抽搐等改变,伤后的角膜反射、对光反射以及睫毛反射消失并在30 min内恢复,为建模成功。在建模后对大鼠的神经功能损伤进行评分,大鼠在颅脑损伤1 h后任务成功计0分,任务失败计1分,分值为0-10分,10分代表有严重的神经功能障碍。任务分别为单侧/偏侧瘫痪、走出圆圈、直线行走、惊跳反射、寻觅行为、圆棒平衡、平衡木并分别在平衡木行走3 cm、2 cm以及1 cm。
1.4 病理切片、超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)的检测以及含水量的检测病理切片:在各个时间点随机选取4只颅脑损伤组的大鼠,在水合氯醛麻醉后,进行生理盐水灌注后取脑组织,将脑组织放置于4%多聚甲醛中固定48 h。以损伤灶为中心,取厚约4 mm的标本,乙醇脱水后石蜡包埋,常规切片HE染色。
脑组织中SOD、GSH、MDA的检测:同样的方法取脑后,留取1 mm×1 mm×1 mm的脑皮质,-80 ℃保存。检测前取出解冻后加入9倍体积的生理盐水进行匀浆,2 500 r/min,离心10 min后取上清待测。
脑组织含水量检测:同样的方法取脑后,留取2 mm×2 mm×1 mm的脑皮质,用滤纸吸干表面水分,称重后于100 ℃干燥箱中烘烤48 h至恒重,称重。根据公式进行计算,脑组织的含水量=(脑组织的湿重-脑组织的干重)/脑组织湿重×100%。
1.5 统计学分析本研究中的所有数据均采用SPSS 11.0统计学软件进行统计学分析,组间比较用方差分析,相关性分析采用Pearson相关分析,P<0.05为差异有统计学意义。
2 结果 2.1 构建大鼠颅脑损伤模型在构建颅脑损伤组大鼠模型时,有4只大鼠由于麻醉死亡,2只在颅脑损伤后死亡,死亡率为8.57%。颅脑损伤组大鼠在损伤处可以明显看到有硬膜下血肿以及蛛网膜下腔出血的表现,且对大鼠的神经功能损伤进行评分,颅脑损伤后的各个时间点的评分差异无统计学意义(P>0.05),见表 1。
| 表 1 颅脑损伤后的各个时间点的评分 |
从不同时间点的脑组织含水量与对照组相比,颅脑损伤组大鼠的脑组织含水量逐渐升高,在颅脑损伤1 h后,其含水量较对照组有所升高,但是差异无统计学意义(P>0.05),伤后3 h开始逐渐升高至伤后的72 h脑组织含水量达到高峰,到伤后的第7天,颅脑损伤组大鼠的脑组织含水量明显下降,但是仍然高于对照组,差异有统计学意义(P<0.05),见表 2。
| 表 2 大鼠的脑组织含水量 |
通过对各组大鼠的脑组织进行切片染色后发现对照组大鼠的脑组织结构完整,细胞排列有序,间质无水肿出现。而颅脑损伤组大鼠在蛛网膜下腔和硬膜下发现出血,并且随着时间的延长,出血逐渐加重,到伤后6 h脑组织已经发现有轻度的水肿,而到12 h可以明显地发现脑组织损伤区出现坏死,并且水肿加剧,到24 h脑组织水肿明显,且有大量的炎性细胞浸润,到3 d损伤达到高峰期,脑组织广泛坏死,水肿明显,细胞核固缩,有大量的炎性细胞浸润;到7 d时,水肿较之前减轻,但是仍然有大量的炎性细胞浸润以及少量的纤维组织增生,见图 1。
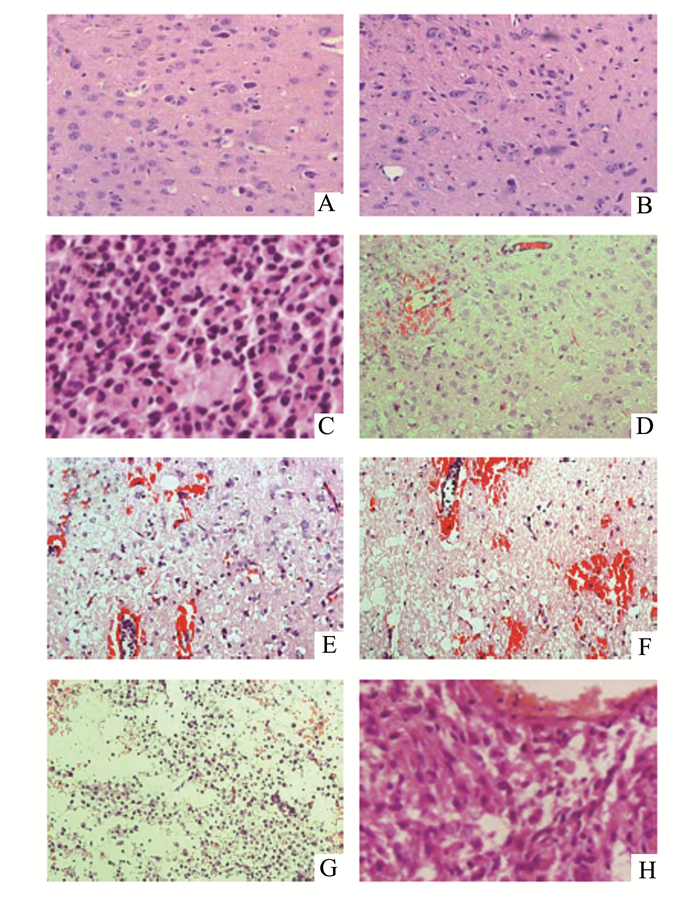
|
图 1 大鼠脑组织HE染色变化(×200) A-H分别为:对照、1 h、3 h、6 h、12 h、24 h、3 d、7 d组 |
SOD活性在颅脑损伤后迅速降低并且在3 d时到达最低点,3 d后逐渐上升,7 d时仍然未恢复至正常水平。GSH的水平变化与SOD活性变化基本一致,而MDA的含量在颅脑损伤后的1 h就升高,在3 d时达到高峰,随后下降,但是到7 d时仍然高于对照组水平,差异有统计学意义。并且三组变化情况的各个时间点与对照组比,差异均有统计学意义,见表 3。
| 表 3 损伤灶周围脑组织SOD、GSH、MDA的变化 |
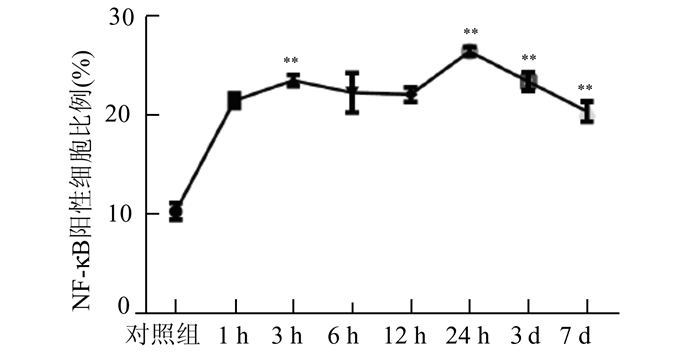
从免疫组化的切片中,我们发现与对照组相比,颅脑损伤组切片中有大量的TNF-α的表达,并且从损伤后1 h开始,TNF-α的表达逐渐增加,到6 h时,其表达量稍有下降,到24 h继续下降,但是较对照组仍明显增高,到3 d时明显上升,第7天时较第3天稍有下降,但是每个时间段的TNF-α表达较对照组均明显增高,差异均有统计学意义,提示颅脑损伤后TNF-α持续高表达;而NF-κB的表达在颅脑损伤组中也处于高表达状态,并且在各个时间点均高表达,其中3 h、24 h这两个时间点较前一个时间点NF-κB的表达显著升高,到了3 d和7 d时,NF-κB的表达稍有下降,但是仍然显著高于对照组,差异具有统计学意义,见图 2-5。
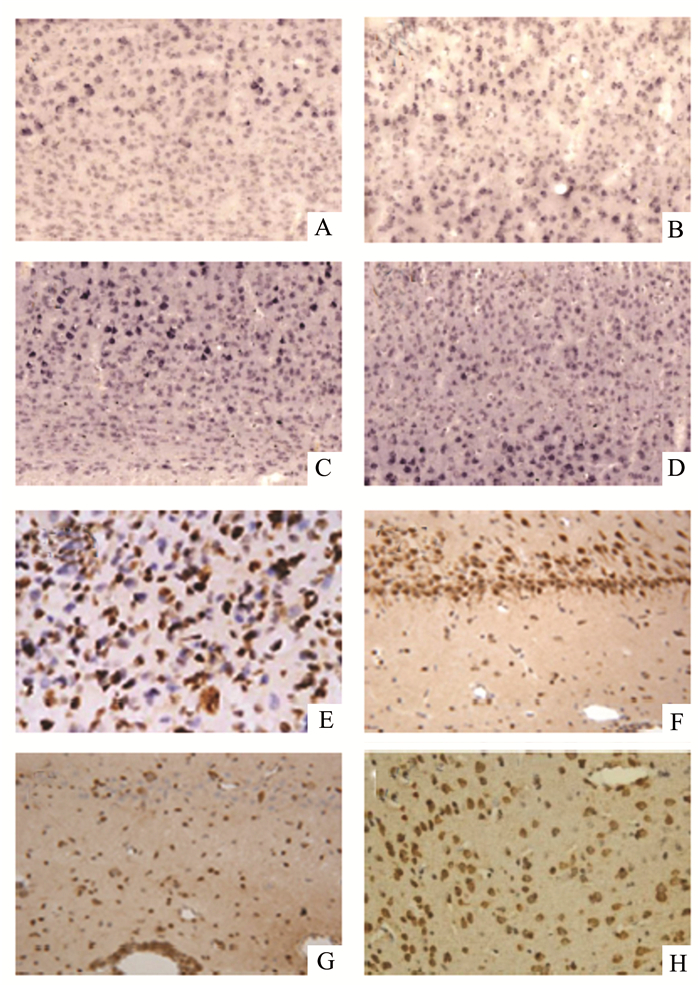
|
图 2 脑组织中TNF-α的表达(免疫组化×100) A-H分别为:对照、1 h、3 h、6 h、12 h、24 h、3 d、7 d组 |
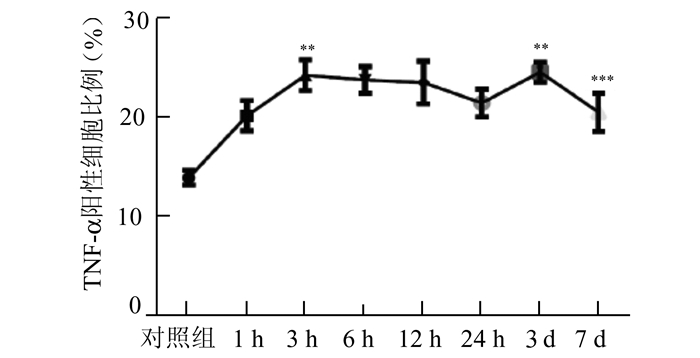
|
图 3 脑组织中TNF-α的表达(阳性细胞比例) 与前一时间点比较,**P < 0.01 |
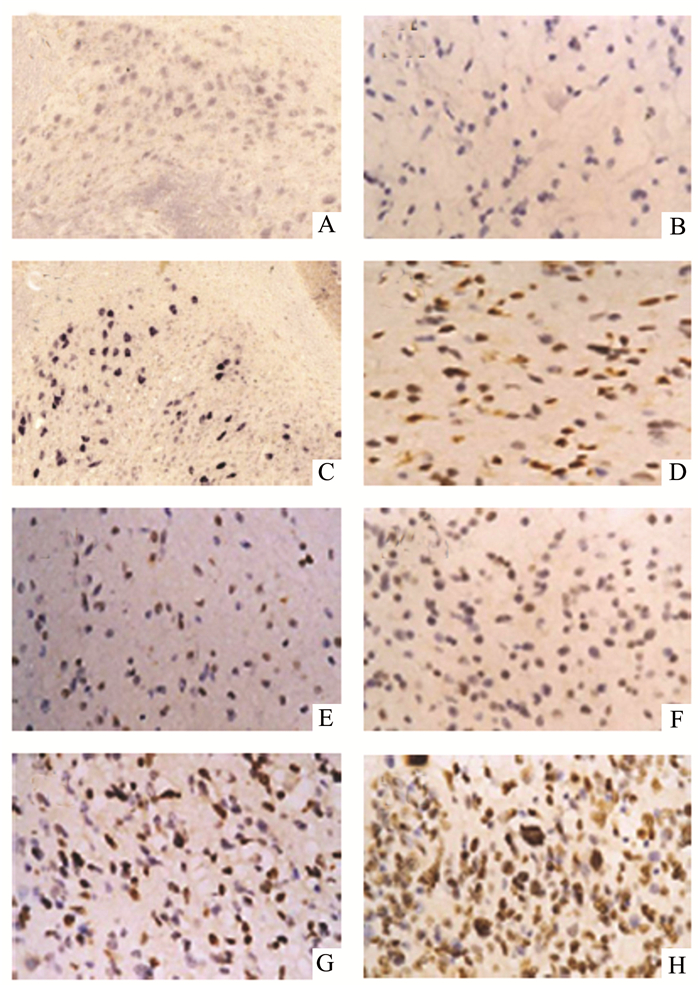
|
图 4 脑组织中NF-κB的表达(免疫组化×100) A-H分别为:对照、1 h、3 h、6 h、12 h、24 h、3 d、7 d组 |
|
图 5 脑组织中NF-κB的表达(阳性细胞比例) 与前一时间点比较,**P < 0.01 |
继发性脑损伤是发生在颅脑损伤后数小时到数天内的神经元损伤,是颅脑损伤患者致残和死亡的主要原因[11, 12]。在颅脑损伤后,多种机制介导了继发性脑损伤的病理变化,本研究通过大鼠建立脑损伤模型,研究大鼠的脑组织含水量、病理切片的变化、损伤脑组织周围的SOD活性以及GSH、MDA含量的变化,并且通过免疫组化比较了颅脑损伤后各个不同时间点TNF-α、NF-κB蛋白的表达情况,以初步探讨TNF-α以及NF-κB通路在颅脑损伤中的变化以及作用。
本研究采用Feeney[13]等建立的大鼠颅脑损伤模型法保证了外力撞击的范围以及深度的一致性,并且在颅脑损伤建立后,通过神经功能损伤评分量表对各组大鼠进行评分发现,各组大鼠之间神经功能评分差异无统计学意义(P>0.05),保证了实验组大鼠模型的一致性。
颅脑损伤后多种机制以及炎症介质介导了继发性脑损伤的病理变化,通过对各组脑组织含水量、病理切片、损伤脑组织周围的SOD活性以及GSH、MDA含量进行比较,我们发现与对照组相比,颅脑损伤组的大鼠的各项指标均较对照组显著升高,差异有统计学意义(P<0.05),并且各项指标的变化趋势基本一致,提示在颅脑损伤后,包括脑水肿、病理变化以及炎症反应等多种机制均在短时间内形成并快速发展,加重了脑损伤。
SOD、GSH是反映机体抗氧化应激能力的重要指标,MDA是反映机体氧自由基水平的可靠指标,能够提示机体脂质过氧化的程度[14, 15]。在本研究中,我们发现大鼠颅脑损伤后1 h开始,损伤灶周围的脑组织中MDA的含量显著升高,且在之后的时间内,持续升高,7 d时表达仍然高于对照组,而损伤组的SOD活性以及GSH的活力明显降低,在7 d时仍然低于对照组,提示颅脑损伤后,由于可清除自由基的酶活力下降,氧自由基的产生增多,脂质过氧化的水平增强,说明氧化应激在继发性脑损伤中起着重要的作用。
近年来越来越多的研究发现,TNF-α和NF-κB与颅脑外伤后继发性脑损伤有着密切的关系,研究者们发现TNF-α以及NF-κB在颅脑损伤后活性明显增强,并且其表达的变化规律与颅脑损伤后的临床症状表现一致[16],本研究发现,对照组的大鼠脑组织中的NF-κB水平较低,而颅脑损伤后NF-κB的水平立即升高,并且持续至第7天,提示NF-κB可能参与了脑损伤后的一系列病理生理的变化。TNF-α的变化趋势与NF-κB一致。提示在颅脑损伤的过程中,TNF-α和NF-κB均高表达,可能存在协同和激活的作用,加重了继发性的脑损伤。
综上所述,本研究发现颅脑损伤后,TNF-α和NF-κB的表达与脑损伤的临床表现变化趋势一致,提示其与急性脑损伤的关系密切,可能是多种信号通路相互作用的结果,其更深的机制还仍待进一步研究。
| [1] | You W, Zuo G, Shen H, et al. Potential dual role of nuclear factor-kappa B in experimental subarachnoid hemorrhage-induced early brain injury in rabbits[J]. Inflamm Res, 2016, 65(12): 975-984. DOI: 10.1007/s00011-016-0980-8. |
| [2] | Shin TH, Gong CB, Kim MS, et al. Development of a Cognitive Level Explanation Model in Brain Injury:Comparisons between Disability and Non-Disability Evaluation Groups[J]. J Korean Neurosurg Soc, 2010, 48(6): 506-517. DOI: 10.3340/jkns.2010.48.6.506. |
| [3] | Yallampalli R, Wilde EA, Bigler ED, et al. Acute white matter differences in the fornix following mild traumatic brain injury using diffusion tensor imaging[J]. J Neuroimaging, 2013, 23(2): 224-227. DOI: 10.1111/jon.2013.23.issue-2. |
| [4] | Kunz A, Dirnagl U, Mergenthaler P. Acute pathophysiological processes after ischaemic and traumatic brain injury[J]. Best Pract Res Clin Anaesthesiol, 2010, 24(4): 495-509. DOI: 10.1016/j.bpa.2010.10.001. |
| [5] |
李莉, 陈政, 欧阳文, 等. 前列地尔对脑死亡大鼠肝脏功能的保护及血清TNF-α和内皮素-1表达的影响[J].
中南大学学报:医学版, 2010, 35(12): 1272-1277.
Li L, Chen Z, Ouyang W, et al. Effect of alprostadil on hepatic injury of brain-dead rats and on serum TNF-α and endothelin-1 expression[J]. Journal of Central South University: Medical Sciences, 2010, 35(12): 1272-1277. |
| [6] | Chen J, Wu X, Shao B, et al. Increased expression of TNF receptor-associated factor 6 after rat traumatic brain injury[J]. Cell Mol Neurobiol, 2011, 31(2): 269-275. DOI: 10.1007/s10571-010-9617-6. |
| [7] | Ohtake F, Saeki Y, Ishido S, et al. The K48-K63 Branched Ubiquitin Chain Regulates NF-κB Signaling[J]. Mol Cell, 2016, 64(2): 251-266. DOI: 10.1016/j.molcel.2016.09.014. |
| [8] | Han S, Xu W, Wang Z, et al. Crosstalk between the HIF-1 and Toll-like receptor/nuclear factor-κB pathways in the oral squamous cell carcinoma microenvironment[J]. Oncotarget, 2016, 7(25): 37 773-37 789. |
| [9] | Khorooshi R, Babcock AA, Owens T. NF-kappaB-driven STAT2 and CCL2 expression in astrocytes in response to brain injury[J]. J Immunol, 2008, 181(10): 7284-7291. DOI: 10.4049/jimmunol.181.10.7284. |
| [10] | Anderson KJ, Scheff SW, Miller KM, et al. The phosphorylated axonal form of the neurofilament subunit NF-H (pNF-H) as a blood biomarker of traumatic brain injury[J]. J Neurotrauma, 2008, 25(9): 1079-1085. DOI: 10.1089/neu.2007.0488. |
| [11] | Homaifar BY, Harwood JE, Wagner TH, et al. Description of outpatient utilization and costs in group of veterans with traumatic brain injury[J]. J Rehabil Res Dev, 2009, 46(8): 1003-1010. DOI: 10.1682/JRRD.2008.12.0166. |
| [12] | Alexander T, Fuller G, Hargovan P, et al. An audit of the quality of care of traumatic brain injury at a busy regional hospital in South Africa[J]. S Afr J Surg, 2009, 47(4): 120-122. |
| [13] | Feeney TJ, Ylvisaker M, Rosen BH, et al. Community supports for individuals with challenging behavior after brain injury:an analysis of the New York state behavioral resource project[J]. J Head Trauma Rehabil, 2001, 16(1): 61-75. DOI: 10.1097/00001199-200102000-00008. |
| [14] |
张良, 杨晨, 潘树义, 等. 高压氧治疗对颅脑损伤大鼠谷胱甘肽过氧化物酶及丙二醛的影响[J].
中国医药导报, 2012, 18(9): 32-34.
Zhang L, Yang C, Pan SY, et al. The effect of hyperbaric oxygen on plasma levels of glutathione peroxidase and maleic dialdehyde after traumatic brain injury in rats[J]. China Medical Herald, 2012, 18(9): 32-34. |
| [15] | Hansel G, Ramos DB, Delgado CA, et al. The potential therapeutic effect of guanosine after cortical focal ischemia in rats[J]. PLoS One, 2014, 9(2): e90693. DOI: 10.1371/journal.pone.0090693. |
| [16] | Jayakumar AR, Tong XY, Ruiz Cordero R, et al. Activation of NF-kappaB Mediates Astrocyte Swelling and Brain Edema in Traumatic Brain Injury[J]. J Neurotrauma, 2014, 31(14): 1249-1257. DOI: 10.1089/neu.2013.3169. |
 2017, Vol. 38
2017, Vol. 38

