在体外受精-胚胎移植(in vitro fertilization-embryo transfer,IVF-ET)技术中,获得高质量胚胎对提高临床妊娠率非常重要。其中卵子质量是影响胚胎植入率和妊娠率的重要因素。评价卵子质量最客观的方法是形态学评估,卵子第一极体形态、卵周间隙、透明带、细胞质中的颗粒分布等,均可作为形态学的评估指标。目前已得到公认的是,形态好的MⅡ期卵子应该有一个清晰、颗粒均质的细胞质,合适的卵周间隙,完整的第一极体和颜色较浅的透明带。体外受精过程中在显微镜下常观察到一定比例的卵子透明带颜色呈现棕色,本研究对近年来所出现棕色透明带的卵子数据进行统计,分析导致棕色透明带的临床原因以及对后期妊娠结局的影响。
1 资料与方法 1.1 研究对象回顾性分析2011-2012年在湖北医药学院附属人民医院生殖医学中心进行IVF-ET治疗的患者共703例(排除反复IVF患者),年龄28-42岁,不孕年限2-8年,排除男方不育因素,不孕原因包括:输卵管性不孕468例,排卵障碍153例,子宫内膜异位症32例,免疫性不孕2例,原因不明25例,多囊卵巢综合征(PCOS) 23例。已排除因特殊原因取消移植的患者。根据卵子透明带的色泽分为棕色透明带组(A组)74例,正常卵子组(B组)629例(见图 1)。所有研究的卵母细胞均经患者同意并签署知情同意书。
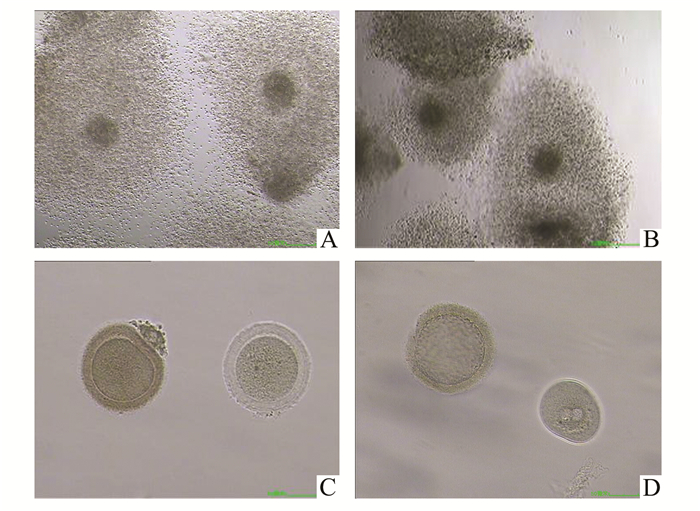
|
图 1 光镜下棕色透明带卵子形态学表现 A.正常卵子卵丘(×4); B.棕色卵子卵丘(×4); C.棕色卵子与正常卵子(×20); D.异常受精卵的棕色透明带(×20) |
所有患者均采用垂体降调节方案,于前次月经周期黄体期或本次月经周期第2天开始使用达必佳针剂(德国辉凌公司生产)0.05 mg/d垂体降调节,果那芬[卵泡刺激素(FSH),瑞士雪兰诺公司生产]或者果那芬联合绝经期促性腺激素(HMG,珠海丽珠公司生产)超促排卵,当超声监测直径达16-18 mm的卵泡超过3个的时候,停用FSH和HMG,于当晚肌肉注射人绒毛膜促性腺激素(hCG,珠海丽珠公司生产)5 000-10 000 IU,36 h后在阴道超声引导下穿刺取卵。
1.2.2 内分泌检测月经周期第3天(患者采血前3个周期均未使用激素治疗)和控制性超排卵(controlled ovarian hyperstimulation,COH)周期hCG注射日清晨抽取静脉血,应用DXI800全自动电化学发光免疫分析系统(美国贝克曼库尔特公司)进行血清激素[卵泡刺激素(FSH)、雌二醇(E2)、孕激素(P)、黄体生成激素(LH)]水平的测定。相应试剂盒购自武汉德高科技有限责任公司,操作按试剂盒说明书要求进行。
1.2.3 受精判断常规授精后,精卵共培养4-6 h后拆除卵子周围颗粒细胞观察第二极体有无排出,若所有卵子均未排除第二极体,判断为受精障碍,行补救性胞浆内单精子注射(intracytoplasmic sperm injection,ICSI),16-18 h后观察原核情况,若出现两原核判断为正常受精。
1.2.4 胚胎培养及妊娠判断受精后胚胎在体外培养24-48 h,于取卵后的第3天(D3)进行胚胎形态学评分:1级:卵裂球大小均匀,形状规则,透明带完整; 胞质均匀、清晰; 胚胎内碎片≤5%; 2级:卵裂球大小略不均匀,形状略不规则; 胞质可有颗粒现象; 碎片在6%-20%之间; 3级:卵裂球大小明显不均匀,可有明显的形状不规则; 胞质可有明显颗粒现象; 碎片在21%-50%之间; 4级:细胞大小严重不均匀; 胞质可有严重颗粒现象; 碎片在50%以上。1-3级的胚胎均为可用胚胎,优先选择卵裂球均匀、碎片少的胚胎,移植胚胎数最多不超过3个,B超引导宫腔内移植。妊娠标准为胚胎移植后第14天查尿hCG阳性为生化妊娠,临床妊娠为第4周B超检查有胎心搏动。
1.3 统计学方法应用SPSS 13.0软件进行数据录入和处理,计数资料用率(%)表示, 组间比较用χ2检验, 计量资料用均数±标准差(x±s)表示, 组间比较用t检验, P<0.05为差异有统计学意义。
2 结果 2.1 两组患者一般情况比较A组平均年龄、体质量指数(BMI)、不孕年限、不孕原因与B组比较,差异均无统计学意义(P>0.05)。见表 1。
| 表 1 A组与B组临床特征比较[n(%)] |
两组D3基础内分泌水平、平均Gn天数、hCG日血清雌二醇(E2)、黄体生成激素(LH)、孕激素(P)水平差异无统计学意义(P>0.05);两组相比A组平均Gn用量、hCG日血清FSH水平显著高于B组(P<0.05)。见表 2。
| 表 2 A组与B组促排过程比较(x±s) |
两组共获卵6 960个,成熟卵共5 916个,优质胚胎共2 840个。两组的平均获卵数、成熟卵率、受精率、补救ICSI率、可用胚胎率差异没有统计学意义(P>0.05); A组平均透明带厚度大于B组(P<0.05),优质胚胎率、临床妊娠率明显低于B组(P<0.05)。见表 3。
| 表 3 棕色卵子与正常卵子的受精结局比较(x±s) |
卵子形态异常分为细胞质异常和细胞质外异常,前者包括细胞质的颗粒排列、滑面内质网、液化泡等异常,后者包括卵子形状的不规则、卵周间隙的增大、卵周间隙碎片的存在、第一极体碎片、卵膜黏度异常和透明带颜色、形状厚度的异常。无论是自然周期还是促排卵周期,人类卵泡的生长发育过程都需要经历了原始卵泡-初级卵泡-次级卵泡-成熟卵泡4个阶段,在这个过程中,每一个环节异常都有可能造成卵泡发育阻滞及卵子形态异常。
棕色卵子与正常卵子相比其透明带色泽发生了异常改变,呈现棕色半透明状,目前对于其形成原因和机制文献报道并不多见,本研究发现其与患者年龄和不孕年限、不孕原因等并没有明显关系,说明与患者本身临床特征没有明显关系,可能与受外界因素刺激有关。
在IVF过程中需要对患者使用外源性FSH进行COH才能得到足够多的卵子,形成胚胎后进行选择性移植。外源性FSH可以影响颗粒细胞的生长分化和卵泡的发育,适合的剂量可以保持卵子和颗粒细胞基因的正常表达,促进卵泡生长和颗粒细胞分化,但高剂量的FSH可以干扰窦卵泡期的卵子和颗粒细胞的某些基因表达,导致颗粒细胞功能异常,进而影响卵子发育[1]。研究表明,COH可能导致卵泡中卵丘过早熟、分散,IVF-ET周期中大量外源激素非自然状态下的刺激可能会导致包括透明带、卵胞浆及极体等卵子形态的异常,这可能与COH过程中使用了大量的外源性FSH有关[2]。Li等[3]研究表明外源性给予不同浓度的FSH对卵子和胚胎产生的效应不同,高FSH水平可降低卵子质量和胚胎质量,而在本研究中棕色卵子组透明带色泽属非正常颜色,从卵丘形态上观察,正常成熟卵丘颗粒细胞疏松,颜色较浅(见图A),棕色卵丘多数颗粒细胞分散较好,但颜色偏深,呈轻度凝集状态(见图B),卵子成熟率又较正常颜色卵子成熟率略高,颗粒细胞可能已早熟。而FSH作用于颗粒细胞,影响颗粒细胞的生长分化和卵泡发育,颗粒细胞在卵子发育成熟中起重要的营养及信号传导作用,同时卵子对颗粒细胞的分化及发育也起中心调节作用,透明带是颗粒细胞和卵子中间连接的桥梁,穿透透明带的胞浆突起在卵丘细胞和卵子表面形成了大量的缝隙连接,氨基酸、核苷酸等低分子底物由颗粒细胞和卵丘细胞通过缝隙连接进入卵子,为卵子提供营养物质,促进后期的发育。透明带的主要成分是糖蛋白,在初级卵子向成熟卵子的发育过程中由卵细胞和颗粒细胞分泌产生。透明带蛋白与穿过卵丘细胞的获能精子相结合,诱发顶体反应,最终促进精卵结合,防止多精受精。Rankin等[4]通过定点突变敲除透明带蛋白基因发现卵子周围透明带结构松散,卵周隙变大,卵子周围颗粒细胞分布不均匀,卵子透明带基质不完整。在COH中,常观察到的异常透明带形态主要有透明带增厚或较薄,密度不均,厚薄不均匀以及透明带粗糙等,提示卵细胞及颗粒细胞中透明带蛋白合成异?蚍置诠δ芤斐?sup>[5]。因此据本研究结果推测,棕色透明带的形成原因可能是持续大量的外源性FSH进入卵泡液引起卵细胞及颗粒细胞中透明带蛋白合成异常或分泌功能异常,最终使颗粒细胞早熟、过度分散、凝集和透明带发生异常,也可能是由于卵子内部透明带蛋白合成异常导致的。
在人类配子受精过程中精子必须通过透明带结合,穿越透明带与卵膜融合才能达到受精的目的,也有不同的解释透明带对受精的影响,一种是透明带的厚度增加使精子向胞浆的迁移距离更远,以至于精子到达卵浆前失去动力,但是本中心并没有观察到由于透明带厚度不同造成的受精率差异,且本研究中的棕色卵子透明带平均厚度明显较对照组高,但并未影响体外受精的受精率和卵裂率,这与文献[6]是一致的。另外,本研究两组补救ICSI率也没有明显差异,进一步证实对受精的完成是没有影响的。有研究表明,异常形态的卵子并未被证实影响受精率、胚胎质量或种植率[7]。棕色卵子中胞质异常和胞浆外异常并不影响卵裂率、胚胎质量,也没有发现刺激方案、卵泡数量和获卵数对结局的影响[6]。有文献报道,卵子形态并不能预测胚胎发育潜能,除非极端的形态异常[8]。本研究发现,棕色卵子的优质胚胎率较低,但可利用胚胎率无显著差异; 棕色卵子所形成的Ⅲ级胚胎居多,而移植的胚胎均是棕色卵子,从卵裂球形态上评估均是可利用胚胎,妊娠率明显比正常的卵子形成胚胎低,这与文献[9]报道一致,说明棕色卵子透明带颜色异常可能影响胚胎卵裂导致发育潜能低下。由于本研究只选择棕色程度较严重的卵子,色泽稍浅的并未纳入,且所用的方案以及对卵子的评判标准不同,因此可能导致研究结果与文献不同。
总之,通过以上分析,在促排卵过程中棕色卵子透明带色泽改变,其原因与患者年龄、体质量指数、不孕原因等没有明显的关系,而与促排卵中使用FSH和血清FSH浓度有关,血清高浓度FSH可能造成的透明带颜色异常,最终导致胚胎发育潜能低下。因此,在临床COH过程中,为获得高质量的卵子和胚胎以及更好的子宫种植环境,掌握促排卵药物的适当剂量是至关重要的。
| [1] | Sánchez F, Adriaenssens T, Romero S, et al. Different follicle-stimulating hormone exposure regimens during antral follicle growth alter gene expression in the cumulus-oocyte complex in mice[J]. Biol Reprod, 2010, 83(4): 514-524. DOI: 10.1095/biolreprod.109.083311. |
| [2] | O'Callaghan D, Yaakub H, Hyttel P, et al. Effect of nutrition and superovulation on oocyte morphology, follicular fluid composition and systemic hormone concentrations in ewes[J]. J Reprod Fertil, 2000, 118(2): 303-313. |
| [3] | Li M, Zhao Y, Zhao CH, et al. High FSH decreases the developmental potential of mouse oocytes and resulting fertilized embryos, but does not influence offspring physiology and behavior in vitro or in vivo[J]. Hum Reprod, 2013, 28(5): 1309-1323. DOI: 10.1093/humrep/det014. |
| [4] | Rankin T, Talbot P, Lee E, et al. Abnormal zonae pellucidae in mice lacking ZP1 result in early embryonic loss[J]. Development, 1999, 126(17): 3847-3855. |
| [5] | Monné M, Han L, Jovine L. Tracking down the ZP domain: From the mammalian zona pellucida to the molluscan vitelline envelope[J]. Semin Reprod Med, 2006, 24(4): 204-216. DOI: 10.1055/s-2006-948550. |
| [6] | Esfandiari N, Burjaq H, Gotlieb L, et al. Brown oocytes: implications for assisted reproductive technology[J]. Fertil Steril, 2006, 86(5): 1522-1525. DOI: 10.1016/j.fertnstert.2006.03.056. |
| [7] | Esfandiari N, Ryan EA, Gotlieb L, et al. Successful pregnancy following transfer of embryos from oocytes with abnormal zona pellucida and cytoplasm morphology[J]. Reprod Biomed Online, 2005, 11(5): 620-623. DOI: 10.1016/S1472-6483(10)61171-6. |
| [8] | Balaban B, Ata B, Isiklar A, et al. Severe cytoplasmic abnormalities of the oocyte decrease cryosurvival and subsequent embryonic development of cryopreserved embryos[J]. Hum Reprod, 2008, 23(8): 1778-1785. DOI: 10.1093/humrep/den127. |
| [9] | Shi W, Xu B, Wu LM, et al. Oocytes with a Dark Zona Pellucida Demonstrate Lower Fertilization, Implantation and Clinical Pregnancy Rates in IVF/ICSI Cycles[J]. PLoS One, 2014, 9(2): e89409. DOI: 10.1371/journal.pone.0089409. |
 2016, Vol. 37
2016, Vol. 37

