呼吸道合胞病毒(respiratory syncytial virus, RSV)属副黏病毒科,肺病毒属,单股负链RNA病毒,是婴幼儿和儿童季节性上呼吸道感染常见的病原体,也是世界范围内引起儿童下呼吸道病毒感染性疾病的最常见原因,表现为毛细支气管炎和病毒性肺炎。RSV感染在老年和免疫功能不全的人群中具有很高的发病率及死亡率[1, 2]。
利巴韦林(ribavirin)是一种人工合成的鸟苷类衍生物,为单磷酸次黄嘌呤核苷(IMP)脱氢酶抑制剂,通过抑制IMP阻碍病毒核酸的合成,但对病毒无直接灭活作用。体内外研究已证实它对RSV复制有很强的抑制作用[3]。美国儿科学会不推荐常规使用利巴韦林,但在严重RSV感染或具有高危因素的RSV感染患儿可以考虑应用[4]。回顾性研究表明,造血干细胞移植及实体器官移植者RSV感染时,无论口服、雾化吸入及静脉使用利巴韦林均可以降低疾病的风险[1, 4, 5]。由于其对多种RNA、DNA病毒有效,在临床上得到了广泛应用。虽然利巴韦林能够有效的抑制RSV复制,但能否调节细胞凋亡从而影响疾病的病理过程尚不清楚。本文通过研究利巴韦林干预后RSV感染的A549细胞pAKT、AKT、IκBα、Bcl-2、Bax蛋白表达的变化,进一步认识利巴韦林的作用机制,为临床应用提供一些新的思路。
1 材料与方法 1.1 实验材料人肺腺癌细胞A549由武汉大学中南医院医学科学研究中心保存,RSV A2株来源于美国典型培养物保藏中心(ATCC),利巴韦林注射液(湖北天药药业,批号:11312151),Phospho-Akt (Ser473)兔抗人单克隆一抗、Akt兔抗人单克隆一抗、IκBα兔抗人单克隆一抗、Bax兔抗人单克隆一抗、Bcl-2兔抗人单克隆一抗、β-actin兔抗人单克隆一抗及辣根过氧化物酶标记羊抗兔二抗(Cell Signaling Technology)。
1.2 实验方法 1.2.1 细胞培养与病毒增殖将A549细胞培养于含10%胎牛血清及双抗(青霉素100 U/ml、链霉素100 μg/ml)的DMEM高糖培养基中,置于37 ℃,5%CO2培养箱中培养,待细胞长满单层时进行传代。取对数生长期细胞接种于6孔板中,待细胞融合至80%时进行分组处理。
待A549细胞生长至60%融合时接种RSV A2株,室温摇床吸附60 min后加入含2%胎牛血清的DMEM培养基,置于37 ℃,5%CO2培养箱培养3-5 d。待90%细胞出现融合病变后,反复冻融3次收获病毒原液。留取部分测病毒滴度其余分装冻存备用。
1.2.2 病毒感染及药物处理细胞维持液为含2%胎牛血清的DMEM培养基,病毒接种液与含药液均用细胞维持液稀释,对照液为含与病毒原液等量的PBS的细胞维持液。本研究结合文献报道的利巴韦林体外抗RSV的最佳作用浓度、作用环节及利巴韦林对A549细胞的最大无毒浓度,采用100 μg/ml终浓度的利巴韦林进行实验[3]。
将A549细胞分为4个组:①细胞对照组(C组):接种对照液,37 ℃,5%CO2培养箱内吸附1 h,弃对照液,加入不含利巴韦林的细胞维持液继续培养。②利巴韦林组(Rib组):接种对照液,37 ℃,5%CO2培养箱内吸附1 h,弃对照液,加入含利巴韦林的细胞维持液培养。③呼吸道合胞病毒组(RSV组):接种含RSV (MOI=3)的病毒液,37 ℃,5%CO2吸附1 h,弃接种的病毒液,加入不含利巴韦林的细胞维持液培养。④利巴韦林干预组(RR组):接种含RSV (MOI=3)的病毒液,37 ℃,5%CO2吸附1 h, 弃接种的病毒液,加入含利巴韦林的细胞维持液培养。各组实验同时进行,在RSV感染后的1, 2, 4, 12, 24 h收集RSV组和RR组培养上清,空斑实验检测各时间点病毒滴度;收集各组细胞,应用Western-blot技术检测pAKT、AKT、IκBα、Bcl-2、Bax蛋白的表达。
1.2.3 病毒滴度测定将A549细胞按照5×105/ml密度接种于12孔板,每孔1 ml。置37 ℃,5%CO2培养箱培养,待细胞生长至单层后,吸去培养基,PBS清洗2次,每孔加入维持液500 μl。用2%DMEM (维持液)10倍倍比稀释病毒原液。每孔加入50 μl稀释好的病毒原液,每个稀释度做2个复孔,充分混匀后置于37 ℃,5%CO2培养箱中吸附2 h。弃吸附液,每孔添加覆盖层(3%琼脂糖)1 ml,置于37 ℃,5%CO2培养箱中培养3-4 d,之后每孔添加约2 ml的1%甲醛。固定过夜使其充分渗透到覆盖层,固定时间至少24 h。剔除覆盖层,每孔添加0.05%中性红溶液2 ml,室温染色1-24 h后吸掉染液,用自来水清洗,室温干燥,计数红色背景中没有着色的“空斑”。由于每个空斑由单个病毒颗粒复制形成,病毒悬液的滴度用每毫升空斑形成单位(pfu)来表示。
1.2.4 免疫印记(Western blot)提取细胞总蛋白,加入蛋白上样缓冲液,100 ℃变性5 min,BCA法测定蛋白浓度。配制12%分离胶及5%浓缩胶进行蛋白电泳,转膜200 mA,90 min。一抗孵育过夜,辣根过氧化物酶标记二抗(1:5 000), 室温摇床90 min,ECL发光、压片、显影和定影。扫描图像,定量分析光密度值。以目的条带与β-actin光密度比值作为目的条带的相对表达量。
1.2.5 统计学分析采用SPSS 17.0软件进行统计学分析。实验数据以均数±标准差(x±s)表示,两组间比较采用t检验,P<0.05认为差异有统计学意义。
2 结果 2.1 RSV组和RR组培养上清中病毒滴度变化RSV组病毒滴度持续升高,24 h升至1.0×105 pfu/ml;而RR组在培养的24 h内,病毒滴度较低,在1.0×103-1.1×103pfu/ml之间波动(图 1)。提示利巴韦林可以有效的抑制RSV复制。
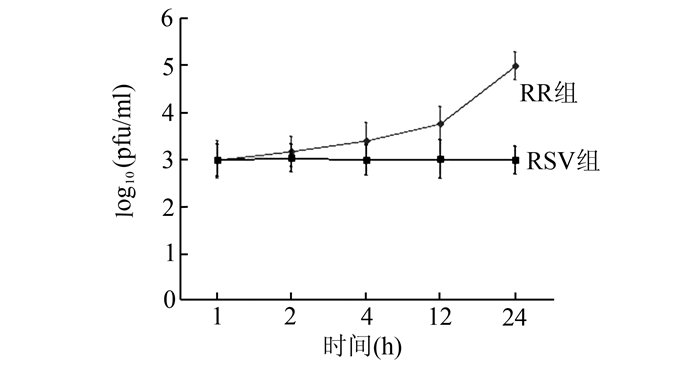
|
图 1 RSV组和RR组培养上清中病毒滴度的变化 |
Rib组与C组相比,pAKT、AKT、IκBα、Bcl-2、Bax蛋白表达变化不显著,差异无统计学意义(P>0.05)。说明利巴韦林对正常A549细胞中的pAKT、AKT、IκBα、Bcl-2、Bax蛋白表达没有影响(图 2)。
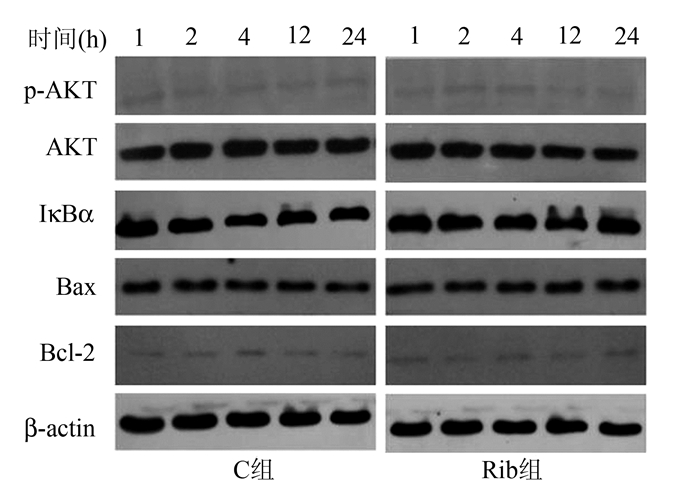
|
图 2 C组和Rib组pAKT、AKT、IκBα、Bcl-2、Bax蛋白的表达水平 |
AKT蛋白在RSV组和RR组中表达恒定。RSV组,随着病毒感染时间的延长,pAKT蛋白的表达在1 h达到高峰,2 h略下降,2-24 h内表达变化不明显。RR组,随着利巴韦林干预时间的延长,pAKT表达显著增加,在2 h升高最明显,2,4,12,24 h表达均高于RSV组,差异有统计学意义(P<0.05)(图 3)。显示利巴韦林作用后可上调pAKT蛋白表达,并在24 h内持续高表达。
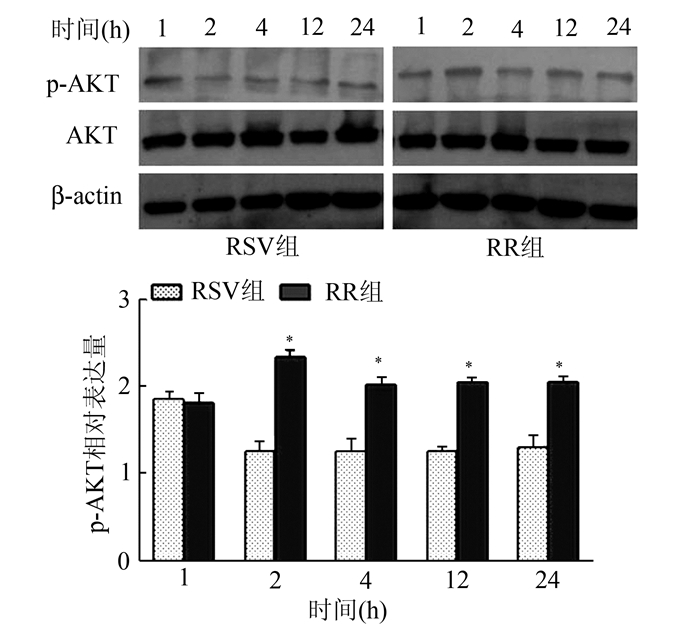
|
图 3 RSV组和RR组pAKT、AKT蛋白的表达水平 RSV组比,*P<0.05 |
RSV组,随着病毒感染时间的延长,IκBα蛋白表达逐渐增加。RR组,IκBα蛋白表达无明显变化,2 h表达与RSV组相比,差异无统计学意义(P>0.05),4,12,24 h表达均低于RSV组,差异有统计学意义(P<0.05)(图 4)。显示利巴韦林作用后可以抑制IκBα蛋白的表达。
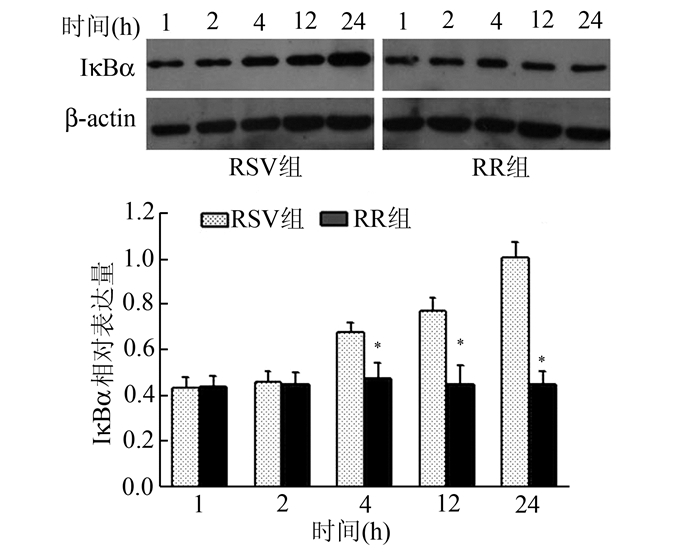
|
图 4 RSV组和RR组IκBα蛋白的表达水平 与RSV组比,*P<0.05 |
RSV组,随着病毒感染时间的延长Bax蛋白表达逐渐增加,4 h达到高峰,4 h至24 h表达无明显变化。RR组Bax蛋白表达明显减少,在2, 4, 12, 24 h表达均低于RSV组,差异有统计学意义(P<0.05)(图 5A)。RSV组Bcl-2蛋白表达先升高后降低,4 h增加最明显。RR组Bcl-2蛋白12 h、24 h表达高于RSV组,差异有统计学意义(P<0.05)(图 5B)。显示利巴韦林作用后可抑制Bax蛋白的表达,促进Bcl-2蛋白表达。
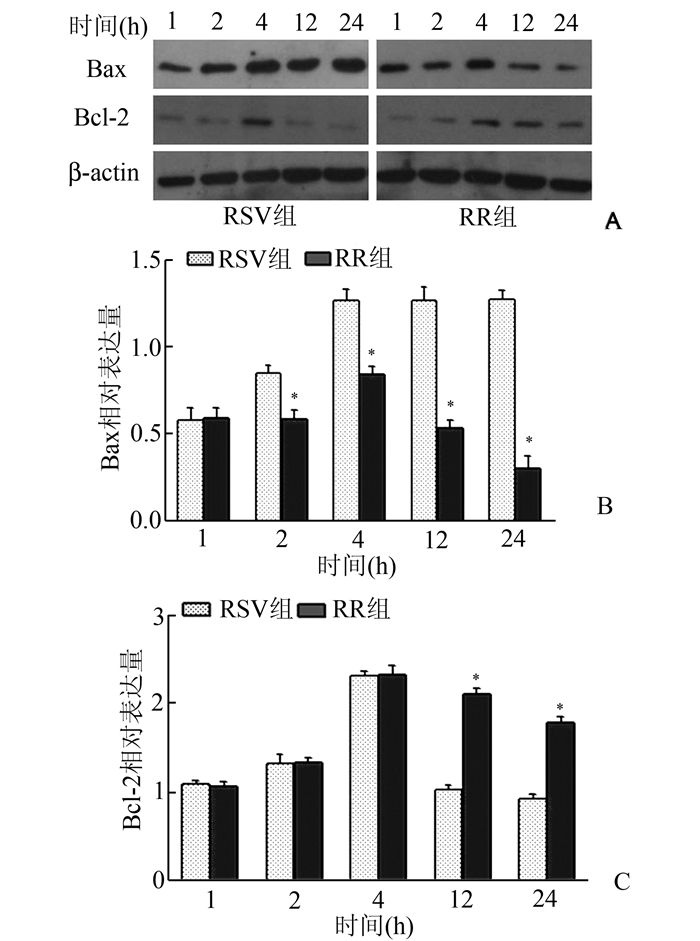
|
图 5 RSV组和RR组Bcl-2、Bax蛋白的表达水平 与RSV组比, *P<0.05 |
PI3-K/AKT信号转导途径在细胞凋亡、存活、增殖以及细胞骨架变化的生物学功能中具有重要的调节作用,是细胞内重要的信号转导通路。PI3-K/AKT通路可以通过激活其下游诸多抗凋亡因素如:NF-κB、Bcl-2、Bcl-xL等,同时抑制一系列促凋亡因素如:FasL、caspase、Bax、p53等起到抗细胞凋亡的作用,Akt-NF-κB是其中一条重要的途径。本研究发现利巴韦林作用1 h即可引起pAKT蛋白表达增加,并在24 h内持续高表达。提示在RSV感染A549细胞的24 h内,利巴韦林作用后可使PI3-K/AKT通路持续激活。AKT激活后可以活化IκB激酶(IκB kinase, IκK),从而使IκB磷酸化。IκB (inhibitor of nuclear factor kappa-B)是核因子kappaB (nuclear factor kappa-B,NF-κB)的抑制蛋白,其中IκBα是IκB家族中抑制NF-κB活性的最重要成分。在静息状态下,IκBα与NF-κB杂二聚体以结合形式位于细胞质中,抑制NF-κB的核转位。当各种刺激因子(如病毒蛋白、细胞因子、脂多糖、氧自由基)刺激细胞时,IκB激酶复合物被级联信号迅速激活。活化的IκK能磷酸化IκBα N端的32、36位丝氨酸残基,磷酸化的IκBα(Phospho-IκBα)21、22位赖氨酸被泛素连接酶泛素化,已磷酸化并泛素化的IκBα进而被26S蛋白小体降解并脱离NF-κB。IκBα的降解使NF-κB的核定位信号(nuclear localization dignal,NLS)暴露,促进NF-κB磷酸化及核转位。IκBα不仅可以抑制NF-κB的活化,还可反馈调节NF-κB系统。IκBα主要结合NF-κB的P65和P50亚基,当IκBα被磷酸化后分解,P65和P50亚基才能解离激活,P65活化后又可以上调IκBα的表达[6-8]。所以当刺激开始的时候IκBα下调,经过一定时间之后IκBα恢复,并与NF-κB结合使之失活。Lindemans等研究发现RSV (MOI=5)感染中性粒细胞10 min和30 min后均有IκBα的显著降解,从而导致NF-κB的激活[9]。本研究发现利巴韦林作用后可以抑制IκBα蛋白的表达。提示利巴韦林在作用后可能抑制P65对IκBα的反馈调节,使NF-κB通路持续激活而发挥抗凋亡作用。
NF-κB激活后可通过上调抗凋亡基因(如Bcl-2家族)的表达,抑制细胞凋亡的线粒体途径或死亡受体途径。Bcl-2蛋白家族(Bcl-2 family of proteins)是调节线粒体通透性的主要成分,通过形成同源和异源二聚体对细胞凋亡进行调控。Bcl-2/Bax异源二聚体抑制细胞凋亡,Bax/Bax同源二聚体促进细胞凋亡。本研究发现利巴韦林作用后可抑制Bax蛋白的表达,促进Bcl-2蛋白表达。说明利巴韦林可以上调抗凋亡基因Bcl-2、下调凋亡基因Bax,从而抑制RSV感染的宿主细胞发生凋亡。
有研究表明RSV感染A549细胞后8 h虽可以检测到细胞凋亡,但细胞在24 h才出现明显凋亡[10]。本研究在RSV感染A549细胞后加入利巴韦林,证实利巴韦林可以激活AKT-NF-κB途径、上调Bcl-2、下调Bax蛋白表达,有利于A549细胞朝着生存的方向发展。说明利巴韦林的抗病毒作用,不仅表现在可以抑制RSV的复制,同时可以保护RSV感染的宿主细胞并有利于其存活,避免了宿主组织细胞发生严重损伤,限制了疾病的病理过程,为利巴韦林的临床应用价值提供了有利依据。
| [1] | Neemann K, Freifeld A. Respiratory Syncytial Virus in Hematopoietic Stem Cell Transplantation and Solid-Organ Transplantation[J]. Curr Infect Dis Rep, 2015, 17(7): 490. |
| [2] | Gomez RS, Guisle-Marsollier I, Bohmwald K, et al. Respiratory Syncytial Virus: pathology, therapeutic drugs and prophylaxis[J]. Immunol Lett, 2014, 162(1 Pt A): 237-247. |
| [3] | Zhang Y, Jamaluddin M, Wang S, et al. Ribavirin treatment up-regulates antiviral gene expression via the interferon-stimulated response element in respiratory syncytial virus-infected epithelial cells[J]. J Virol, 2003, 77(10): 5 933-5 947. DOI: 10.1128/JVI.77.10.5933-5947.2003. |
| [4] | Turner TL, Kopp BT, Paul G, et al. Thompson R. Respiratory syncytial virus: current and emerging treatment options[J]. Clinicoecon Outcomes Res, 2014, 6: 217-225. |
| [5] | Chemaly RF, Shah DP, Boeckh MJ. Management of respiratory viral infections in hematopoietic cell transplant recipients and patients with hematologic malignancies[J]. Clin Infect Dis, 2014, 59(Suppl 5): S344-S351. DOI: 10.1093/cid/ciu623. |
| [6] | Hayden MS, Ghosh S. Shared Principles in NF-κB Signaling[J]. Cell, 2008, 132(3): 344-362. DOI: 10.1016/j.cell.2008.01.020. |
| [7] | Kanarek N, Ben-Neriah Y. Regulation of NF-kappaB by ubiquitination and degradation of the IkappaBs[J]. Immunol Rev, 2012, 246(1): 77-94. DOI: 10.1111/j.1600-065X.2012.01098.x. |
| [8] | Hinz M, Arslan SC, Scheidereit C. It takes two to tango: IkappaBs, the multifunctional partners of NF-kappaB[J]. Immunol Rev, 2012, 246(1): 59-76. DOI: 10.1111/j.1600-065X.2012.01102.x. |
| [9] | Lindemans CA, Coffer PJ, Schellens IM, et al. Respiratory syncytial virus inhibits granulocyte apoptosis through a phosphatidylinositol 3-kinase and NF-kappaB-dependent mechanism[J]. J Immunol, 2006, 176(9): 5 529-5 537. DOI: 10.4049/jimmunol.176.9.5529. |
| [10] | Bitko V, Shulyayeva O, Mazumder B, et al. Nonstructural proteins of respiratory syncytial virus suppress premature apoptosis by an NF-kappaB-dependent, interferon-independent mechanism and facilitate virus growth[J]. J Virol, 2007, 81(4): 1 786-1 795. DOI: 10.1128/JVI.01420-06. |
 2016, Vol. 37
2016, Vol. 37

