B细胞分泌免疫球蛋白(Ig)是哮喘过敏反应的核心机制之一。其表达水平异常与哮喘的严重程度相关。其中,除IgE与哮喘的相关性,IgG1水平增高[1]介导的过敏反应也可能是其重要免疫机制,有研究发现IgE与IgG1介导的体液免疫与过敏的发生相关[2]。本研究通过观察哮喘患者B细胞分泌免疫球蛋白IgG1表达水平在不同严重程度支气管哮喘患者急性发作期与正常人对比的差异,以及治疗后是否下降,并分析IgG1与患者肺功能指标(FEV1/FVC、FEV1/Pre)之间的相关性,从而明确IgG1在哮喘中的表达分化水平,探讨IgG1是否与哮喘临床症状的发生相关,是否与哮喘严重程度相关,进一步明确B细胞介导的细胞免疫在哮喘中的作用机制,为指导临床治疗提供基础。
1 材料与方法 1.1 健康志愿者和支气管哮喘患者入选标准及治疗方案健康对照组的入选标准为:近4周内无急性感染病史并且肺功能正常,无慢性气道疾病史、无哮喘疾病史、非过敏体质、无其他全身免疫异常及肿瘤疾病史。支气管哮喘患者入选标准为:4周内无急性感染史和未接受全身或吸入糖皮质激素治疗且存在典型哮喘临床表现、支气管激发或舒张试验阳性、过敏源皮试阳性、血清总IgE升高、外周血嗜酸性粒细胞增多、无其他全身免疫异常及肿瘤疾病史。按照全球哮喘防治倡议委员会(GINA)2011年颁发的《支气管哮喘处理与预防全球策略》,支气管哮喘患者接受规范吸入或全身糖皮质激素治疗5-7 d后入选治疗组。所有入选者均需填写知情同意书。
支气管哮喘患者入组共31例,其中男性14例,女性17例,平均年龄(40.78±9.88)岁,来自我院住院或门诊患者, 其严重程度按照我国哮喘防治指南分级。健康志愿者入组共42例,其中男性19例,女性23例,平均年龄(43.38±11.34)岁,均来自我院体检科,病例采集时间为2013年6月-2014年5月。
1.2 肺功能测定所有病例肺功能测定均采用Vmax229型肺功能仪(USA)检测肺功能,记录第一秒用力呼气容积(FEV1)占用力肺活量百分比(FEV1/FVC)和FEV1占预计值百分比(FEV1/Pre)。
1.3 流式细胞术鉴定人外周血中B细胞水平在未治疗前,抽取健康对照组及急性发作期哮喘患者外周血样本。每份样本需采用肝素钠抗凝试管抽取约5-8 ml静脉血,室温下以800 r/min离心8 min后取上清液后冻存。然后以PBS稀释后按Ficoll淋巴细胞分离液(Nycomed, Norway)产品说明书分离PBMCs。后收集洗涤细胞PE-抗人CD19(eBioscience,USA),PE标记的兔IgG2a (eBioscience,USA)作为同型对照。孵育40 min并洗涤细胞,用固定剂(eBioscience, USA)固定后采用流式细胞仪鉴定淋巴细胞中CD19+B细胞表达比例。
1.4 ELISA法鉴定人外周血血清中IgG1分泌水平收集、冻存受试者外周血血清,用ELISA试剂盒(eBioscience,USA)按说明方法检测所有样本IgG1的分泌水平,共重复检测3次。IgG1的检测浓度范围为0.16-10 μg/ml。
1.5 统计学分析统计学数据使用SPSS 13软件进行处理,数据以均数±标准差表示。对于两组间计量资料分析,方差齐者采用t检验,对于前后对照采用配对t检验。对于两组之间的率的比较,统计学差异采用卡方检验进行分析。相关性分析采用Pearson分析。
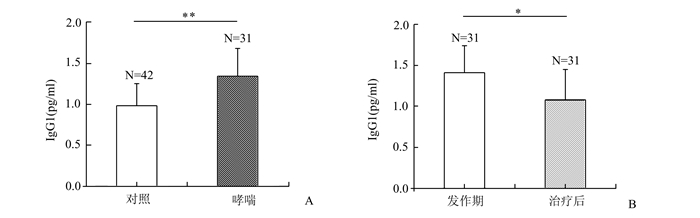
2 结果 2.1 哮喘患者急性发作及治疗后血清中IgG1表达水平与正常组相比较,哮喘患者急性发作期血清中IgG1水平显著升高(P<0.01)(图 1A)。在治疗5-7 d后,IgG1显著下降(P<0.05)(图 1B)。
|
图 1 哮喘患者急性发作及治疗后血清中IgG1表达水平 |
不同严重程度哮喘患者急性发作期血清中IgG1表达水平、B细胞表达水平与肺功能水平见表 1。
| 表 1 不同严重程度哮喘患者急性发作期IgG1、B细胞表达、肺功能测定 |
重度哮喘患者急性发作期血清中IgG1水平显著高于中度和轻度(P<0.01),中度哮喘患者急性发作期血清中IgG1水平显著高于轻度组(P<0.01,见表 1)。
2.3 哮喘患者血清中IgG1分泌水平与B细胞分化水平呈正相关关系哮喘组患者急性发作期血清IgG1水平与患者淋巴细胞中CD19+B细胞水平呈显著正相关(r为0.713,P<0.01)。
2.4 哮喘患者血清中IgG1分泌水平与肺功能水平呈负相关哮喘组患者急性发作期血清IgG1水平与患者肺功能FEV1/FVC及FEV1/Pre呈显著负相关(r分别为-0.642,P均<0.05)。
3 讨论过敏导致的气道高反应是哮喘发病的重要环节,B细胞介导的体液免疫参与了哮喘的发病过程,其中, 免疫球蛋白IgE的参与是重要致病因子。但随后研究发现,在IgE特异性缺失的小鼠模型上仍然出现了强有力的过敏反应,提示致敏的多途径,并在该小鼠模型上发现特异性IgG的升高,推测抗原特异性IgG的升高与该过敏反应的出现相关[4, 5]。目前进一步研究发现,在特异性血清IgG中,其在过敏性哮喘的发生中扮演的角色存在不同。有研究发现IgG4能够负向调节过敏反应[6],而过敏性哮喘患者血清IgG1水平明显升高,与过敏反应严重程度可能呈平行关系[2, 3],推测其参与哮喘症状的产生。
在抗原诱导下,树突状细胞(DC)递呈抗原并活化Th2细胞, B淋巴细胞在活化的Th2细胞诱导下,分泌抗原特异性IgG1,其与DC上的FcγRs结合,形成IgG1抗原复合物,迅速促进过敏反应的发生,是目前IgG1触发过敏反应的可能途径[1]。小鼠过敏模型中,阻断FcγRs导致IgG1分泌下降[7]减轻过敏反应印证该途径的可能。从我们搜集的31例过敏性哮喘患者血清IgG1水平的上升可以看出,在人体中IgG1参与哮喘过敏反应的发生,这与部分既往研究结果[2, 3]相似。而我们随后的研究,监测哮喘患者进行5-7 d治疗后血清IgG1水平,发现其明显下降,进一步说明血清IgG1参与哮喘急性发作期症状的发生。并且我们发现哮喘患者IgG1分泌水平及血清B淋巴细胞数量随着哮喘严重程度的上升而明显上升,尤其在中、重度哮喘患者中,其上升更显著,提示,IgG1水平与哮喘症状严重程度平行。监测IgG1血清水平的可能有助于评估哮喘的治疗效果。
同时,我们在相关性研究中发现,IgG1分泌水平及血清B淋巴细胞数量呈正相关,而血清中IgG1分泌水平与肺功能水平呈负相关。更进一步说明,哮喘患者血清IgG1水平越高,气道阻塞越明显,哮喘发生程度越严重。提示临床预后不良。通过动态监测血清IgG1水平,可能有助于评估哮喘的严重程度、复发及预后。
IgG1分泌异常存在于多种自身免疫性疾病[8],如系统系红斑狼疮、类风湿性关节炎、自身免疫性肝炎等,近几年发现其在过敏性疾病中亦相当重要。本研究通过对不同严重程度过敏性哮喘患者治疗前后血清IgG1水平及肺功能FEV1进行评估,进一步明确其参与哮喘的发生,与哮喘严重程度及治疗效果相关。但IgG1与IgE在过敏哮喘中是否存在相关性,与B淋巴细胞、Tfh的关系,仍需进一步研究。
| [1] | Williams JW, Tjota MY, Sperling AI. The contribution of allergen-specific IgG to the development of th2-mediated airway inflammation[J]. Allergy (Cairo), 2012, 2012: 236075. |
| [2] | Lau S, Illi S, Platts-Mills TA, et al. Longitudinal study on the relationship between cat allergen and endotoxin exposure, sensitization, cat-specific IgG and development of asthma in childhood-report of the German Multicentre Allergy Study (MAS 90)[J]. Allergy, 2005, 60(6): 766-773. DOI: 10.1111/all.2005.60.issue-6. |
| [3] | Jönsson F, Mancardi DA, Kita Y, et al. Mouse and human neutrophils induce anaphylaxis[J]. Clin Invest, 2011, 121(4): 1484-1496. DOI: 10.1172/JCI45232. |
| [4] | Oettgen HC, Martin TR, Wynshaw-Boris A, et al. Active anaphylaxis in IgE-deficientmice[J]. Nature, 1994, 370(6488): 367-370. DOI: 10.1038/370367a0. |
| [5] | Mehlhop PD, van de Rijn M, Goldberg AB, et al. Allergen-induced bronchial hyperreactivity and eosinophilic inflammation occur in the absence of IgE in a mouse model of asthma[J]. Proc Natl Acad Sci USA, 1997, 94(4): 1344-1349. DOI: 10.1073/pnas.94.4.1344. |
| [6] | Hales BJ, Martin AC, Pearce LJ, et al. IgE and IgG antihouse dust mite specificities in allergic disease[J]. J Allergy Clin Immunol, 2006, 118(2): 361-367. DOI: 10.1016/j.jaci.2006.04.001. |
| [7] | Kagari T, Tanaka D, Doi H, et al. Essential role of Fcγ receptors in anti-type Ⅱ collagen antibody-induced arthritis[J]. J Immunol, 2003, 170(8): 4318-4324. DOI: 10.4049/jimmunol.170.8.4318. |
| [8] | Ebert LM, Horn MP, Lang AB, et al. Bcells alter the phenotype and function of follicular-homing CXCR5+ T cells[J]. Eur J Immunol, 2004, 34(12): 3562-3571. DOI: 10.1002/(ISSN)1521-4141. |
 2016, Vol. 37
2016, Vol. 37

