细胞衰老指细胞在不可逆地丧失增殖能力后进入的相对稳定的细胞状态,表现为体积增大、扁平状、G1期阻滞等。正常细胞中,多种因素可引起细胞衰老,如癌基因表达或抑癌基因失活、活性氧自由基的产生等。细胞衰老不仅控制正常细胞的自然老化,也控制细胞恶性转变,如口腔鳞状细胞癌、前列腺癌、肝癌和乳腺癌中细胞衰老,对肿瘤发展起到抑制作用[1]。研究细胞衰老对于肿瘤抑制作用的机制,有助于认识肿瘤发生发展的机制,为肿瘤治疗提供基础资料
微小RNA (MicroRNA,miRNA, miR)是长约20-22nt的非编码RNA,通过与靶mRNA 3’UTR端结合,在转录后水平调控基因的表达[2]。miR-34a的编码基因定位于1p36.23,过表达以后,可诱导人间充质干细胞、人血管平滑肌细胞衰老[3]。研究发现在肝细胞癌和结肠癌细胞中miR-34a可抑制端粒酶活性,诱导衰老样表型[4]。然而,目前尚无研究阐明miR-34a与头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)细胞衰老的关系。
低氧是肿瘤微环境的一个显著特征。近年来的研究表明,低氧和低氧诱导因子-1α(HIF1-α)可延迟细胞衰老的发生[5]。虽然,研究发现低氧可通过抑制miR-34a的表达促进肾小球上皮细胞的上皮间充质转化(EMT)[6],但miR-34a对HNSCC衰老的影响及与低氧的调控关系尚不明确。因此本实验通过在HNSCC细胞中过表达miR-34a,初步探讨低氧与miR-34a对细胞衰老的影响。
1 材料与方法 1.1 材料UM-SCC-23 (密歇根大学),Fadu和Cal-27细胞(ATCC, 美国),DMEM高糖培养基和胎牛血清(Hyclone, 美国),慢病毒表达载体(pCDH-EF1-copGFP-pre-miR-34a和pCDH-EF1-copGFP-control) (Systems Biosciences, 美国),细胞衰老β-Gal染色试剂盒和MTT细胞增殖及细胞毒性检测试剂盒(碧云天,江苏),miRNA提取试剂盒(Ambion, 美国),miR-34a、U6检测引物和qPCR检测试剂盒(Genecopia, 美国)。
1.2 组织样本收集和qRT-PCR检测收集2010年9月-2015年4月期间我院经手术切除及病理确诊的HNSCC组织样本39例。每例组织样本分别选取癌及对照的癌旁黏膜上皮(距病灶边缘 > 1 cm),置RNA保存液中,于-80 ℃保存。利用miRNA提取试剂盒提取总RNA,提取过程中防止样品的污染和降解,RNA提取全程在冰上操作,逆转录试剂盒合成cDNA,以该cDNA为模板用HIF1-α及actin检测引物进行PCR扩增,检测组织中HIF1-α mRNA的相对表达量。HIF1-α扩增条件如下:预变性95 ℃、10 min;变性95 ℃、10 s,退火55 ℃、20 s,延伸72 ℃、15 s,循环40次。
1.3 细胞常氧和低氧培养UM-SCC-23、Fadu和Cal-27细胞培养于10%胎牛血清DMEM高糖培养基并置于常氧培养箱(20% O2,5% CO2,37 ℃)。低氧下培养的HNSCC细胞,据培养时间分为6,12,18,24 h组,置于低氧培养箱(1% O2,5% CO2,余为N2,37 ℃)。
1.4 慢病毒包装及稳定表达miR-34a的人头颈部鳞癌细胞系的建立与筛选在80%融合的293E细胞中按比例加入辅助包装质粒(Gag、rev和vsvg)、lipofectamine和miR-34a过表达慢病毒载体。48 h后取病毒液,感染UM-SCC-23和Fadu细胞,并加入4 μg/ml polybrene进行培养。48 h后荧光显微镜下观察感染细胞中GFP荧光,然后通过流式细胞仪分选出GFP阳性细胞。
1.5 qRT-PCR检测细胞中miR-34a的表达用microRNA提取试剂盒提取其总RNA,miRNA逆转录试剂盒合成cDNA。以该cDNA为模板用pre-miR-34a及U6检测引物进行PCR扩增,检测细胞中pre-miR-34a的相对表达量。pre-miR-34a及U6 PCR扩增条件如下:预变性95 ℃、10 min;变性95 ℃、10 s,退火60 ℃、20 s,延伸72 ℃、15 s,循环40次。
1.6 MTT法测细胞增殖取对数生长期细胞制成单细胞悬液,接种到96孔板中,每孔5×103个细胞,设置空白对照孔。于铺板的第1、2、4、5、6、7、8天别拿出对应的孔板加入10 μl MTT溶液。孵育4 h后,在孔内加入100 μl Formazan,继续孵育直至在普通光学显微镜下观察发现formazan全部溶解。应用酶标仪(570 nm波长)读取每组吸光度,设置3个复孔,取平均值。
1.7 β-Gal染色首先,将细胞接种至6孔板内置爬片上。低氧处理0, 6, 12, 18, 24 h后,按照细胞衰老β-Gal染色试剂盒说明,对细胞进行固定、染色及过夜孵育。然后进行伊红复染、脱水封片。镜下(×200)观察,胞质蓝染且体积增大的细胞为衰老细胞,每张细胞爬片任选5个视野进行拍照,实验重复6次,共30个视野。利用Adobe Photoshop CS6软件分别标记衰老细胞和未衰老细胞,记录单个视野内衰老细胞数除以总细胞数(衰老细胞和非衰老细胞之和)所得值,取前述30个视野的所得值的平均数作为该组细胞的细胞衰老率。
1.8 统计学方法数据采用GraphPad Prism5软件进行统计学分析,以x±s表示,组间单因素分析采用独立样本t检验,以P<0.05为差异有统计学意义。实验结果均重复3次以上。
2 结果 2.1 HNSCC组织和对应的癌旁上皮中HIF1-α和miR-34a的表达与癌旁正常上皮相比,39例HNSCC组织中,38.5%(15/39) HIF1-α mRNA表达上升[log2(倍数)≥0.4],12.8%(5/39)表达降低[log2(倍数)≤-0.4],48.7%(19/39)表达无明显差异[-0.4<log2(倍数)<0.4];23.1%(9/39) miR-34a表达升高,66.7%(26/39)表达降低,10.3%(4/39)表达无明显差异。在15例HIF1-α表达上升的肿瘤组织中,80.0%(12/15)例样本显示miR-34a表达显著下降(log2(倍数)≤-1)(图 1)。
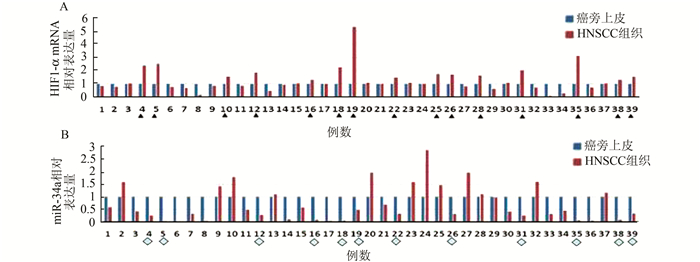
|
图 1 HNSCC组织中HIF1-α和miR-34a的表达 ▲标注处代表HIF1-α和miR-34a表达的升高;◆标注处代表miR-34a的表达下降 |
UM-SCC-23、Fadu和CAL-27细胞以不同时间点进行低氧处理后,其miR-34a表达均较常氧细胞显著降低(P<0.05),且miR-34a水平的下降具有时间依赖性(图 2)。UM-SCC-23细胞在低氧6 h后,miR-34a水平开始显著降低;随着低氧时间的延长,miR-34a表达逐渐降低,且在24 h后达到最低。Fadu细胞在低氧12 h后检测到miR-34a表达显著降低,随后逐渐降低至24 h。CAL-27细胞在低氧6 h后检测到miR-34a表达降低,18 h后达到最低,24 h后miR-34a表达回升,但仍显著低于常氧。
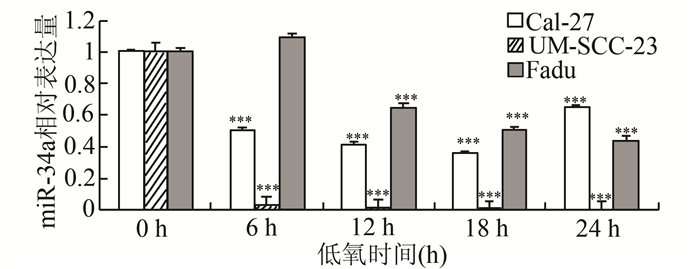
|
图 2 低氧下HNSCC细胞中miR-34a的表达 与0 h相比,***P<0.05 |
荧光显微镜下可见S-34a、S-con、F-34a和F-con细胞均表达绿色荧光。通过qRT-PCR检测发现,与S-con细胞对比,S-34a中miR-34a mRNA相对表达量增加约258.2倍;与F-con细胞对比,F-34a中miR-34a mRNA相对表达量增加约280.5倍(图 3)。
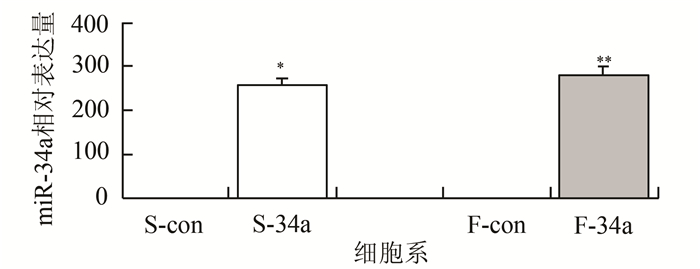
|
图 3 HNSCC细胞中miR-34a的表达 与S-con相比,*P<0.05;与F-con相比,**P<0.05 |
与S-con细胞比,在培养的第4天可检测到S-34a细胞增殖能力明显减弱,差异有显著统计学意义(P<0.05);随着培养时间的延长,S-34a和S-con细胞增殖能力都在逐渐增强,但S-34a增殖能力始终弱于S-con,且二者增殖能力差异倍数随时间延长而增大,在第8天达到最大。
与F-con细胞比,F-34a细胞在培养的第2天起,细胞增殖能力明显减弱,差异有显著统计学意义;随着培养时间的延长,F-34a和F-con细胞增殖能力都在逐渐增强,但F-34a增殖能力始终弱于F-con,且二者增殖能力差异倍数随时间延长而增大,在第6天达到最大, 之后F-34a和F-con增殖差异倍数开始缩小,在第8天差异倍数略低于第2天(图 4)。
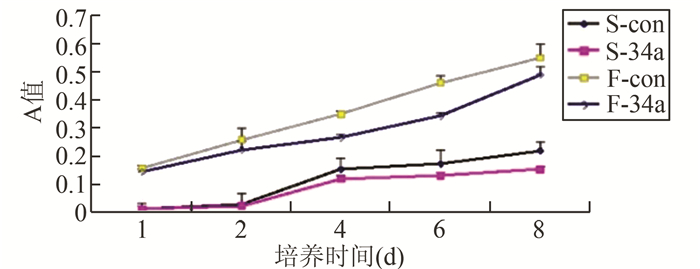
|
图 4 HNSCC细胞增殖能力比较 |
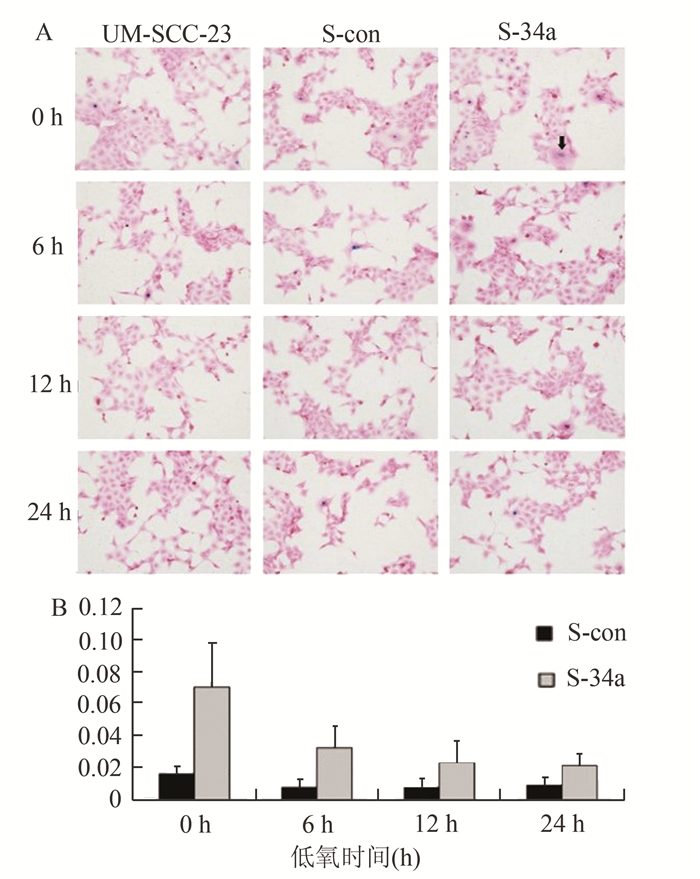
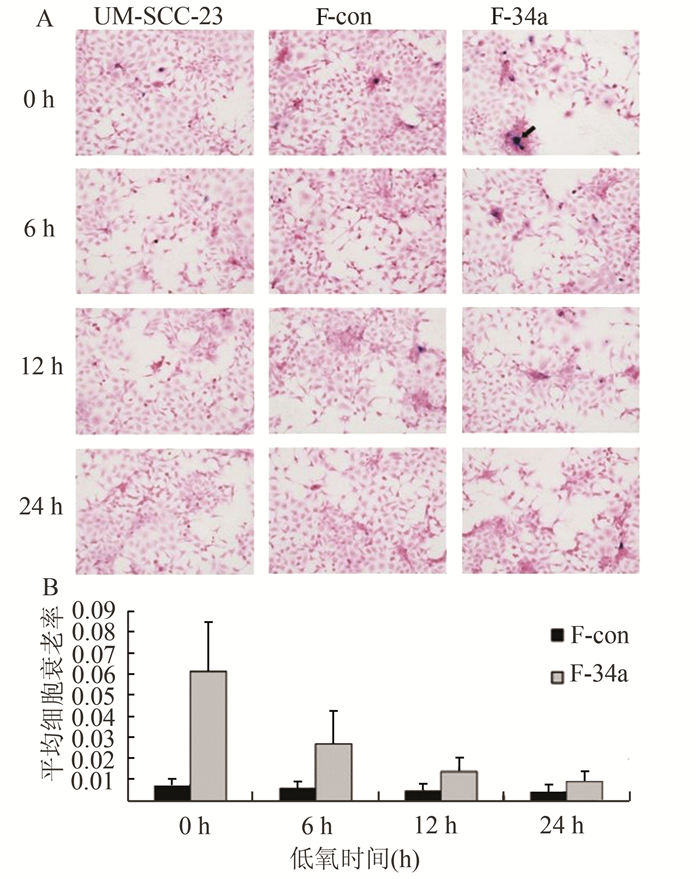
常氧下,miR-34a过表达细胞S-34a平均细胞衰老率是对照S-con细胞的4.41倍;F-34a平均细胞衰老率是F-con的8.18倍,差异具有统计学意义(P<0.05)。与常氧组相比,低氧下S-34a和F-34a细胞的平均细胞衰老率随着低氧时间的延长而逐渐降低,差异具有统计学意义(P<0.05)。在同样的低氧条件下,miR-34a过表达细胞的衰老率均显著高于对照组(P<0.05)。随着低氧时间的延长,miR-34a过表达细胞与对照细胞的衰老率差异倍数逐渐减小。低氧24 h后,S-34a平均细胞衰老率是对照S-con细胞的2.63倍(图 5),F-34a平均细胞衰老率是F-con的3.33倍(图 6)。
|
图 5 低氧不同时间点S-con和S-34a细胞衰老的情况 |
|
图 6 低氧不同时间点在F-con和F-34a细胞衰老的情况 |
研究发现miR-34家族在抑制肿瘤方面起到重要作用,涉及到多种癌症的发展相关过程,如增殖、迁移、侵袭、远处转移和凋亡等[7]。有研究表明在成神经细胞瘤、恶性胶质瘤以及胰腺癌中miR-34a表达下降[2]。本研究发现66.7% HNSCC组织中miR-34a表达降低,仅23.1% miR-34a表达升高,提示miR-34a表达降低可能与HNSCC发生发展相关。目前研究发现,miR-34a参与调控细胞的衰老。在正常细胞如间充质干细胞中,miR-34a过表达可明显抑制SIRT1蛋白的表达,进而诱导血管内皮细胞的衰老和凋亡[3]。Xu等研究发现在肝癌细胞中过表达miR-34a后,可抑制FoxM1和c-Myc的表达,进而促进细胞衰老[4]。然而,miR-34a与HNSCC细胞衰老的关系目前尚无报道。本实验发现过表达miR-34a后可促进HNSCC细胞的衰老,抑制其增殖。
研究发现在阻塞性呼吸暂停小鼠模型中,间断低氧和持续低氧可使其脑干组织miR-34a表达下降,且持续低氧后miR-34a表达水平更低,表明低氧可调控miR-34a的表达[8]。此外,有研究表明低氧和HIF1-α可促进HNSCC EMT和增殖[9]。本实验研究发现在检测到HIF1-α上调的HNSCC组织中,约80.0%的病例显示miR-34a的表达较癌旁正常组织显著下降,提示HNSCC组织中HIF1-α和miR-34a的表达呈反向趋势。为了进一步探讨低氧对miR-34a的影响,本研究检测了低氧下UM-SCC-23、Fadu和Cal-27细胞miR-34a的表达,结果显示随着低氧时间的延长UM-SCC-23、Fadu和Cal-27细胞miR-34a的表达显著下降。提示组织和细胞低氧微环境可能是HNSCC中miR-34a下调的一个重要因素。
目前研究认为低氧可抑制内皮祖细胞、结肠癌和乳腺癌等细胞的衰老[10]。为了进一步研究HNSCC中低氧对miR-34a诱导的细胞衰老的影响,本课题组检测了不同低氧时间下过表达miR-34a细胞衰老的变化。结果表明miR-34a过表达细胞的平均衰老率随着低氧时间的延长而逐渐降低。虽然在同样的低氧条件下,miR-34a过表达细胞的衰老率仍显著高于对照细胞,但随着低氧时间的延长,其衰老率差异倍数逐渐减小。可见,低氧可在一定程度上抑制miR-34a诱导的HNSCC细胞衰老。
综上,本实验表明miR-34a可诱导HNSCC细胞的衰老;低氧通过抑制miR-34a的表达在一定程度上抑制miR-34a诱导的细胞衰老。
| [1] | Parkinson EK. Senescence as a modulator of oral squamous cell carcinoma development[J]. Oral-Oncol, 2010, 46(12): 840-853. DOI: 10.1016/j.oraloncology.2009.09.009. |
| [2] | Agostini M, Knight RA. miR-34: from bench to bedside[J]. Oncotarget, 2014, 5(4): 872-881. DOI: 10.18632/oncotarget. |
| [3] | Zhang F, Cui J, Liu X, et al. Roles of microRNA-34a targeting SIRT1 in mesenchymal stem cells[J]. Stem Cell Res Ther, 2015, 6(1): 195. DOI: 10.1186/s13287-015-0187-x. |
| [4] | Xu X, Chen W, Miao R, et al. miR-34a induces cellular senescence via modulation of telomerase activity in human hepatocellular carcinoma by targeting FoxM1/c-Myc pathway[J]. Oncotarget, 2015, 6(6): 3 988-4 004. DOI: 10.18632/oncotarget. |
| [5] | Tsai CC, Chen YJ, Yew TL, et al. Hypoxia inhibits senescence and maintains mesenchymal stem cell properties through down-regulation of E2A-p21 by HIF-TWIST[J]. Blood, 2011, 117(2): 459-469. DOI: 10.1182/blood-2010-05-287508. |
| [6] | Du R, Sun W, Xia L, et al. Hypoxia-induced down-regulation of microRNA-34a promotes EMT by targeting the Notch signaling pathway in tubular epithelial cells[J]. PLoS One, 2012, 7(2): e30771. DOI: 10.1371/journal.pone.0030771. |
| [7] | Rokavec M, Li H, Jiang L, et al. The p53/miR-34 axis in development and disease[J]. J Mol Cell Biol, 2014, 6(3): 214-230. DOI: 10.1093/jmcb/mju003. |
| [8] | Zhang J, Guo X, Shi Y, et al. Intermittent hypoxia with or without hypercapnia is associated with tumorigenesis by decreasing the expression of brain derived neurotrophic factor and miR-34a in rats[J]. Chin Med J, 2014, 127(1): 43-47. |
| [9] | Zhang J, Wang Y, Chen X, et al. MiR-34a suppresses amphiregulin and tumor metastatic potential of head and neck squamous cell carcinoma (HNSCC)[J]. Oncotarget, 2015, 6(10): 7 454-7 769. DOI: 10.18632/oncotarget. |
| [10] | Lee SH, Lee JH, Yoo SY, et al. Hypoxia inhibits cellular senescence to restore the therapeutic potential of old human endothelial progenitor cells via the hypoxia-Inducible factor-1α-TWIST-p21 Axis[J]. Arterioscler Thromb Vasc Biol, 2013, 33(10): 2 407-2 414. DOI: 10.1161/ATVBAHA.113.301931. |
 2016, Vol. 37
2016, Vol. 37

 ,
,