2. 武汉大学中南医院重症医学科 湖北 武汉 430071
2. Dept. of Intensive Care Unit, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
脓毒症是ICU病人最常见的致死原因之一。发生的机制与感染扩散入血导致炎症因子失控有关,如肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素(interleukin,IL)-1b、高迁移率族蛋白1 (high mobility group box-1 protein, HMGB1)表达失控[1, 2]。失控的炎症反应最终导致器官功能失调甚至危及生命。尽管抗微生物的治疗取得了巨大进展,但是近年由感染引起的致死性脓毒症却增加了30%。近些年针对脓毒症的研究取得了巨大进步,但发生的机制并未完全明了[3]。利用脂多糖(Lipopoly-saccharide, LPS)制作小鼠脓毒症模型是进行实验研究的基础。
刺激迷走神经激活胆碱能抗炎通路可以有效减轻炎症反应,其作用机制与迷走神经激活α7胆碱能受体(α7-nicotinic acetylcholine receptor,α7nAChR)有关[4]。GTS-21是人工合成的α7nAChR特异性激动剂,可用于建立胆碱能抗炎通路研究中抗炎模型。目前不同文献中LPS小鼠脓毒症模型和GTS-21抗炎模型中用药剂量差异较大。为了便于后继研究的开展,本实验参考以前文献中用药剂量,通过对LPS和GTS-21在细胞实验模型和动物实验模型中使用剂量与TNFα和HMGB1表达进行研究,摸索建立稳定有效的实验模型的最佳药物剂量,为探索脓毒症发生机制的研究奠定基础。
1 材料与方法 1.1 材料 1.1.1 材料及试剂ELISA试剂盒(eBioscience, USA),小牛血清(FBS, HyClone),脂多糖(LPS,Sigma),GTS-21(Abcam)。
1.1.2 实验细胞和实验动物小鼠巨噬细胞RAW264.7源于武汉大学中南医院医学实验中心。细胞培养使用48孔板,每孔细胞接种密度2×104,培养液选用含10%小牛血清的DMEM培养液。
SPF级5-6周龄BALB/c雄性小鼠(20-22 g)购买自武汉大学动物实验中心,小鼠采取标准化饲养。饲养条件为22 ℃,12 h昼夜交替的实验环境,采用标准化小鼠食物和自由摄水。按照实验动物关爱原则小鼠受到人性化关爱。
1.2 方法 1.2.1 模型的建立RAW264.7细胞种植24 h后,为了确定最佳实验药物剂量,第一、二、三组细胞,每组6孔,每孔分别加入80, 50, 30 mg/ml LPS,在1,6,12,18,24和30 h各取上清液200 μl,用ELISA法检测TNFα和HMGB1。在最佳LPS剂量下,使用GTS-21 (6, 8, and 10 μg/ml),在上述时间点再次检测TNFα和HMGB1。
36只小鼠被随机分成6组:3组为LPS组,3组GTS-21治疗组,每组6只。第一、二、三组为LPS组,分别按10, 15, 20 mg/kg腹腔注射LPS诱导炎症反应,摸索最佳的LPS剂量。对照组小鼠采用同样的方法腹腔注射生理盐水;第四、五、六组为GTS-21组,腹腔注射最佳剂量LPS同时,注射GTS-21分别2, 4, 6 mg/kg。腹腔注射后6, 12, 18, 24 h取血标本稀释后4 ℃低温离心机3 000 r/min离心10 min,取上清用于下一步检测。本实验后处死小鼠,取其内脏组织进行组织学进行后继研究时,没有发现肠肝脾肾等腹腔脏器的损伤,排除内脏损伤导致的脓毒症。
1.2.2 小鼠评分给药后,分别观察小鼠的生命状态并进行鼠脓毒症评分(murine sepsis score,MSS),LPS组中出现脓毒症症状,存活时间均超过24 h,血清中TNFα和HMGB1浓度最高组为最佳LPS剂量。GTS-21组中TNFα和HMGB1浓度最低组为最佳GTS-21剂量。
1.2.3 炎症因子的检测采用TNFα和HMGB1的ELISA试剂盒检测血清中炎症因子浓度,操作方法按照试剂盒提供的说明书严格操作。
1.2.4 统计学分析采用Graphpad Prism 5软件进行数据统计分析,两组间的检测结果分别采用t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 细胞模型结果在培养液中加入不同浓度的LPS进行细胞培养,分别在1, 6, 12, 18, 24和30 h分别取上清进行ELISA检测。观察期间,第一组RAW264.7有少量死亡,第二组和第三组细胞死亡量极少。第二组的TNFα在12 h表达浓度最高(P < 0.05)(图 1,A),24 h HMGB1浓度也明显高于其他组(图 1,B)(P < 0.05)。
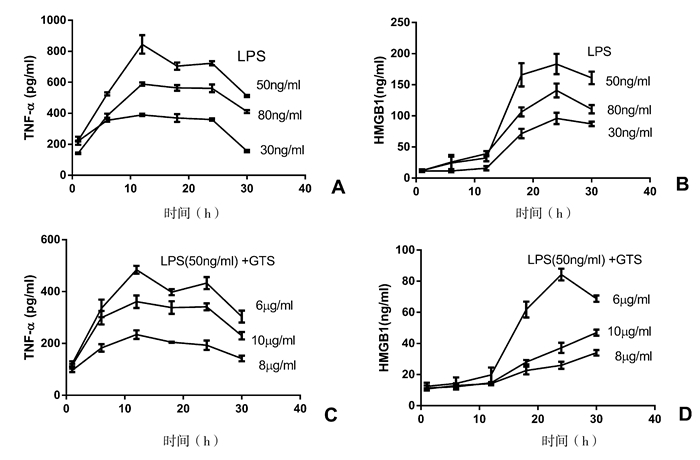
|
图 1 RAW264.7细胞炎症因子表达变化 |
以LPS浓度为50 mg/ml作为刺激剂量,培养液中同时加入不同浓度的GTS-21,在上述时间点检测TNFα和HMGB1的表达变化,在给药24 h后,GTS浓度为6 mg/ml组,TNFα和HMGB1的浓度最低(图 1,C、D)。
2.2 小鼠模型MSS结果在小鼠模型构建过程中我们采用Shrum等研制的MSS评分系统[5]。评分从外表、意识、活动、刺激反应、眼睛、呼吸频率、呼吸质量等方面评分,每项正常为0分,最严重为4分,总分3分以上为脓毒症。第一组腹腔注射10 mg/kg LPS的小鼠约10 min后MSS评分升高,最高评分5分,12 h逐渐降低。第二组注射15 mg/kg LPS,MSS在9 h最高,平均7分,且有2只小鼠出现便血症状,24 h无小鼠死亡。第三组注射LPS 20 mg/kg,MSS>10,并在14和17 h各有一只死亡。第四、五、六组分别在注射LPS 15 mg/kg的同时分别注射GTS 2, 4, 6 mg/kg,此3组小鼠的MSS均较第二组明显改善。
2.3 小鼠模型结果对实验小鼠在不同时间断尾采血,稀释后行ELISA检测,换算后得血清TNFα和HMGB1浓度。TNFα组采血时间为给药后6, 12, 18, 24 h,测HMGB1的采血时间为给药后12, 18, 24, 30 h。通过对LPS给药量分别为10, 15, 20 mg/kg的第一、二、三组上清检测可见,给药后12 h的TNFα血液浓度第二、三组均明显高于第一组(P < 0.05),两组间没有明显差异(P > 0.05)(图 2A)。给药后24 h的HMGB1血液浓度结果也显示第二、三组均明显高于第一组(P < 0.05),二、三组间没有明显差异(P > 0.05)(图 2B)。
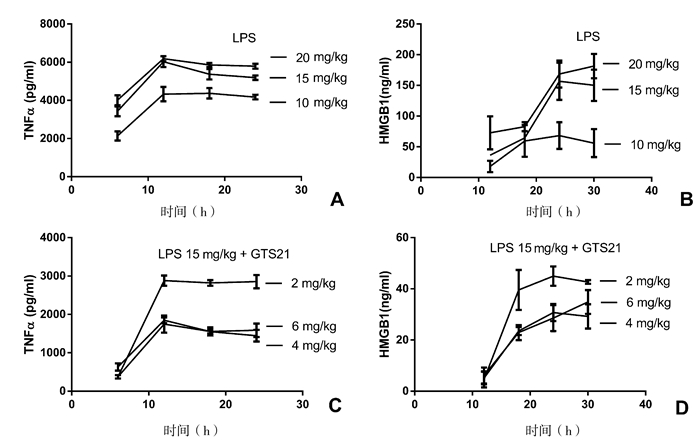
|
图 2 小鼠血液炎症因子表达变化 |
在注射不同浓度的GTS-21后,第五、六组小鼠的血清TNFα和HMGB1浓度表达均低于第四组(P < 0.05),而第五、六组之间浓度无明显差异(P > 0.05)(图 2C、2D)。
3 讨论脓毒症的高死亡率与该病导致机体多器官损伤,炎症因子表达失控,发生机制的未完全明了有关。目前研究的细胞实验多以巨噬细胞为主,来源有小鼠单核巨噬细胞白血病细胞RAW264.7细胞系培养和小鼠腹腔灌洗得到。小鼠脓毒症模型目前应用较为广泛的有三种[6],第一种为腹膜炎模型,方法有盲肠结扎穿孔(CLP)模型和腹腔植入含活菌纤维蛋白凝块的模型两种。第二种为血管内输注活菌模型,即一次性往血管内注入大量活菌。第三种方法为LPS攻击模型,往小鼠腹腔或者血管注射脂多糖,可诱导产生脓毒症症状及体征。
第三种方法由于不会出现细菌数量难以控制、模型较易复制,诱导产生的血流动力学、血液学及代谢改变与脓毒症患者类似等优点获得广泛应用。但是小剂量的内毒素对小鼠损伤轻,不能达到脓毒症模型的效果,大剂量容易导致动物DIC,呼吸衰竭,使动物在24 h内死亡。
近年发现,激活迷走神经传出纤维后,其外周神经末梢释放的乙酰胆碱递质能激活巨噬细胞膜表面α7nAChR,这一反射通路被称为胆碱能抗炎通路[7]。GTS-21是人工合成的α7nAChR特异激动剂,用药后可以起到激活抗炎通路类似的抗炎效果。RAW264.7细胞系和小鼠的脓毒症模型和胆碱能抗炎通路模型的建立为进一步开展脓毒症及抗炎的机制研究和治疗药物的评价奠定基础。
脓毒症的发生与全身的炎症因子失衡有关,TNFα、HMGB1等炎症因子是对脓毒症发生机制研究的重要指标,炎症因子增高的程度往往反映了机体内代谢的紊乱程度[8]。本研究中,RAW264.7细胞中TNFα和HMGB1在LPS浓度50 ng/ml达最高,继续升高LPS浓度,细胞死亡量增加,产生的炎症因子反而减少。加入GTS-21后炎症因子表达明显减少,但是超过6 μg/ml时抗炎效果不再增加,推测与细胞膜表面受体饱和有关。
MSS评分大于3分时与实验动物死亡率密切相关[5],本实验三种剂量LPS小鼠MSS>5分。腹腔注射LPS量达到15 mg/kg时实验小鼠的生存时间均超过30 h。继续增加剂量,血清炎症因子浓度不会出现明显增加,但小鼠在24 h内有33%死亡。因此,我们认为在构建小鼠脓毒症模型中,尤其是研究晚期炎症因子为了保证小鼠的存活时间,建议注射的LPS量以不超过15 mg/kg为宜。腹腔注射GTS-21的量超过4 mg/kg后抗炎效果并不能增加,但副作用可能会增加。
综上,从炎症因子表达改变、小鼠临床表现的角度来看,本实验建立的内毒素性RAW264.7细胞脓毒症模型和小鼠脓毒症模型与GTS-21胆碱能抗炎通路模型均具有较好的稳定性和易行性,为脓毒症研究和抗炎研究提高理想的细胞实验模型和动物实验模型。
| [1] | Kaukonen KM, Bailey M, Suzuki S, et al. Mortality related to severe sepsis and septic shock among critically ill patients in Australia and New Zealand, 2000-2012[J]. JAMA, 2014, 311(13): 1308-1316. DOI: 10.1001/jama.2014.2637. |
| [2] | Ravetti CG, Moura AD, Vieira EL, et al. sTREM-1 predicts intensive care unit and 28-day mortality in cancer patients with severe sepsis and septic shock[J]. J Crit Care, 2015, 30(2): 440-447. |
| [3] | Marik PE. Early management of severe sepsis: concepts and controversies[J]. Chest, 2014, 145(6): 1407-1418. DOI: 10.1378/chest.13-2104. |
| [4] | Xiang H, Hu B, Li Z, et al. Dexmedetomidine controls systemic cytokine levels through the cholinergic anti-inflammatory pathway[J]. Inflammation, 2014, 37(5): 1763-1770. DOI: 10.1007/s10753-014-9906-1. |
| [5] | Shrum B, Anantha RV, Xu SX, et al. A robust scoring system to evaluate sepsis severity in an animal model[J]. BMC Res Notes, 2014, 7: 233. DOI: 10.1186/1756-0500-7-233. |
| [6] | Fink MP. Animal models of sepsis[J]. Virulence, 2014, 5(1): 143-153. DOI: 10.4161/viru.26083. |
| [7] | Zabrodskii PF, Lim VG, Shekhter MS, et al. Role of nicotinic and muscarinic cholinoreceptors in the realization of the cholinergic anti-inflammatory pathway during the early phase of sepsis[J]. Bull Exp Biol Med, 2012, 153(5): 700-703. DOI: 10.1007/s10517-012-1803-8. |
| [8] | Xiong J, Xu L, Qu WM, et al. Roles of GILZ in protein metabolism of L6 muscle cells exposed to serum from septic rats[J]. Genet Mol Res, 2014, 13(4): 8209-8219. DOI: 10.4238/2014.October.8.2. |
 2016, Vol. 37
2016, Vol. 37

