2. 西安医学院第一附属医院 陕西 西安 710077;
3. 西安医学院全科医学院 陕西 西安 710077
2. The First Affiliated Hospital of Xi′an Medical University, Xi'an 710077, China;
3. School of General Medicine Xi′an Medical University, Xi'an 710077, China
目前胃癌是癌症相关死亡的主要原因之一。根据国际癌症研究机构(International Agency for Research on Cancer, IARC)的统计数据显示,全球胃癌的发病率和死亡率呈逐年上升的趋势,2012年全球新发胃癌病例951 600例,723 100例患者死于胃癌[1],在我国,胃癌的发病率和死亡率也逐年上升,并且具有年轻化的趋势[2]。手术是治疗早期胃癌的主要方法,术后局部复发和远处转移是治疗失败的根本原因,年轻、低分化、区域淋巴结转移,病理分期晚、浸润程度深、脉管瘤栓等因素提示预后不良。但是,由于恶性肿瘤分子生物学特征的差异,这些因素不足以准确判断预后,因此,研究胃癌的分子生物学标志物对于判断预后,制定治疗方案有十分重要的意义。
自噬(autophagy)是细胞生长、发育和分化的重要调控机制,自噬的失调在恶性肿瘤的发生发展中具有重要作用。目前研究发现自噬可以通过多个途径增强肿瘤的侵袭和转移能力[3]。本研究通过检测胃癌和正常胃组织自噬标志蛋白LC3和基质金属蛋白酶MMP-2的表达差异,分析LC3、MMP-2与临床病理学参数的关系,及两者之间的相关性,探讨两者是否能够作为胃癌的生物标志物判断预后。
1 材料与方法 1.1 组织标本收集2013年1月-2015年1月延安大学附属医院胃癌组织标本120例,及配对正常胃组织标本120例。所有患者均接受胃癌根治术,所有病例均经病理确诊为胃腺癌。年龄在26-69岁之间,中位年龄52岁,120例患者的临床资料见表 1。
| 表 1 120例胃癌患者的临床病理资料 |
MMP-2小鼠抗人单克隆抗体和LC3B兔抗人单克隆抗体均购自(Abcam, Cambridge, United Kingdom);链霉亲和素-生物素复合物(SABC)试剂盒、二抗生物素化山羊抗小鼠IgG/兔IgG、和DAB显色液均购自武汉博士德生物工程有限公司。
1.3 免疫组化SABC法将石蜡组织切片放置在60 ℃烘箱内烘烤60 min。将石蜡切片放置于二甲苯溶液脱蜡,乙醇溶液梯度脱水。每张切片适量滴加3%过氧化氢去离子水封闭,室温下孵育15 min。高压热修复。滴加1滴非免疫性山羊血清工作液37 ℃下孵育40 min, 去除非特异性染色。每张切片分别滴加一抗(抗人LC3B或MMP-2抗体),4 ℃冰箱孵育过夜。从冰箱取出后在室温下放置30 min进行复温。然后滴加生物素化山羊抗小鼠IgG/兔IgG,37 ℃孵育30 min。滴加SABC,37 ℃孵育30 min。DAB试剂盒显色,应用苏木素进行复染。
1.4 结果判定LC3和MMP-2均在胞质表达,阳性表达为胞质棕黄色均匀染色。阳性细胞百分数评分标准:在10×20倍镜下随机选取5个视野,每个视野分别计数阳性染色的细胞数,评分标准:0分, 平均阳性细胞数与总计数细胞之比0%-9%; 1分,平均阳性细胞数与总计数细胞之比10%-49%;2分:平均阳性细胞数与总计数细胞之比50%-100%。染色强度的评分标准:0分, 阴性; 1+, 淡黄色; 2+, 黄色; 3+, 棕黄色。蛋白表达的分级:阳性细胞百分数评分与染色强度评分的乘积,低表达:0-3分;高表达:≥4分。每一张病理切片均由两位病理科医生采用盲法独立阅片。
1.5 统计学分析统计分析应用SPSS 19.0统计软件,计数资料的分析应用χ2检验进行;相关性分析应用Spearman相关性检验。应用90例患者的临床资料进行生存分析,各组间中位无疾病进展生存(Disease free survival, DFS)的差异应用log-rank检验进行分析(DFS定义为从手术时间到疾病进展时间或者是末次随访时间),以双侧检验P<0.05具有统计学意义。
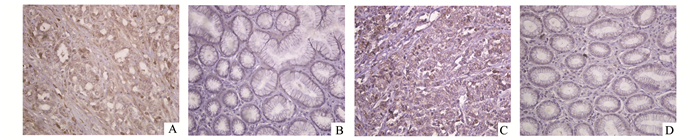
2 结果 2.1 LC3和MMP-2在胃癌和正常胃组织的表达LC3和MMP-2均在细胞胞质表达,棕黄色均匀染色为阳性染色,LC3在胃癌和正常胃组织的高表达率分别为52.5% (63/120), 31.7% (38/120),胃癌组织LC3的高表达率显著高于正常胃组织,差异有统计学意义(P<0.001);MMP-2在胃癌和正常胃组织的高表达率分别为51.7% (62/120), 35.0% (42/120),胃癌组织MMP-2的高表达率显著高于正常胃组织,差异有统计学意义(P<0.001)(表 2,图 1)。
| 表 2 胃癌和正常胃组织LC3和MMP-2的表达[n(%)] |
|
图 1 胃癌和正常胃组织LC3和MMP-2表达的免疫组化照片 A.胃癌LC3高表达;B.正常胃组织LC3低表达; C.胃癌MMP-2高表达; D.正常胃组织MMP-2低表达(×400) |
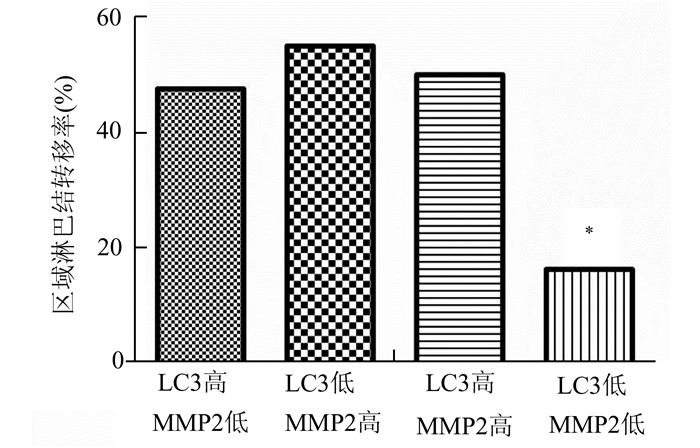
LC3的高表达与胃癌患者pTNM分期(P=0.004)和区域淋巴结转移(P=0.030)有显著相关性,与年龄(P=0.521)、性别(P=0.118)、肿瘤大小(P=0.978)、肿瘤位置(P=0.559)、肿瘤分化程度(P=0.093)和侵润深度(P=0.053)均无显著相关性;MMP-2的高表达与胃癌患者pTNM分期(P=0.002)和区域淋巴结转移(P=0.007)有显著相关性,与年龄(P=0.218)、性别(P=0.298)、肿瘤大小(P=0.194)、肿瘤位置(P=0.545)、肿瘤分化程度(P=0.640)和侵润深度(P=0.810)均无显著相关性(表 3)。同时存在LC3和MMP-2低表达的患者区域淋巴结转移率显著低于单独LC3或MMP-2高表达的患者(P=0.005)(图 2)。
| 表 3 胃癌LC3和MMP-2的表达与临床病理学参数的关系 |
|
图 2 胃癌LC3、MMP-2的表达和区域淋巴结转移率的关系 |
应用Spearman相关分析胃癌组织LC3和MMP-2的表达相关性,研究结果显示LC3和MMP-2的表达有显著相关性(r=0.299, P=0.001)。
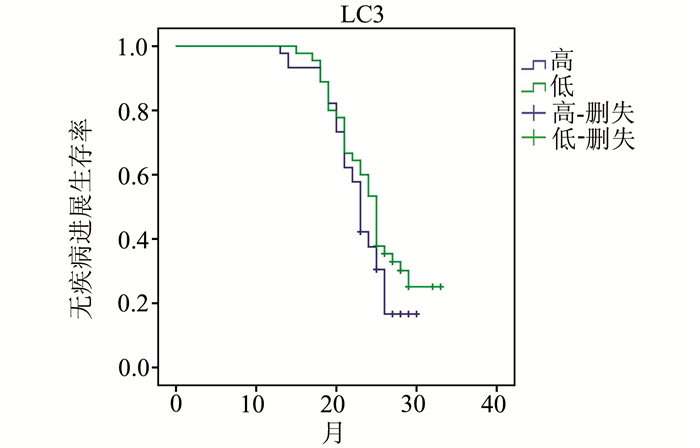
2.4 胃癌LC3表达与无疾病进展生存的关系90例患者进行随访,中位随访时间为23.5个月。LC3高表达和低表达的患者中位无疾病进展时间分别为23和25个月(P=0.184)(图 3)。
|
图 3 生存曲线 |
目前研究认为自噬异常伴随在肿瘤发生、发展、转移的整个过程中,自噬对于肿瘤细胞的转移具有双重性的作用,在转移的早期,自噬能够抑制肿瘤组织的坏死和炎症,抑制转移;而当肿瘤细胞脱离细胞外基质后,自噬可以为其提供代谢所需的营养物质和能量,维持生存。
本研究结果显示胃癌组织LC3的高表达率显著高于正常胃组织,并且LC3的高表达与更晚的病理分期和区域淋巴结转移有关,更晚的病理分期是由区域淋巴结转移导致的,提示肿瘤组织的自噬水平显著增强,自噬水平增高可能有利于胃癌细胞向区域淋巴结的转移。并且,LC3高表达预示较短的无疾病进展生存时间,即这部分患者容易出现复发和转移,虽然无统计学差异,可能与样本量较少有关。既往一些研究有相似的结果,Yoshioka等应用免疫组化法检测胃肠道肿瘤组织LC3的表达,结果显示LC3主要在癌组织中的表达显著增高[4]。Liao等的研究表明LC3的阳性表达与Ⅰ-Ⅲ期胃癌患者术后的复发风险显著相关,与Ⅳ期胃癌患者的生存呈负相关[5]。Yoshioka等在胃癌组织细胞中发现LC3的点状聚集,与预后不良有关,LC3的表达和Ki67的表达显著相关,Ki67的高表达反映恶性肿瘤增殖活跃[4]。综合上述的研究结果,我们认为LC3的高表达是胃癌的不良预后因素。因此,在恶性肿瘤的进展期,癌细胞可能通过上调自噬水平清除废蛋白和被损伤的细胞器,为癌细胞提供能量,维持存活。但是目前有另一些研究在乳腺癌和肺癌中观察到自噬水平的降低[6, 7]。这些不同的结果可能与自噬对细胞的双重作用有关,并且自噬能力在不同类型肿瘤及发展的不同阶段也存在很大差异。
本研究结果显示胃癌组织MMP-2的表达水平较正常胃组织显著增高。并且MMP-2的高表达水平与更晚的病理分期和区域淋巴结转移有关,更晚的病理分期是由区域淋巴结转移导致的。Burlaka等的研究结果也表明胃癌MMP-2和MMP-9的表达和区域淋巴结转移呈显著正相关[8]。Ma等的研究结果显示淋巴结阳性的胃癌患者MMP-2的表达水平较淋巴结阴性的胃癌患者显著增高[9]。上述研究结果提示MMP-2的高表达预示胃癌容易发生区域淋巴结的转移。本研究进一步分析了LC3和MMP-2的联合表达对区域淋巴结的转移的影响,结果表明与单独LC3或MMP-2低表达的患者比较,同时存在LC3和MMP-2低表达的患者区域淋巴结转移率显著降低。并且LC3的表达和MMP-2的表达具有显著相关性。这一研究结果提示同时存在LC3和MMP-2低表达的患者区域淋巴结转移的风险降低,两者的联合检测能够预测区域淋巴结转移,具有一定的临床意义。
肿瘤的转移包括一系列病理事件的发生,包括细胞外基质(ECM)的降解,上皮间质转化(EMT),肿瘤血管形成,微环境的异常,自噬在肿瘤的转移中发挥双刃剑的作用。目前研究表明,尽管自噬性细胞死亡能够发挥抗转移的作用,大部分研究支持自噬通过多个环节促进了肿瘤转移。基质金属蛋白酶(MMP-2)在肿瘤的转移中发挥重要作用,主要通过促进ECM的降解促进肿瘤转移[10]。AMPK信号通路的活化阻断了mTOR信号通路,激活了自噬,在ECM的分离过程中发挥促存活的作用,除此之外,提高的自噬抑制了转移肿瘤细胞的失巢凋亡,保护肿瘤细胞,使其在转移器官的微环境中存活。因此我们认为在胃癌中增强的自噬活性,能够清除细胞中被不利微环境所损伤的蛋白和细胞器,维持存活,增强肿瘤细胞向区域淋巴结转移的能力。
| [1] | Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. Cancer J Clin, 2015, 65(2): 87-108. DOI: 10.3322/caac.21262. |
| [2] | Sun Z, Wang Q, Yu X, et al. Risk factors associated with splenic hilar lymph node metastasis in patients with advanced gastric cancer in northwest China[J]. Int J Clin Exp Med, 2015, 8(11): 21 358-21 364. |
| [3] | Su Z, Yang Z, Xu Y, et al. Apoptosis, autophagy, necroptosis, and cancer metastasis[J]. Mol Cancer, 2015, 14(48): 1-14. |
| [4] | Yoshioka A, Miyata H, Doki Y, et al. LC3, an autophagosome marker, is highly expressed in gastrointestinal cancers[J]. Int J Oncol, 2008, 33(3): 461-468. |
| [5] | Liao W, Sun L, Wang C, et al. LC3A-positive "stone-like" structures predict an adverse prognosis of gastric cancer[J]. Anat Rec (Hoboken), 2014, 297(4): 653-662. DOI: 10.1002/ar.22895. |
| [6] | Zarzynska JM. The importance of autophagy regulation in breast cancer development and treatment[J]. Biomed Res Int, 2014, 2014: 1-9. |
| [7] | Jiang ZF, Shao LJ, Wang WM, et al. Decreased expression of Beclin-1 and LC3 in human lung cancer[J]. Mol Biol Rep, 2012, 39(1): 259-267. DOI: 10.1007/s11033-011-0734-1. |
| [8] | Burlaka AP, Ganusevich Ⅱ, Gafurov MR, et al. Stomach Cancer: Interconnection between the Redox State, Activity of MMP-2, MMP-9 and Stage of Tumor Growth[J]. Cancer Microenviron, 2016, 9(1): 27-32. DOI: 10.1007/s12307-016-0182-5. |
| [9] |
马丽娟, 李亦工, 黄菱, 等. 赖氨酰氧化酶和基质金属蛋白酶2在胃癌组织中的表达及其与胃癌转移的关系[J].
中华肿瘤杂志, 2011, 33(1): 37-41.
Ma LJ, Li YG, Huang L, et al. Expression of LOX and MMP-2 in gastric cancer tissue and the effects of LOX and MMP-2 on tumor invasion and metastasis[J]. Chin J Oncol, 2011, 33(1): 37-41. |
| [10] | Kessenbrock K, Wang CY, Werb Z. Matrix metalloproteinases in stem cell regulation and cancer[J]. Matrix Biol, 2015, 44(46): 184-190. |
 2018, Vol. 39
2018, Vol. 39


