2. 武汉大学HOPE护理学院 湖北 武汉 430071
2. Wuhan University HOPE School of Nnursing, Wuhan 430071, China
CD1分子属于非多态性基因家族,由5个不同基因组成。它分为两群:一群分子在人类表达,即CD1a、CD1b、CD1c和CD1e分子;另一群分子在人类和鼠均表达,即CD1d分子。树突细胞 (dendritic cells, DCs)、巨噬细胞和B淋巴细胞等抗原递呈细胞均表达CD1d分子[1]。目前认为最主要的CD1d限制性细胞是自然杀伤 (natural killer, NK) T细胞,它兼具NK细胞和T细胞特征。NKT细胞表达CD1d限制性T细胞抗原受体 (T cell receptor,TCR)。根据T细胞抗原受体 (TCRs) 特征,NKT细胞分为Ⅰ型NKT细胞 (又称为恒定NKT细胞,iNKT细胞) 和Ⅱ型NKT细胞[2]。研究显示Ⅰ型NKT细胞参与哮喘气道炎症和气道高反的形成[3]。CD1d/NKT细胞受体相互作用诱导NKT细胞产生大量Th1和Th2类细胞因子,如白介素 (IL)-4、IL-5、IL-13、肿瘤坏死因子 (TNF)、干扰素 (IFN)-γ等,在体内阻断CD1d/NKT细胞通路可能调节这些细胞因子的释放[4]。目前不清楚阻断CD1d/Ⅰ型NKT细胞通路是否抑制哮喘气道炎症,因此本文探讨抗CD1d单克隆抗体对哮喘小鼠气道炎症的影响,并观察抗CD1d单克隆抗体对小鼠肺Ⅰ型NKT细胞数量和活性的影响,从而为哮喘治疗提供新的途径。
1 材料与方法 1.1 实验动物6-8周龄雌性BALB/c小鼠,购自于武汉大学动物实验中心。在无特定病原菌 (specific pathogen free,SPF) 环境下饲养。
1.2 实验试剂鸡卵清白蛋白 (ovalbumin,OVA,Grade V),美国Sigma公司;免疫佐剂 (Inject Alum),美国Thermo公司;抗CD1d单克隆抗体,eBioscience公司;快速瑞氏-姬姆萨复合染液试剂盒 (Wright-Giemsa),江苏南京建成生物工程研究所;Ⅰ型胶原酶,Invitrogen公司;ELISA试剂盒 (IL-4,IL-5,IL-13,OVA-specific IgE),eBioscience公司;PE标记的PBS-57/小鼠CD1d四聚体由美国国立卫生研究院赠送;固定剂、破膜剂、Brefeldin A、PE-cy5标记的TCR-β、FITC标记的IL-4及IFN-γ均购自eBioscience公司。
1.3 小鼠哮喘模型的制备及干预小鼠随机分为抗CD1d单克隆抗体组 (抗CD1d mAb组)、哮喘组和对照组,每组5只。哮喘组和抗CD1d单克隆抗体组第0、14天,每只小鼠腹腔注射20 μg OVA (含2 mg氢氧化铝佐剂),第25、26、27天,腹腔注射1%戊巴比妥钠麻醉小鼠后,经鼻腔给予100 μl OVA激发,对照组采用等体积PBS代替。在首次激发前1 h,抗CD1d单克隆抗体组每只小鼠尾静脉注射50 μg抗CD1d单克隆抗体,对照组和哮喘组给予等体积PBS代替。
1.4 标本的收集和处理与细胞学、组织学检测各组小鼠于末次激发24 h后,对小鼠进行眼球取血。分离血清,分装,-80 ℃保存,用于检测血清OVA特异性IgE。随后钝性分离暴露气管,在甲状软骨处插入静脉留置针,用含有1 mmol/L EDTA的冷PBS缓冲液0.5 ml灌洗3次,回收率在80%以上为合格 (总体积>1.2 ml)。支气管肺泡灌洗液 (BALF) 置于4 ℃离心,1 200 r/min,10 min。收取上清液,-80 ℃保存,用于检测IL-4,IL-5和IL-13水平。用含有1%FBS的PBS操作液重悬BALF中细胞沉淀,调节细胞浓度为1×106个/ml,取100 μl于细胞涂片离心机上甩片,500 r/min,1 min。待玻片晾干后,进行瑞氏-姬姆萨染色。取左肺组织,以10%中性甲醛溶液固定,常规石蜡包埋、切片,HE和PAS染色,观察肺组织炎症和气道基底膜PAS阳性细胞 (杯状细胞)。
1.5Ⅰ型NKT细胞数量和活性测定取右肺组织,充分切碎,Ⅰ型胶原酶消化,通过300目细胞滤网过滤获得肺组织单细胞混悬液,以密度梯度离心法分离肺组织单细胞混悬液中单个核细胞 (MNCs),调整浓度为1×106/ml,加入PE标记的PBS-57/小鼠CD1d四聚体复合物,4 ℃,避光,40 min。再加入PE-Cy5标记的TCR-β,4 ℃,避光,20 min。流式细胞术检测PBS-57/小鼠CD1d四聚体+TCR-β+细胞,即为Ⅰ型NKT细胞。以Ⅰ型NKT细胞分泌的细胞因子IL-4和IFN-γ水平作为评价其活化状态的指标。胞内细胞因子检测时,肺MNCs需经佛波酯 (PMA,50 μg/L) 和离子霉素 (Ionomycin,500 μg/L) 刺激2 h后,加入1 mg/L Brefeldin A阻断剂,37 ℃培养箱孵育4 h。随后收集细胞,同上述表面染色后固定破膜,随后加入FITC-IL-4和FITC-IFN-γ,室温,避光,20 min。破膜剂1-2 ml洗涤细胞一次,400 μl PBS重悬细胞后上机检测。
1.6 血清OVA特异性IgE和BALF中细胞因子的检测采用ELISA法检测小鼠血清OVA特异性IgE水平,结果以OD值表示相对水平。参考试剂说明书,采用ELISA法检测BALF中的IL-4、IL-5和IL-13水平。
1.7 统计学处理应用SPSS 17.0软件进行统计分析。数据以均数±标准差 (x±s) 表示,采用单因素方差分析,P<0.05为差异有统计学意义。
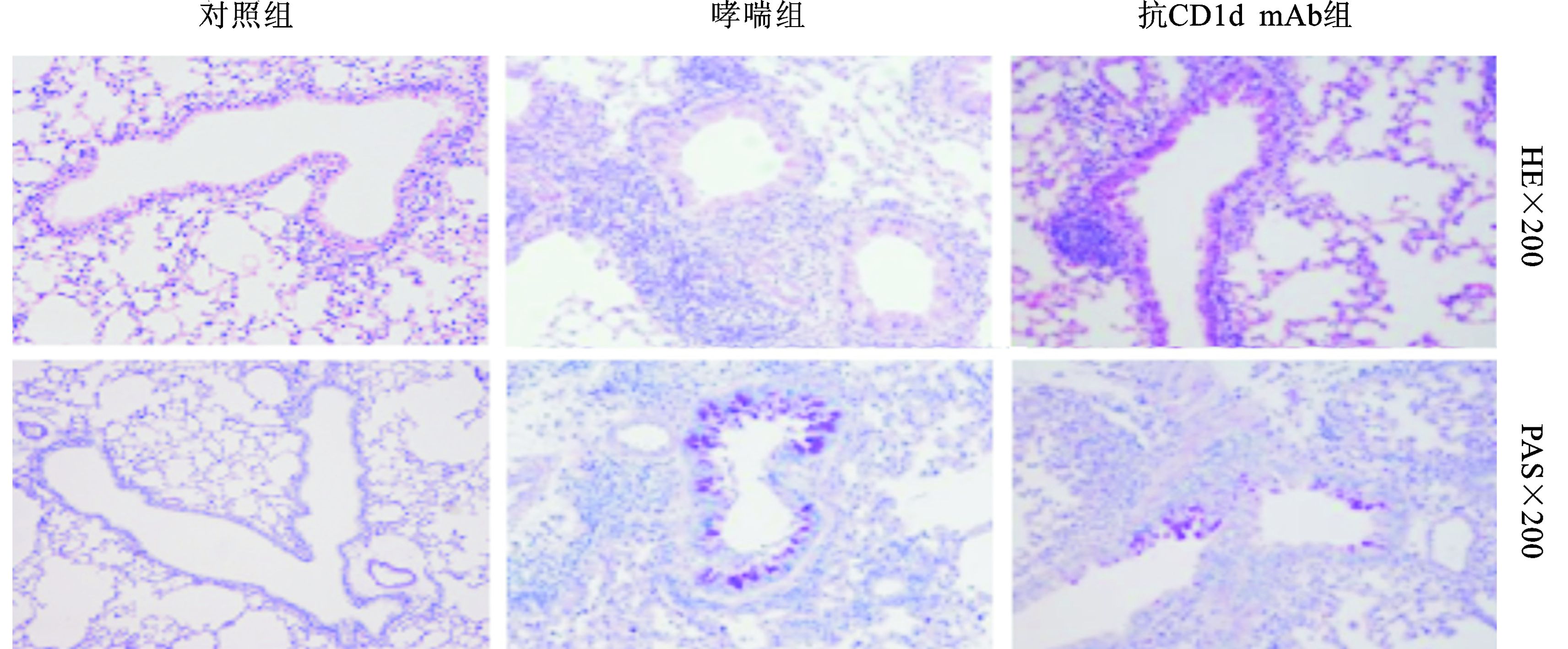
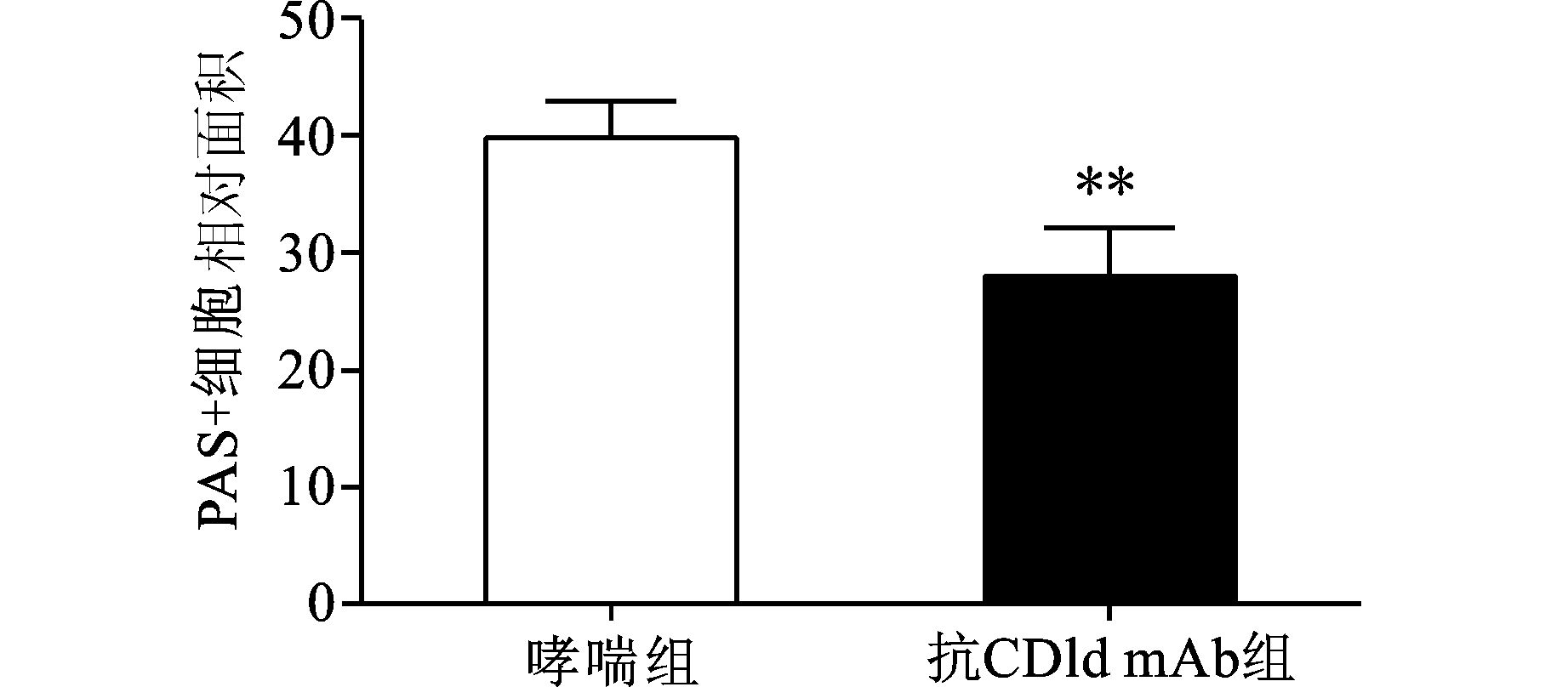
2 结果 2.1 各组HE和PAS染色采用HE和PAS染色评估小鼠气道炎症浸润和杯状细胞增生程度。对照组小鼠肺组织无炎症表现,气道基底膜上无PAS染色阳性细胞 (杯状细胞);哮喘组小鼠肺组织炎性浸润明显,气道基底膜上可见大量PAS阳性细胞;与哮喘组比较,抗CD1d单克隆抗体组小鼠肺组织炎症浸润明显减轻;气道基底膜上PAS阳性细胞明显减少,两组间比较差异有统计学意义 (P<0.01)(图 1、图 2)。
|
图 1 各组肺组织HE染色和PAS染色 |
|
图 2 各组支气管上皮细胞中PAS染色阳性细胞数相对面积 与哮喘组比较,**P<0.01 |
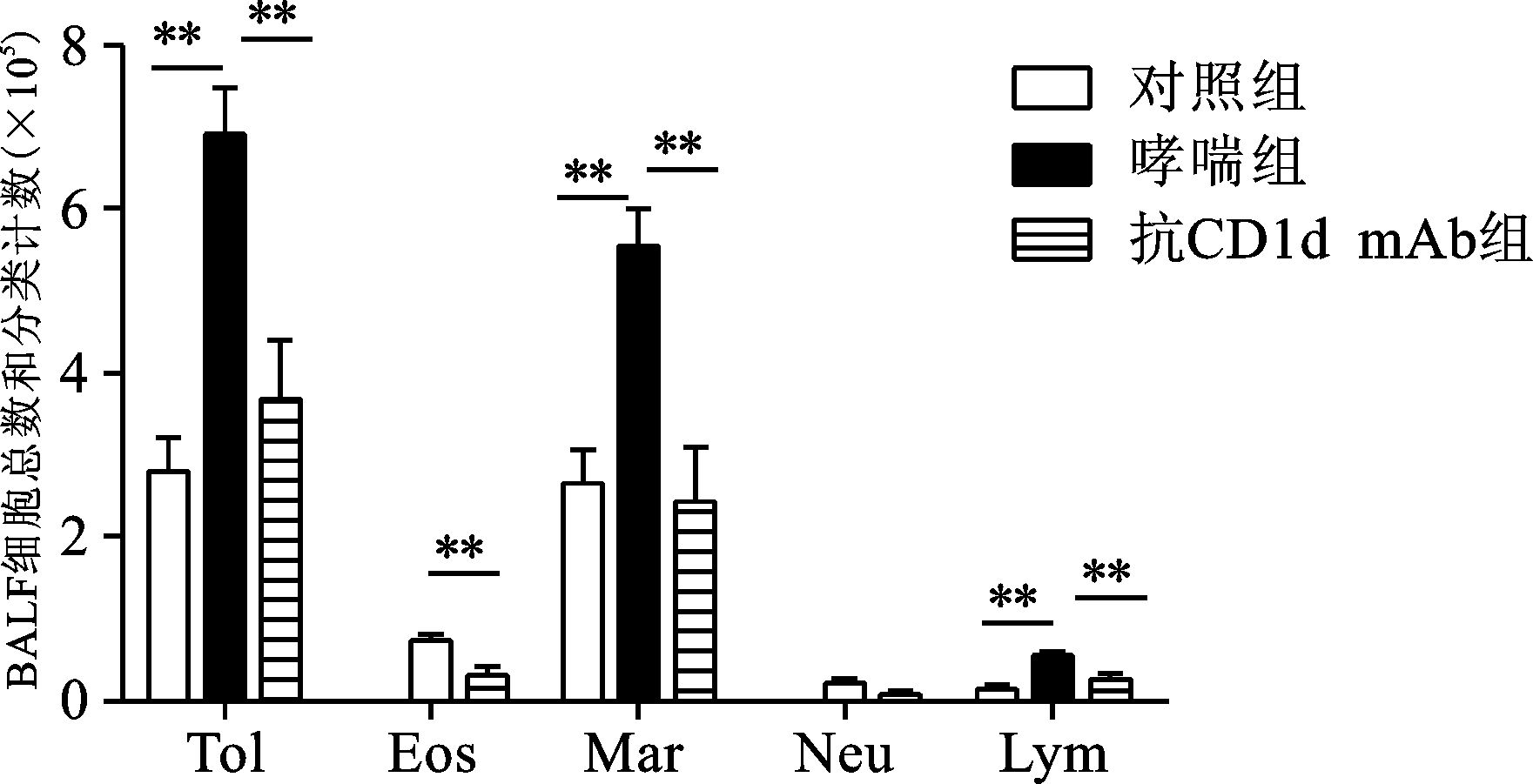
对照组小鼠BALF中细胞以巨噬细胞为主,少许淋巴细胞,未检测到嗜酸粒细胞、中性粒细胞。哮喘组小鼠BALF中细胞总数、巨噬细胞、嗜酸粒细胞、中性粒细胞和淋巴细胞计数均显著高于对照组;抗CD1d单克隆抗体组小鼠BALF中细胞总数及巨噬细胞、嗜酸粒细胞、淋巴细胞计数明显低于哮喘组 (均P<0.01)(图 3)。
|
图 3 各组BALF中细胞总数和分类计数比较 BALF,支气管肺泡灌洗液;Tol,细胞总数;Eos,嗜酸粒细胞;Mar,巨噬细胞;Neu,中性粒细胞;Lym,淋巴细胞;数据以x±s表示,两组间比较,**P<0.01 |
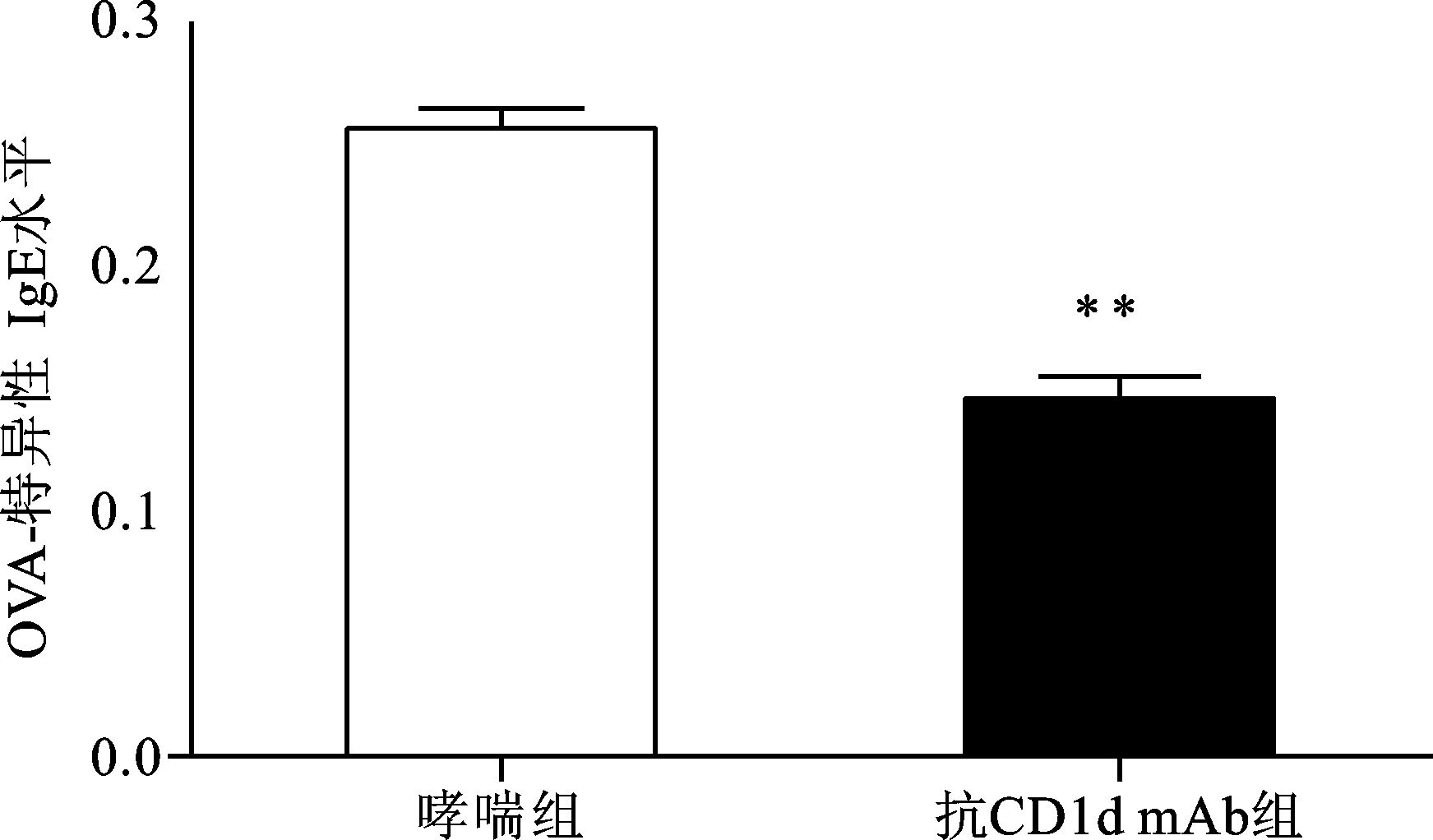
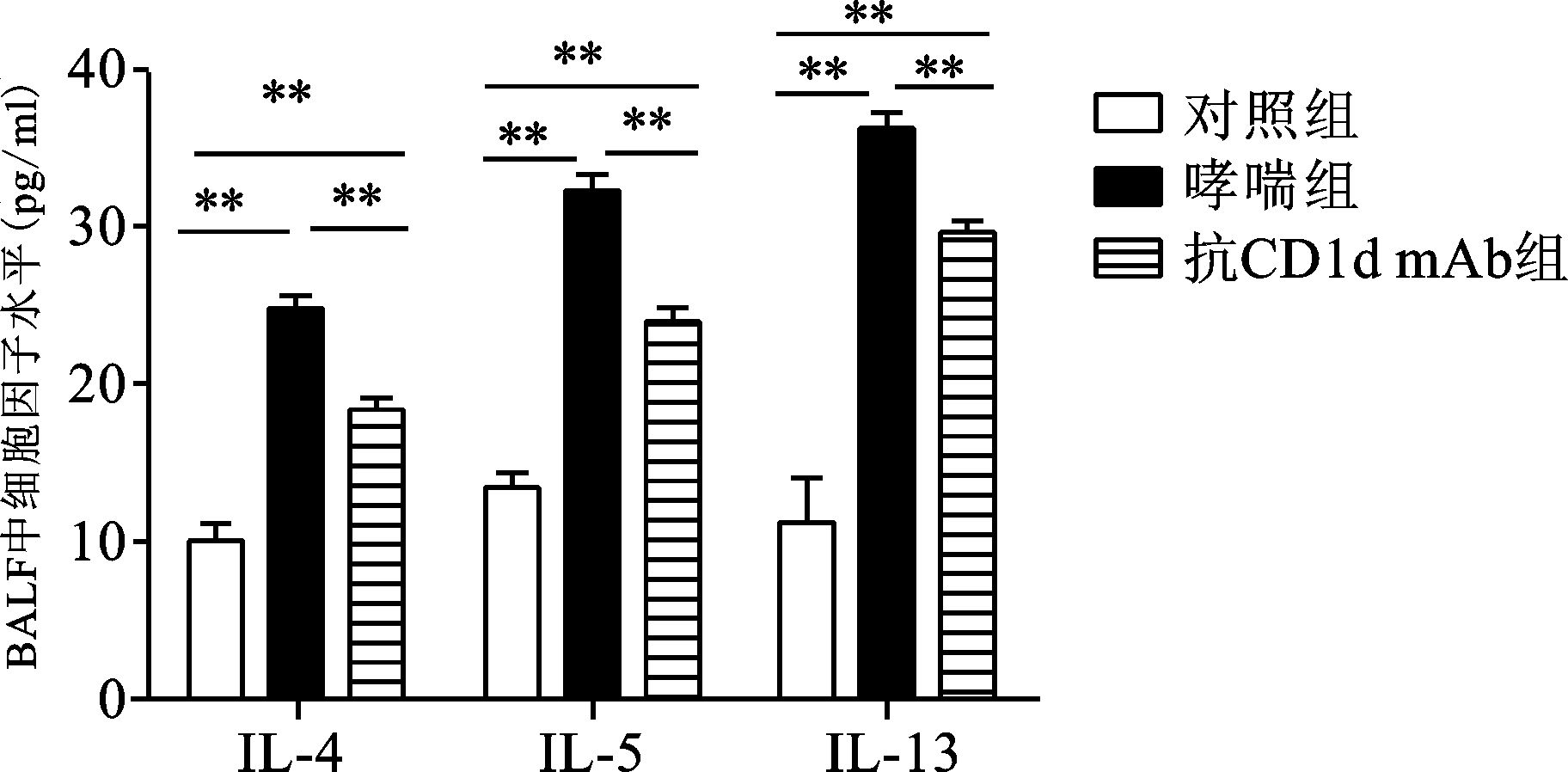
对照组小鼠中未检测到OVA特异性IgE。哮喘组和抗CD1d单克隆抗体组小鼠血清OVA特异性IgE的OD值分别为 (0.256±0.182) 和 (0.145±0.022),两组间比较差异有统计学意义 (P<0.01)(图 4)。抗CD1d单克隆抗体组小鼠BALF中IL-4、IL-5、IL-13水平明显低于哮喘组 (P<0.01),但明显高于对照组 (P<0.01)(图 5)。
|
图 4 各组血清中OVA特异性IgE水平比较 与哮喘组比较,**P<0.01 |
|
图 5 各组BALF中IL-4、IL-5和IL-13水平比较 两组间比较,**P<0.01 |
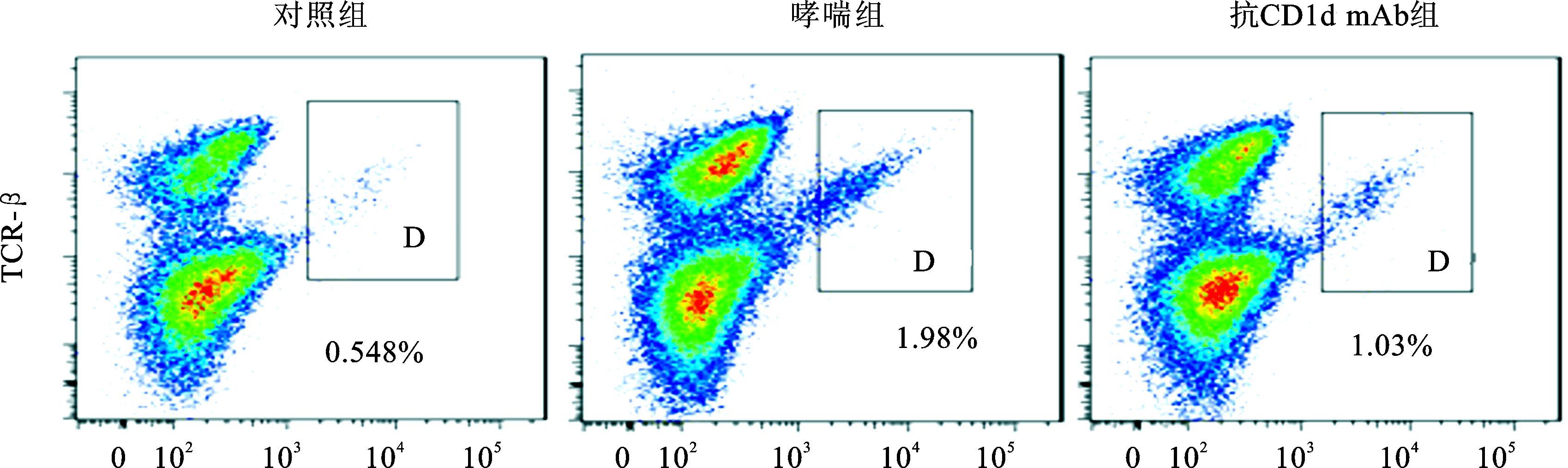
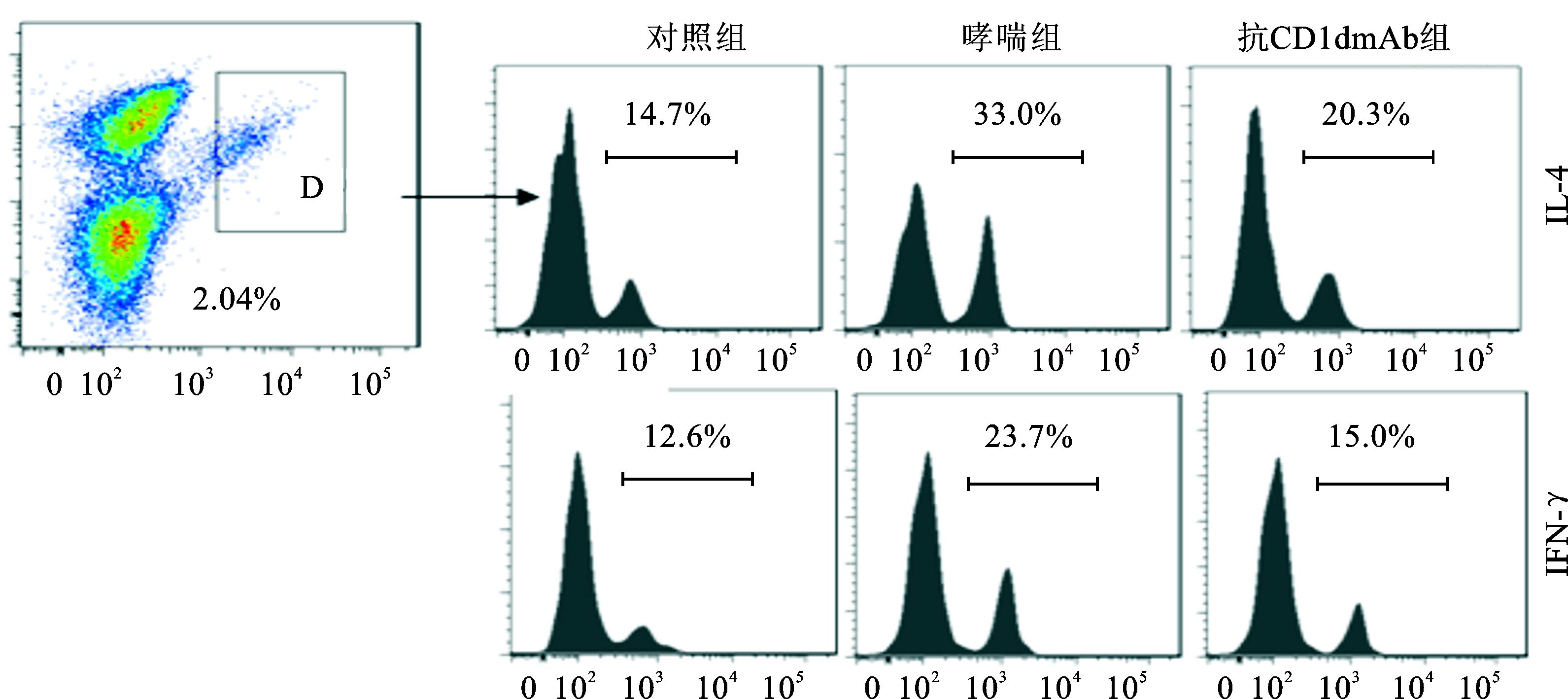
抗CD1d单克隆抗体组小鼠肺Ⅰ型NKT细胞数量明显低于哮喘组,但明显高于对照组 (P<0.01)。以分泌细胞因子IL-4和IFN-γ作为Ⅰ型NKT细胞活化水平,抗CD1d单克隆抗体组小鼠肺IL-4+和IFN-γ+ Ⅰ型NKT细胞的百分数明显低于哮喘组,但明显高于对照组 (P<0.01)(图 6、7,表 1)。
|
图 6 各组肺Ⅰ型NKT细胞占肺单个核细胞 (MNCs) 的百分数比较 D门下的百分数表示肺Ⅰ型NKT细胞 (PBS-57/小鼠CD1d四聚体+ TCR-β+细胞) 占肺单个核细胞 (MNCs) 的百分数 |
|
图 7 各组肺IL-4+和IFN-γ+ Ⅰ型NKT细胞占肺Ⅰ型NKT细胞百分数比较 横线上的百分数表示分泌IL-4(上图) 和IFN-γ(下图) 的Ⅰ型NKT细胞占肺Ⅰ型NKT细胞百分数 |
| 表 1 流式细胞术检测肺MNCs中Ⅰ型NKT细胞数量和活性比较 (x±s) |
哮喘是由多种细胞和细胞成分参与的慢性炎症性疾病,慢性气道炎症、气道高反应和黏液分泌增加是其主要特征。经典观念认为CD4+Th2细胞是哮喘发病的重要环节,它通过产生Th2类细胞因子,如IL-4、IL-5、IL-13等参与形成气道炎症和气道高反应[5]。目前认为除了Th2细胞,NKT细胞等也参与哮喘的形成[6]。NKT细胞表达CD1d限制性T细胞抗原受体 (T cell receptors,TCRs),它识别的抗原不是MHC分子提呈的肽类抗原,而是由非经典的MHC样分子CD1d提呈的脂类抗原。根据TCRs特征,将NKT细胞分为Ⅰ型NKT细胞和Ⅱ型NKT细胞[2]。目前Ⅰ型NKT细胞在支气管哮喘发生中的作用备受关注。研究显示腹腔注射外源性糖脂类抗原α半乳糖神经酰胺 (α-GalCer) 可以通过活化Ⅰ型NKT细胞增强OVA诱导的哮喘小鼠气道炎症;过继转移活化的Ⅰ型NKT细胞可以增强哮喘小鼠气道炎症,同时采用OVA致敏和激发缺乏Ⅰ型NKT细胞的CD1d-/-小鼠,发现小鼠Th2炎症反应明显减轻[7-9]。这些研究提示Ⅰ型NKT细胞可以增强哮喘小鼠气道炎症。研究显示通过诱导Ⅰ型NKT细胞分泌白细胞介素-4可以减轻小鼠自身免疫性脑脊髓炎的严重程度,且这种作用依赖CD1d分子[10]。因此干预Ⅰ型NKT细胞的免疫调节功能可能为哮喘提供新的治疗靶点。本研究通过建立BALB/c小鼠哮喘模型,结果发现OVA致敏和激发使小鼠肺组织炎性细胞浸润明显,杯状细胞明显增生,BALF中细胞总数及巨噬细胞、嗜酸粒细胞等数量明显增加,血清中OVA特异性IgE以及BALF中IL-4、IL-5、IL-13水平明显增高;经尾静脉注射抗CD1d单克隆抗体可以减轻小鼠肺组织炎性细胞浸润及杯状细胞增生,降低BALF中细胞总数和嗜酸粒细胞数量以及血清中OVA特异性IgE和BALF中IL-4、IL-5、IL-13水平,结果提示尾静脉注射抗CD1d单克隆抗体可以减轻哮喘小鼠气道炎症。
目前认为Ⅰ型NKT细胞活化需要两个信号,TCR识别CD1d-脂质复合体构成的第一信号和抗原提呈细胞产生的细胞因子,如IL-12构成的第二信号[11]。Ⅰ型NKT细胞活化依赖CD1d分子递呈的内源性或者外源性脂类抗原[12]。我们研究发现抗CD1d单克隆抗体组小鼠肺Ⅰ型NKT细胞和IL-4+和IFN-γ+ Ⅰ型NKT细胞数量明显低于哮喘组,结果提示抗CD1d单克隆抗体可以降低Ⅰ型NKT细胞的活化水平。由于树突状细胞是最主要的抗原提呈细胞,是参与哮喘Th2免疫反应的重要环节。Abós-Gracia等研究发现橄榄树花粉可以通过上调树突状细胞表面CD1d的表达活化Ⅰ型NKT细胞,同时伴随DC表面CD86的升高[13]。因此我们推测抗CD1d单克隆抗体可能通过抑制树突状细胞抗原提呈功能降低Ⅰ型NKT细胞活性,进一步减轻哮喘小鼠的气道炎症,但仍需进一步研究。
综上所述,抗CD1d单克隆抗体可能通过抑制肺Ⅰ型NKT细胞活性减轻哮喘小鼠气道炎症,这可能成为哮喘治疗的新靶点。
| [1] | Zajonc DM, Maricic I, Wu D, et al. Structural basis for CD1d presentation of a sulfatide derived from myelin and its implications for autoimmunity[J]. J Exp Med, 2005, 202(11): 1517-1526. DOI: 10.1084/jem.20051625. |
| [2] | Balato A, Unutmaz D, Gaspari AA. Natural killer T cells: an unconventional T-cell subset with diverse effector and regulatory functions[J]. J Invest Dermatol, 2009, 129(27): 1628-1642. |
| [3] | Umetsu DT, DeKruyff RH. Natural killer T cells are important in the pathogenesis of asthma: The many pathways to asthma[J]. J Allergy Clin Immunol, 2010, 125(5): 975-979. DOI: 10.1016/j.jaci.2010.02.006. |
| [4] | Rossjohn J, Pellicci DG, Patel O, et al. Recognition of CD1d-restricted antigens by natural killer T cells[J]. Nat Rev Immunol, 2012, 12(12): 845-857. DOI: 10.1038/nri3328. |
| [5] | Robinson DS. The role of the T cell in asthma[J]. J Allergy Clin Immunol, 2010, 126(6): 1081-1091. DOI: 10.1016/j.jaci.2010.06.025. |
| [6] | Lloyd CM, Hessel EM. Function of T cells in asthma: more than just TH2 cells[J]. Nat Rev Immunol, 2010, 10(12): 838-848. DOI: 10.1038/nri2870. |
| [7] |
张固琴, 聂汉祥, 刘敏, 等. α半乳糖神经酰胺活化iNKT细胞对哮喘小鼠过敏性气道炎症的影响[J].
武汉大学学报:医学版, 2013, 34(4): 499-503.
Zhang GQ, Nie HX, Liu M, et al. Effect of alpha-galcer activated iNKT cells on allergic airway inflammation in mouse asthma[J]. Medical Journal of Wuhan University, 2013, 34(4): 499-503. |
| [8] | Nie HX, Yang QY, Zhang GQ, et al. Invariant NKT cells act as an adjuvant to enhance Th2 inflammatory response in an OVA-induced mouse model of asthma[J]. PLoS One, 2015, 10(4): e0119901. DOI: 10.1371/journal.pone.0119901. |
| [9] |
王爱玲, 张固琴, 杨巧玉, 等. Ⅰ型NKT细胞在哮喘小鼠气道炎症形成中的作用[J].
武汉大学学报:医学版, 2016, 37(1): 42-46.
Wang AL, Zhang GQ, Yang QY, et al. Role of typeⅠ natural killer T cell in airway inflammation in an OVA-induced mouse model of asthma[J]. Medical Journal of Wuhan University, 2016, 37(1): 42-46. |
| [10] | Jahng AW, Maricic I, Pedersen B, et al. Action of natural killer T cells potentiates or prevents experimental autoimmune encephalomyelitis[J]. J Exp Med, 2001, 194(12): 1789-1799. DOI: 10.1084/jem.194.12.1789. |
| [11] | Brigl M, Tatituri RV, Watts GF, et al. Innate and cytokine-driven signals, rather than microbial antigens, dominate in natural killer T cell activation during microbial infection[J]. J Exp Med, 2011, 208(6): 1163-1177. DOI: 10.1084/jem.20102555. |
| [12] | Rossjohn J, Pellicci DG, Patel O, et al. Recognition of CD1d-restricted antigens by natural killer T cells[J]. Nat Rev Immunol, 2012, 2(12): 845-857. |
| [13] | Abós-Gracia B, Del Moral MG, López-Relacño J, et al. Olea europaea pollen lipids activate invariant natural killer T cells by upregulating CD1d expression on dendritic cells[J]. J Allergy Clin Immunol, 2013, 131(5): 1393-1399. DOI: 10.1016/j.jaci.2012.11.014. |
 2017, Vol. 38
2017, Vol. 38

