2. 武汉大学人民医院消化内科 湖北 武汉 430060;
3. 南昌大学第二附属医院消化内科 江西 南昌 330006
2. Dept. of Gastroenterology, Renmin Hospital of Wuhan University, Wuhan 430060, China;
3. Dept. of Gastroenterology, The Second Affiliated Hospital, Nanchang University, Nanchang 330006, China
肿瘤细胞侵袭转移是恶性肿瘤的基本特征和重要标志之一,也是导致多数恶性肿瘤患者死亡的主要原因[1]。肿瘤细胞侵袭转移是一个多步骤、多因素参与的复杂过程。而细胞间的黏附在这过程中起双重作用:一方面,肿瘤细胞必须先从其原发灶的黏附部位脱离后才能侵袭,故黏附可抑制侵袭;另一方面,肿瘤细胞从连续的黏附和去黏附中获得运动的牵引力,正是借助这种牵引力肿瘤细胞才能够进行移动。
钙黏连蛋白是Ca2+依赖的介导同源细胞间相互黏附的多基因家族。目前已经发现了100多个钙黏连蛋白家族成员,除了经典钙黏连蛋白外,在1994年Berndorff等人发现了一个非经典钙黏连蛋白家族新成员——肠肝钙黏连蛋白(Liver-intestine cadherin,LI-cadherin),该蛋白最先是在大鼠的肝细胞和肠上皮细胞被发现,故被命名为LI-cadherin[2]。研究表明LI-cadherin异常表达与食管癌、结肠癌、胰腺导管腺癌、肝内胆管细胞癌、肾母细胞瘤和肾细胞癌、肝细胞癌、卵巢上皮癌、神经内分泌肿瘤、乳腺癌、膀胱原位性腺癌及胃癌等多种恶性肿瘤的发生、发展、侵袭转移及预后密切相关,LI-cadherin在预后和治疗效果评估方面是有价值的肿瘤标志物[3-9]。
1 LI-cadherin的结构和生物学特性钙黏连蛋白是一类Ca2+依赖性的糖蛋白超家族,根据蛋白质的结构域和基因组结构的差异,可以将钙黏蛋白家族成员主要分为6个亚家族:经典钙黏连蛋白(classical/type Ⅰ cadherins)、非经典钙黏连蛋白(atypical/type Ⅱ cadherin)、桥粒钙黏连蛋白(desmosomal cadherin)、桥粒芯黏连蛋白(desmogleins)、原钙黏连蛋白(protocadherins)、佛拉明戈黏连蛋白(flamingo cadherins)以及其他类型钙黏连蛋白。大多数钙黏连蛋白有着相似的结构,典型特征是拥有5个钙黏连蛋白重复区(exstracellular cadherin,EC)。这相似的结构也使它们拥有共同的生物学功能:细胞黏附、细胞识别、调控组织器官形态的发生和维持、介导细胞信号转导甚至神经传导等。而黏附是肿瘤侵袭和转移过程中的一个关键环节,如果黏附分子的功能异常,细胞之间的黏连功能就会出现紊乱,从而导致组织细胞结构改变和功能异常。
LI-cadherin又被称为人类肽链转移因子-1(human peptide transporter-1,HPT-1) 或钙黏蛋白-17(cadherin-17,CDH17),由832个氨基酸组成,与经典钙黏连蛋白大约有20%-30%相似性。LI-cadherin与其他钙黏连蛋白相比在结构和功能上都有着很大的不同[2],与经典的上皮细胞钙黏蛋白(epithelial-cadherin,E-cadherin)的结构区别主要在于(图 1):细胞外部分,LI-cadherin具有7个结构域,而E-cadherin为5个;细胞质部分,LI-cadherin胞质尾区只有大概25个氨基酸残基,而E-cadherin高度保守,含有150-160个氨基酸残基;其胞内段结构与经典E-cadherin完全不同。因此LI-cadherin与钙黏连蛋白超家族其他成员之间并没有较多的相似性。
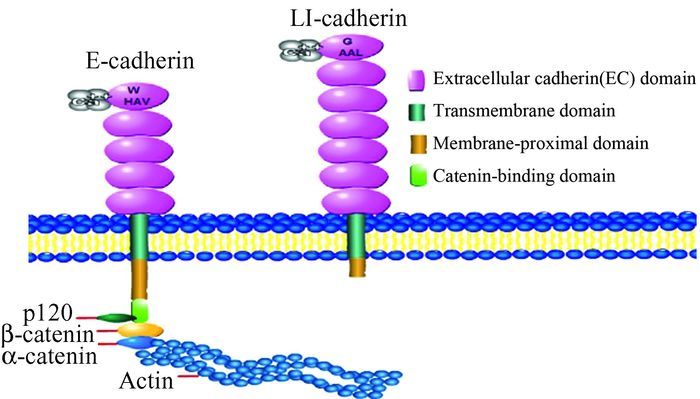
|
图 1 上皮细胞钙黏连蛋白和肝肠钙黏连蛋白的主要结构 |
尽管LI-cadherin明显短小的胞质尾区与经典钙黏连蛋白高度保守的胞质尾区没有同源性,但作为非经典钙黏连蛋白超家族成员之一,LI-cadherin仍然可以依赖Ca2+介导同种细胞间的黏附。Kreft等[10]检测了LI-cadherin的细胞黏附功能是否依赖链蛋白、肌动蛋白细胞骨架或胞质内的其他元件,以及是否需要突变蛋白的相互作用。该研究表明了LI-cadherin的黏附功能与其他细胞质内成分是相互独立的,即其对经典钙黏连蛋白所介导的细胞黏附的调控机制并不敏感,而且可能在经典钙黏连蛋白功能下调的情况下仍然具有介导细胞黏附功能。LI-cadherin作为钙黏连蛋白超家族中结构特殊的一员,除了黏附功能外,近年来的一些相关研究报道了它的特殊生理功能:① 同型LI-cadherin蛋白分子的相互作用是以高效协同的方式与Ca2+结合[11];② LI-cadherin在含胆固醇高的膜部位表达,这使其具有横向移动性[12];③ LI-cadherin可能参与了肠肽运输作用[13];④ LI-cadherin可能参与了上皮细胞中的水分重吸收[14]。
2 LI-cadherin蛋白在人类肿瘤中的异常表达研究表明钙黏连蛋白常在肿瘤细胞中低表达,从而引起肿瘤细胞间黏连的改变,进而使细胞移动能力增加,导致肿瘤细胞侵袭转移。LI-cadherin作为非经典钙黏连蛋白超家族成员之一,其也有这样的特性,但LI-cadherin的特异性结构决定了其功能与其他钙黏连蛋白存在差异。LI-cadherin在不同肿瘤组织中的表达水平也不尽相同,在有些肿瘤组织中高表达,而在另一部分肿瘤组织中低表达或表达缺失。但众多研究表明LI-cadherin在肿瘤的发生发展过程中起重要作用,并与肿瘤组织细胞的侵袭转移密切相关。下面将具体阐述LI-cadherin与不同肿瘤的关系。
2.1 LI-cadherin低表达与肿瘤 2.1.1 LI-cadherin与食管癌流行病学、组织学和分子生物学的研究均提示胃食管反流病(gastroesophageal reflux disease,GERD)可发展为Barrett's食管(barrett's esophagus,BE),进而发展为食管腺癌(esophageal adenocarcinoma,ADC)。Mokrowiecka等[15]通过检测贲门部胃黏膜、BE、胃黏膜上皮内瘤变(intraepithelial neoplasia,IEN)和ADC中的LI-cadherin表达水平来评价其与临床病理参数的意义,发现LI-cadherin的表达水平逐渐降低与BE发展为ADC的过程密切相关。席玉[16]等发现ADC组织中LI-cadherin表达水平随着肿瘤分化程度的降低、浸润深度的增加和肿瘤细胞淋巴结的转移而降低,表明LI-cadherin在细胞间黏附中起重要作用,且维系着肿瘤上皮细胞株的形态完整性,如果这种完整性遭到破坏,癌细胞株即可获得侵袭能力,加速癌细胞的侵袭转移。王苒等[3]发现LI-cadherin在食管鳞癌(esophageal squamous cell carcinoma,ESCC)组织中呈现明显低表达或表达缺失,且在食管癌旁的各级癌前病变组织中,LI-cadherin的表达阳性率随着病变严重程度的加重而呈现下降的趋势,提示LI-cadherin可能在食管癌变的早期就参与了癌变的过程,可作为评估食管癌患者病情发展的重要参考指标。
2.1.2 LI-cadherin与结肠癌Lin等[4]通过探讨CDH-17和特定富含AT碱基DNA序列结合蛋白2(Special AT-rich sequence-binding protein2,SATB2) 以及其他标记在大量的大肠髓样癌和正常组织中的表达情况,来进一步检测它们的临床诊断特异性。研究得出LI-cadherin和SATB2是大肠髓样腺癌的高度敏感特异的标记物,并提出LI-cadherin、SATB2和Mut L同源基因1(mut L homolog 1,MLH1) 是用来区分未知的原位癌的常规免疫染色指标, 尤其是诊断老年人患者有CK7-/CK20-肿瘤时。张志广等[17]研究显示结直肠癌(colorectal cancer,CRC)中LI-cadherin表达阳性率较正常黏膜明显降低,且癌组织分化程度越低,LI-cadherin表达阳性率越低,说明拥有细胞间紧密连接的分化良好的细胞保持了LI-cadherin的表达能力,而低分化者则减弱或丧失了表达能力。Takamura等[18]首次检测了LI-cadherin蛋白在4种人类结肠癌细胞株中的表达水平,其中LI-cadherin蛋白在高分化SW1116细胞中高表达,而在低分化HT29、HCT15和COLO201细胞中未见表达。他们也调查了LI-cadherin与CRC临床病理参数关系,研究表明LI-cadherin在低分化的CRC中表达量越低,越能够促进肿瘤细胞的侵袭转移,并进行统计分析得出LI-cadherin低表达模式与肿瘤低分化水平、淋巴结转移、以及pTNM进展期具有相关性。在最近研究中,余琼芳等人[19]采用短发夹RNA (short hairpin RNA,shRNA)技术沉默LOVO细胞LI-cadherin基因,可显著增加基质金属蛋白酶-2(matrix metalloproteinases-2,MMP-2) 和基质金属蛋白酶-9(matrix metalloproteinases-9,MMP-9) 的mRNA表达水平及其活性,并显著降低半乳凝素3(galectin-3) 的蛋白表达水平,从而使结肠癌细胞因失去细胞外基质而增强黏附和迁徙能力。
2.1.3 LI-cadherin与胰腺癌胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous tumor,IPMN)是胰腺癌的重要癌前病变之一,Morimatsu等[5]研究了LI-cadherin与IPMN的关系,发现LI-cadherin诱导了IPMN的肠型分化及癌变,且随着IPMN级别的增高,LI-cadherin的表达水平亦增高。但是胰腺癌变后,低分化或未分化的胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)组中LI-cadherin的表达强度比高分化的PDAC显著降低,LI-cadherin的表达量与总体生存率呈正相关,而与肿瘤的恶性程度呈负相关,且LI-cadherin可与半乳凝素3(galectin-3) 结合,共同参与PDAC发生发展和预后的调控。以上研究表明LI-cadherin参与了胰腺癌变的过程,LI-cadherin表达水平逐渐增高而诱发胰腺癌变后,随着胰腺癌恶性程度的加重,其表达水平却又逐渐降低。
2.1.4 LI-cadherin与肝内胆管细胞癌肝内胆管细胞癌(intrahepatic cholangiocellular carcinoma,ICC)是起源于肝内胆管上皮细胞的一种相对少见的恶性肿瘤。已有研究报道在34例手术切除ICC中,LI-cadherin在正常胆管上皮不表达,而在高分化的ICC中高表达,在低分化的ICC中低表达[20]。最近,Inoue等人[21]利用免疫组织化学检测到LI-cadherin在16例不伴有肝内胆管结石ICC的胆管上皮内瘤变(biliary intraepithelial neoplasia,BilIN)中有表达。其表达逐渐上调与BilIN组织病理学的发展有关,高级别的BilIN是LI-cadherin表达相关的一个重要因素,这些研究说明LI-cadherin过表达可能参与了BilIN的发展过程。
2.1.5 LI-cadherin与肾母细胞瘤和肾细胞癌后肾腺瘤(metanephric adenoma,MA)是一种罕见的肾脏上皮组织良性肿瘤,肿瘤方式可分为小腺泡状、管状、乳头状、肾小球和花蕾样结构以及囊状结构。MA在形态上与肾母细胞瘤(Wilm’s tumor,WT)和乳头状肾细胞癌(papillary renal cell carcinoma,PRCC)1型类似,且临床症状也存在一定程度的相似性,影像学检测均表现为肾脏肿块,不具特异性,对该肿瘤的诊断帮助有限。Yakirevich等[6]采用免疫组织化学方法检测LI-cadherin、CD57、AMACR、WT-1、CDX2在WT、PRCC、MA中的表达,结果表明LI-cadherin在正常成人肾实质中染色阴性,在MA中的腺泡、管状、乳头状等结构中都有表达,而在WT、PRCC所有病例中都不表达。该研究表明LI-cadherin相对于WT、PRCC,其是MA的一个敏感和特异性高的标志物,可用于WT、PRCC和MA的鉴别诊断。
2.2 LI-cadherin高表达与肿瘤 2.2.1 LI-cadherin与肝细胞癌Wong等[22]首次报道了LI-cadherin在肝细胞癌(hepatocellular carcinoma,HCC)细胞株和HCC组织中呈高表达模式。Ding等[23]人研究发现高侵袭性HCCLM3细胞的LI-cadherin的mRNA和蛋白表达水平显著高于低侵袭性PLC/PRF/5和Hep3B细胞中的表达,HCCLM3细胞的LI-cadherin基因低表达可降低该细胞的侵袭转移能力。该研究中又发现了一个异常结果,即在已报道的其他恶性肿瘤中,LI-cadherin主要固定表达细胞质中,但在HCC中其似乎更偏向表达于细胞膜上,这种不同的表达模式可能与HBV相关的HCC侵袭转移和预后不良有关。在体内和体外实验的研究中,Liu等[24]利用RNAi技术沉默LI-cadherin基因可阻滞原发性HCC和高侵袭性HCC细胞的增殖和扩散,其机制是LI-cadherin阻断了Wnt/β-catenin信号通路并同时激活了肿瘤抑癌基因,从而促进了肿瘤细胞的死亡。
可变剪接是生成蛋白质多样性的一个关键因素,肿瘤细胞中存在大量的异常可变剪接。在50例HCC患者组织中,Wang等[25]发现有近一半的HCC患者存在LI-cadherin基因的mRNA可变剪接,并发现了缺失外显子7的LI-cadherin基因,该基因在HCC患者中的表达量显著升高。Lee等[26]也发现LI-cadherin在HCC中的表达明显上调,基因的遗传多态性及剪切异构体能够增加正常人群HCC的发生风险。但是,HCC患者体内LI-cadherin拼接的具体分子机制还不大清楚,LI-cadherin蛋白作为HCC预后不良的潜在指标,这还需要大量的研究和临床分析。
2.2.2 LI-cadherin与卵巢上皮癌卵巢上皮癌(epithelial ovarian cancer,EOC)是女性生殖系统常见的恶性肿瘤之一,发病率仅次于子宫颈癌和子宫体癌,居第3位。Huang等[7]发现,LI-cadherin在低分化、高分化期的卵巢上皮癌EOC高表达,较高的表达水平与预后不良有关,多因素分析显示LI-cadherin是EOC的一个独立的预后指标。
2.2.3 LI-cadherin与神经内分泌肿瘤Snow等[8]首次全面检测了前肠、中肠、后肠以及侵袭转移到肝脏的高分化神经内分泌肿瘤(well-differentiated neuroendocrine tumor,WDNENT)组织中的LI-cadherin表达水平,发现LI-cadherin在WDNENT中表达,且后肠的WDNET普遍表达LI-cadherin。该研究还证实LI-cadherin是中肠的WDENT一个敏感的标记,且LI-cadherin+/CDX2-/TTF1-表型在后肠WDENT的敏感度和特异性分别可以达到92%和91%。
2.2.4 LI-cadherin与膀胱腺癌膀胱腺癌分为原发性与继发性,二者在临床上很难鉴别。Rao等[9]研究了25例原发性膀胱腺癌、25例由结直肠癌转移到膀胱的继发性膀胱腺癌和11例伴有腺分化的尿路上皮癌的患者,发现LI-cadherin在原发性膀胱腺癌和继发性膀胱腺癌的表达阳性率都可达92%,但是在伴腺分化的尿路上皮癌组织中却不表达。该研究还证实β-catenin在原发性膀胱腺癌细胞膜和细胞质的表达阳性率达92%,而在继发性膀胱腺癌细胞核的表达阳性率达92%。以上研究表明LI-cadherin在原发性膀胱腺癌与继发性膀胱腺癌都呈高表达模式,且LI-cadherin与β-catenin是共同鉴别原发性膀胱腺癌与继发性膀胱腺癌的有效标记物。
2.3 LI-cadherin异常表达与胃癌LI-cadherin的表达水平与胃癌(gastric cancer,GC)的临床分期和患者预后的关系存在一定的争议。有研究发现LI-cadherin高表达于高分化GC的早期阶段,而在发生淋巴结转移的GC中却呈低表达水平[27]。Lee等[28]发现LI-cadherin在临床病理Ⅰ期或未发生淋巴结转移的GC中的表达水平显著高于进展期GC,且证实LI-cadherin高表达是一个影响早期GC患者预后的独立生物标记物。然而王苒等[3]发现LI-cadherin在贲门癌及其周围组织中的阳性表达率随着病变程度的加重而呈现上升趋势,在贲门癌组织中的表达率最高,而在癌旁正常上皮组织中LI-cadherin则为低表达,且贲门癌淋巴结转移患者LI-cadherin阳性表达率明显高于淋巴结未转移患者,提示高表达的LI-cadherin可能与患者预后差有关。该研究还特别观察到LI-cadherin在贲门肠上皮化生组织中的阳性表达尤为明显,表达率为63%,结合贲门癌LI-cadherin表达阳性率研究结果提示LI-cadherin在肠化中的表达可能参与了贲门肠上皮化生的相关分子改变,并与贲门癌变的恶性程度相关,可能是贲门癌前病变肠化组织细胞的生物学标记物。Ge等[29]发现LI-cadherin基因在进展期GC中表达上调,且其高表达水平与进展期的GC浸润深度有关,并进一步分析得出LI-cadherin在进展期GC中的表达水平显著高于早期GC。更有趣的事是在胃癌细胞系中的实验研究报道中,奚海林等[30]利用脂质体将pcDNA3.1(-)/CDH17真核表达重组脂粒分别转染入胃癌细胞BGC-826,BGC-823细胞中,应用体外的侵袭实验、迁移实验、增殖实验来检测LI-cadherin对胃癌细胞的侵袭迁移能力、黏附能力的影响,实验结果分别显示:LI-cadherin基因在BGC-826细胞中过表达能降低胃腺癌的增殖、侵袭及迁移能力;而LI-cadherin基因在BGC-823细胞中过表达能提高胃腺癌的增殖、侵袭及迁移能力,并促进胃腺癌的发生及发展。Xu等[31]和Wang等[32]分别沉默BGC-823细胞和MKN-45细胞中的LI-cadherin基因表达,结果发现LI-cadherin基因表达下调能够降低BGC-823和MKN-45细胞的侵袭转移能力。
虽然上述显示了LI-cadherin在GC中的异常表达的研究存在一定的争议,但目前LI-cadherin在GC的发生、发展过程中起重要的作用已得到初步的证实,其可能涉及的分子机制如下:① LI-cadherin的上调表达可以激活Wnt信号转导通路,使β-catenin在胞质中累积并进入细胞核后与T细胞因子形成复合物,最终上调下游靶基因如cyclin D1、c-myc的表达,从而促进细胞增殖,抑制细胞凋亡[33];LI-cadherin的上调表达还可以激活NFκB信号通路,促进下游蛋白VEGF-C和MMP-9的表达,从而诱导肿瘤的血管生成和淋巴结转移[32]。② LI-cadherin可以显著增强MMP-2和MMP-9的活性,使基底膜和细胞外基质降解,利于肿瘤细胞的浸润、转移[33];③ LI-cadherin抑制Rb基因,从而使细胞周期调节失控,导致细胞无限增殖[34]。
3 问题与展望作为非经典钙黏连蛋白超家族成员之一的LI-cadherin,虽然其结构的特殊性决定了其生物学功能与其他钙黏连蛋白存在差异,但众多研究表明LI-cadherin在肿瘤发生、发展的演变过程中起重要作用,并与肿瘤细胞的侵袭转移密切相关。目前研究发现LI-cadherin可能通过表达水平逐渐增高而诱发正常组织恶变后,又通过其表达水平逐渐降低而增加肿瘤的恶性程度和肿瘤细胞的侵袭转移能力,但是LI-cadherin以这种异常表达的方式参与不同肿瘤细胞的发生、发展和侵袭转移的具体机制目前还不清楚。LI-cadherin在肿瘤组织中的作用机制也可能不止一种,除了有介导细胞间的黏附作用外,可能还有其他的功能作用,这些问题都有待进一步的研究。随着分子生物技术的提高及相关实验研究的进展,相信LI-cadherin在肿瘤发生、发展、侵袭及转移等过程中的分子机制将逐步明确,为肿瘤的诊断、防治、治疗等方面提供新的思路。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359-E386. DOI: 10.1002/ijc.29210. |
| [2] | Berndorff D, Gessner R, KreftB, et al. Liver-intestine cadherin: Molecular cloning and characterization of a novel Ca(2+)-dependent cell adhesion molecule expressed in liver and intestine[J]. J Cell Biol, 1994, 125(6): 1353-1369. DOI: 10.1083/jcb.125.6.1353. |
| [3] |
王苒. 河南食管癌高发区食管癌和贲门癌及癌前病变组织中钙粘连LI-cadherin的表达分析[D]. 河南: 郑州大学, 2006.
Wang R. Analysis on LI-cadherin expression in esophageal squamous cell carcinoma and gestric cardia adenocarcinoma from the high-incidence areas in Henan[D]. Zhenzhou: Zhengzhou University, 2006. https://www.baidu.com/link?url=ajgR-brtqOj_r4xoJGVN3yIhsxSS-R-kE-D7_CNssec-Xzhw_vuKhZHs8vLgRz-bRbDf6JrGbT2lE_rhRI-Kna&wd=&eqid=a664ac6c0002c2ed000000055975496d |
| [4] | Lin F, Shi JH, Zhu SB, et al. Cadherin-17 and SATB2 are sensitive and specific immunomarkers for medullary carcinoma of the large intestine[J]. Arch Pathol Lab Med, 2014, 138(8): 1015-1026. DOI: 10.5858/arpa.2013-0452-OA. |
| [5] | Morimatsu K, Aishima S, Kayashima T, et al. Liver-intestine cadherin expression is associated with intestinal differentiation and carcinogenesis in intraductal papillary mucinous neoplasm[J]. Pathobiology, 2012, 79(2): 107-114. DOI: 10.1159/000334269. |
| [6] | Yakirevich E, Magi-Galluzzi C, Grada Z, et al. Cadherin 17 is a sensitive and specific marker for metanephric adenoma[J]. Am J Surg Pathol, 2015, 39(4): 479-486. DOI: 10.1097/PAS.0000000000000401. |
| [7] | Huang LP, Yu YH, Sheng C, et al. Up-regulation of cadherin 17 and down-regulation of homeodomain protein cdx2 correlate with tumor progression and unfavorable prognosis in epithelial ovarian cancer[J]. Int J Gynecol Cancer, 2012, 22(7): 1170-1176. DOI: 10.1097/IGC.0b013e318261d89c. |
| [8] | Snow AN, Mangray S, Lu S, et al. Expression of cadherin 17 in well-differentiated neuroendocrine tumours[J]. Histopathology, 2015, 66(7): 1010-1021. DOI: 10.1111/his.2015.66.issue-7. |
| [9] | Rao Q, Williamson SR, Lopez-Beltran A, et al. Distinguishing primary adenocarcinoma of the urinary bladder from secondary involvement by colorectal adenocarcinoma: Extended immunohistochemical profiles emphasizing novel markers[J]. Mod Pathol, 2013, 26(5): 725-732. DOI: 10.1038/modpathol.2012.229. |
| [10] | Kreft B, Berndorff D, Bottinger A, et al. Li-cadherin-mediated cell-cell adhesion does not require cytoplasmic interactions[J]. J Cell Biol, 1997, 136(5): 1109-1121. DOI: 10.1083/jcb.136.5.1109. |
| [11] | Ahl M, Weth A, Walcher S, et al. The function of 7d-cadherins: A mathematical model predicts physiological importance for water transport through simple epithelia[J]. Theor Biol Med Model, 2011, 8: 18. DOI: 10.1186/1742-4682-8-18. |
| [12] | Bartolmas T, Hirschfeld-Ihlow C, Jonas S, et al. Li-cadherin cis-dimerizes in the plasma membrane Ca(2+) independently and forms highly dynamic trans-contacts[J]. Cell Mol Life Sci, 2012, 69(22): 3851-3862. DOI: 10.1007/s00018-012-1053-y. |
| [13] | Dantzig AH, Hoskins JA, Tabas LB, et al. Association of intestinal peptide transport with a protein related to the cadherin superfamily[J]. Science, 1994, 264(5 157): 430-433. |
| [14] | Baumgartner W. Possible roles of Li-cadherin in the formation and maintenance of the intestinal epithelial barrier[J]. Tissue Barriers, 2013, 1(1): e23815. DOI: 10.4161/tisb.23815. |
| [15] | Mokrowiecka A, Zonnur S, Veits L, et al. Liver-intestine-cadherin is a sensitive marker of intestinal differentiation during barrett's carcinogenesis[J]. Dig Dis Sci, 2013, 58(3): 699-705. DOI: 10.1007/s10620-012-2425-8. |
| [16] |
席玉, 殷云勤. VEGF和LI-cadherin与食管腺癌进展关系的研究[J].
当代医学, 2014, 20(14): 19-21.
Xi Y, Yin YQ. Research about relationship between VEGF, LI-cadherin and progresses of esophageal adenocarcinoma[J]. Contemp Med, 2014, 20(14): 19-21. DOI: 10.3969/j.issn.1009-4393.2014.14.011. |
| [17] |
张志广, 毕志林, 闻淑军. LI-钙黏蛋白在结直肠癌及腺瘤中表达的相关研究[J].
天津医药, 2009, 37(4): 251-253.
Zhang ZG, Bi ZL, Wen SJ. Associated study on the LI-cadherin expression in colorectal carcinoma and adenoma[J]. Tianjin Med J, 2009, 37(4): 251-253. |
| [18] | Takamura M, Ichida T, Matsuda Y, et al. Reduced expression of liver-intestine cadherin is associated with progression and lymph node metastasis of human colorectal carcinoma[J]. Cancer Lett, 2004, 212(2): 253-259. DOI: 10.1016/j.canlet.2004.03.016. |
| [19] | Yu Q, Shen W, Zhou H, et al. Knockdown of li-cadherin alters expression of matrix metalloproteinase-2 and -9 and galectin-3[J]. Mol Med Rep, 2016, 13(5): 4469-4474. |
| [20] | Takamura M, Yamagiwa S, Wakai T, et al. Loss of liver-intestine cadherin in human intrahepatic cholangiocarcinoma promotes angiogenesis by up-regulating metal-responsive transcription factor-1 and placental growth factor[J]. Int J Oncol, 2010, 36(1): 245-254. |
| [21] | Inoue M, Ajioka Y, Wakai T, et al. Liver-intestine cadherin in intraepithelial neoplasia of intrahepatic cholangiocarcinoma[J]. Hepatogastroenterology, 2011, 58(112): 2045-2051. |
| [22] | Wong BW, Luk JM, Ng IO, et al. Identification of liver-intestine cadherin in hepatocellular carcinoma—a potential disease marker[J]. Biochem Biophys Res Commun, 2003, 311(3): 618-624. DOI: 10.1016/j.bbrc.2003.10.032. |
| [23] | Ding ZB, Shi YH, Zhou J, et al. Liver-intestine cadherin predicts microvascular invasion and poor prognosis of hepatitis B virus-positive hepatocellular carcinoma[J]. Cancer, 2009, 115(20): 4753-4765. DOI: 10.1002/cncr.v115:20. |
| [24] | Liu LX, Lee NP, Chan VW, et al. Targeting cadherin-17 inactivates wnt signaling and inhibits tumor growth in liver carcinoma[J]. Hepatology, 2009, 50(5): 1453-1463. DOI: 10.1002/hep.23143. |
| [25] | Wang XQ, Luk JM, Leung PP, et al. Alternative mrna splicing of liver intestine-cadherin in hepatocellular carcinoma[J]. Clin Cancer Res, 2005, 11(2 Pt 1): 483-489. |
| [26] | Lee NP, Poon RT, Shek FH, et al. Role of cadherin-17 in oncogenesis and potential therapeutic implications in hepatocellular carcinoma[J]. Biochim Biophys Acta, 2010, 1806(2): 138-145. |
| [27] | Ko S, Chu KM, Luk JM, et al. Overexpression of li-cadherin in gastric cancer is associated with lymph node metastasis[J]. Biochem Biophys Res Commun, 2004, 319(2): 562-568. DOI: 10.1016/j.bbrc.2004.04.197. |
| [28] | Lee HJ, Nam KT, Park HS, et al. Gene expression profiling of metaplastic lineages identifies cdh17 as a prognostic marker in early stage gastric cancer[J]. Gastroenterology, 2010, 139(1): 213-225. DOI: 10.1053/j.gastro.2010.04.008. |
| [29] | Ge J, Chen Z, Wu S, et al. A clinicopathological study on the expression of cadherin-17 and caudal-related homeobox transcription factor (cdx2) in human gastric carcinoma[J]. Clin Oncol (R Coll Radiol), 2008, 20(4): 275-283. DOI: 10.1016/j.clon.2008.01.013. |
| [30] |
奚海林, 李睿, 牛建华, 等. 肝肠-钙黏连蛋白过表达对胃癌细胞BGC-823增殖、侵袭及迁移能力的影响[J].
肿瘤, 2012, 32(11): 880-885.
Xi HL, Li R, Niu JH, et al. Effects of over-expression of liver-intestine cadherin on proliferation, invasion and migration of human gastric carcinoma BGC-823 cells[J]. Tumor, 2012, 32(11): 880-885. DOI: 10.3781/j.issn.1000-7431.2012.11.005. |
| [31] | Xu Y, Zhang J, Liu QS, et al. Knockdown of liver-intestine cadherin decreases BGC823 cell invasiveness and metastasis in vivo[J]. World J Gastroentero, 2012, 18(24): 3129-3137. |
| [32] | Wang J, Kang WM, Yu JC, et al. Cadherin-17 induces tumorigenesis and lymphatic metastasis in gastric cancer through activation of NF kappa B signaling pathway[J]. Cancer Biol Ther, 2013, 14(3): 262-270. DOI: 10.4161/cbt.23299. |
| [33] | Liu QS, Zhang J, Liu M, et al. Lentiviral-mediated mirna against liver-intestine cadherin suppresses tumor growth and invasiveness of human gastric cancer[J]. Cancer Sci, 2010, 101(8): 1807-1812. DOI: 10.1111/cas.2010.101.issue-8. |
| [34] | Qiu HB, Zhang LY, Ren C, et al. Targeting cdh17 suppresses tumor progression in gastric cancer by downregulating wnt/beta-catenin signaling[J]. PLoS One, 2013, 8(3): e56959. DOI: 10.1371/journal.pone.0056959. |
 2017, Vol. 38
2017, Vol. 38

