男性生殖力正不断减退,精子的质量和数量呈现逐年下滑的趋势[1]。诸多因素影响着生精功能,其中肥胖被认为是其中重要因素之一[2]。研究证实,精子质量与体重指数(body mass index, BMI)存在密切相关性,BMI越大,精子质量越差[2]。肥胖可引起糖尿病等代谢性疾病,其中胰岛素抵抗(insulin resistance, IR)被认为是核心环节[3]。在肥胖男性中,低水平的睾酮与IR程度密切相关[4]。二甲双胍(metformin, Met)主要通过增强组织对胰岛素的敏感性而改善IR,此外还有减轻体重、降低代谢综合征的发病率的作用[5]。基于以上研究,本实验以高脂饮食所致肥胖大鼠为模型,观察Met在改善代谢的同时是否对睾丸生精功能和精子质量产生影响。
1 材料与方法 1.1 实验动物及分组24只8周龄的性发育成熟雄性Wistar大鼠按随机数字表法分为3组,标准饮食组(对照组,control group)、高脂饮食组(high fat diet,HFD组)及高脂饮食+二甲双胍组(Metfromin group,Met组),每组8只, 剔除实验过程中因灌胃死亡的大鼠。大鼠在动物实验中心饲养,SPF级, 对照组每日采用标准饲料喂养, HFD组每日供应充足的高脂饲料, Met组在高脂饲料的基础上每日给予20 mg/kg的Met灌胃,其他组采用等体积的生理盐水。每周一早晨8点记录一次大鼠的体重。8周时,空腹12 h后,实验动物经腹腔麻醉后处死。本课题的内容经所在单位动物实验伦理委员会批准。
1.2 血清糖脂代谢、性激素和炎症因子的测定通过内眦静脉采血。血液样本在室温下放置1 h后离心(300 g×15 min),将收集到的血清置于-70 ℃冰箱保存。空腹血糖测定运用葡萄糖氧化酶法。血清胰岛素、瘦素、促性腺激素(FSH、LH)、睾酮(T)、雌二醇(E2)及炎症因子(TNF-α、IL-6)测定通过ELISA。IR程度通过HOMA-IR来反映,其计算公式为[空腹胰岛素(mU/L)]×[空腹血糖(mmol/L)]/22.5[6]。
1.3 附睾精子参数分析将附睾和输精管用眼科剪尽可能剪碎成长度约2 mm的片段,置入盛有Hepes缓冲液的培养皿中并用眼科镊反复挤压组织,使精子游离于液体中。液体收集至EP管中,随后转移到培养箱中孵育10 min。用加样器吸取精液标本加入血球计数板的计数室内(每侧15 μl),计算精子的密度。每只大鼠分析3次精液样本,取平均值。精子活动力的检测采用计算机辅助的精子分析系统及配套软件。按常规方法在光学显微镜下观察精子形态。
1.4 睾丸组织学观察每组随机选取3只大鼠的一侧睾丸在称重后固定,石蜡包埋,切片(厚度3-4 μm),进行HE染色后观察曲细精管的排列、直径及生精细胞数量。每只睾丸选取两个切片,在切片中随机选择5个视野(400倍)观察。
1.5 睾丸组织内睾酮及炎性因子的测定组织样品准备:预冷的PBS冲洗组织后剪碎,使用匀浆器按质量体积比1:9匀浆,制备成10%的组织匀浆液,5 000 g离心10 min,收集上清通过ELISA法测定睾酮和炎症因子。
1.6 统计学分析所有定量数据均表示为(均数±标准差)。采用SPSS 19.0软件进行统计学分析。组间的比较采用单因素方差分析(One-way ANOVA),两两比较采用Tukey检验,以P<0.05判断为有统计学差异。
2 结果 2.1 体重、糖脂代谢指标的测定饲养8周时,HFD组大鼠体重、体重增加值、空腹血糖、胰岛素和瘦素水平及HOMA-IR指数均显著高于对照组。在高脂饮食基础上给予Met干预后,上述指标与对照组相比虽有升高趋势,但无统计学差异(见表 1)。
| 表 1 大鼠体重、糖脂代谢及性激素水平的比较(x±s) |
HFD组与对照组和Met组相比,睾酮明显降低,E2显著升高。比较睾丸组织中睾酮的浓度,显示HFD组中睾酮的水平显著低于对照组和Met组,HFD组睾丸组织的睾酮平均水平约为对照组的50%。观察不同饲养时间点血清睾酮和E2的浓度变化,发现随着饲养时间的延长,血清睾酮的水平是逐渐下降的,而E2是逐渐上升的(图 1)。
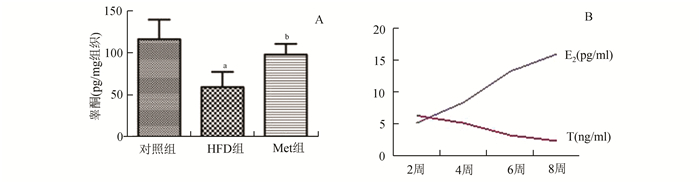
|
图 1 睾丸组织和血清性激素表达 A:睾丸组织睾酮水平; B:HFD组血清E2和T随饲养时间的变化规律与对照组相比,aP<0.05;与HFD组相比, bP<0.05 |
TNF-α、IL-6、IL-18的检测结果表明在血清和睾丸局部,HFD组的炎性因子浓度均显著高于对照组和Met组。在睾丸组织中,Met虽然可以显著降低这些炎症因子的水平,但是仍没有使其恢复到对照组的水平(图 2)。
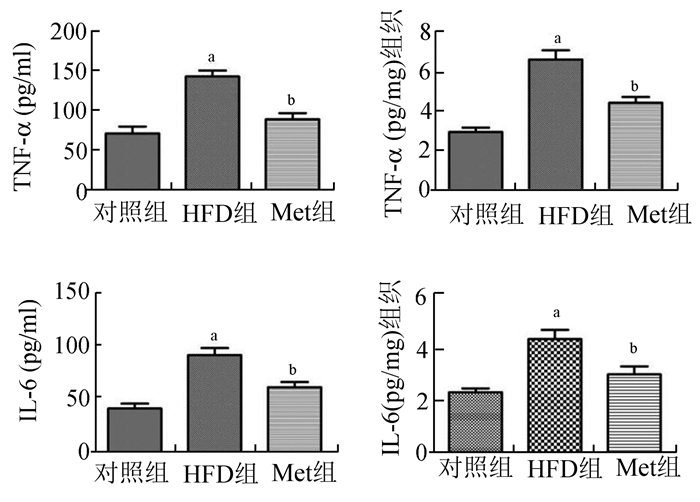
|
图 2 不同组别大鼠血清(左图)和睾丸组织(右图)炎症因子的表达水平 与对照组相比,aP<0.05;与HFD组相比, bP<0.05 |
睾丸重量和睾丸系数[睾丸重量(g)/体重(kg)]的比较反映出HFD组睾丸重量及其占体重的比例较对照组是明显下降的,Met组得到了一定程度的改善。HE染色(图 3)后观察睾丸的结构发现对照组的睾丸组织内分布着丰富的生精小管,基底膜完整,上皮规则排列着数层生精相关细胞。管腔内可见较多精细胞。HFD组的生精小管直径变小,形态不规则,基底膜欠完整。HFD组曲细精管直径和生精细胞数量显著低于对照组和Met组。精液分析,HFD组的精子密度、活动力和存活率是显著降低的,但畸形率是升高的(表 2)。
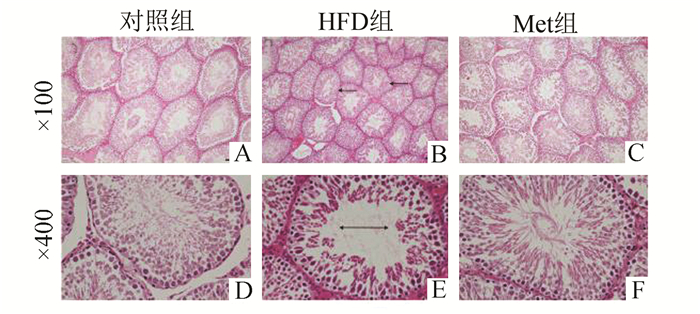
|
图 3 睾丸组织学观察(HE染色) 单箭头表示HFD组曲细精管直径变小,双箭头表示曲细精管内生精细胞数量减少 |
| 表 2 肥胖大鼠睾丸重量、组织学及附睾精子参数 |
肥胖与男性生育力下降的关系越来越受到关注。研究发现精液质量下降与血清低睾酮水平和体重指数相关,特别是与伴随肥胖的IR关系密切。由此我们想到减轻体重、纠正IR是否就可以改善精液质量。本实验在肥胖大鼠模型上,给予了Met干预,从精液分析参数、全身糖脂代谢、性激素、睾丸组织学、睾丸局部性激素和炎性反应等多个角度予以阐释肥胖对生精功能的影响,并探讨Met的保护效益。
3.1 肥胖及糖脂代谢代谢异常对生精功能的影响维持正常的性激素状态对于生精必不可少,特别是睾酮在生精过程中参与了关键步骤的调节。实验的结果显示HFD组血清睾酮和睾丸组织内睾酮水平显著低于对照组。另外,伴随着低睾酮出现的是E2的异常升高。这是因为肥胖会导致皮下和内脏大量白色脂肪组织的堆积,而这些脂肪组织可以增强芳香化酶的活性,促进睾酮转化为雌激素,导致雄/雌激素的比例失衡。其次,瘦素作用于下丘脑可以调控GnRh的释放,作用于Leydig细胞可以调控睾酮的生成。适当的瘦素对于精子的生成是有积极意义的。但伴随肥胖出现的脂代谢异常,即瘦素水平过度升高,会对Leydig细胞产生损害,引起雄激素分泌不足[7]。
肥胖者的白色脂肪可以产生大量的炎症因子(如TNF-α、IL-6)释放到血循环中。TNF-α可以促进基质金属蛋白酶9(MMP-9)的表达。高水平的TNF-α联合MMP-9,增强其蛋白水解作用,破坏曲细精管上皮的细胞外基质,损坏血睾屏障。另外,高水平的TNF-α还可以促进睾丸生精细胞的凋亡,减少精子生成,即降低精液中精子密度。IL-6和TNF-α还可以协同促进氧化过激,升高局部活性率(ROS)水平,降低精子受精能力。
从解剖上讲,正常的睾丸重量、体积及足够数量的生精细胞对于精子的产生是必需的。实验结果显示,肥胖大鼠的睾丸表面欠光滑,甚至有萎缩、皱褶的表现,睾丸重量和睾丸指数均显著低于对照组。HE染色后观察HFD组的生精小管直径变小,生精细胞数量减少。附睾精子参数分析也证实肥胖大鼠的精子密度、活力和正常形态率均下降。由此证明肥胖及其伴随的糖脂代谢异常会从多个层面破坏睾丸生精,引起精子质量下降。
3.2 二甲双胍对肥胖大鼠睾丸生精功能的改善Met除了改善IR、降血糖作用外,其减轻体重,改善糖脂代谢的功能越来越受到关注。其主要机制是Met可以降低食欲,减少营养摄入。脂肪是全身分布最广的内分泌组织,肥胖时白色脂肪组织大量蓄积导致瘦素的分泌增加。而Met可通过降低体重、减少体内脂肪的蓄积,来改善高瘦素状态。
调控瘦素水平,可减少对性腺轴的干扰,纠正性激素分泌的异常,实验结果表现为Met组的血清和睾丸组织内睾酮水平升高,E2水平下降。与此同时,减轻体重和减少白色脂肪组织在体内蓄积,从根本上减少炎性因子的生成和释放,故可不同程度地降低肥胖大鼠血清和睾丸组织中促炎因子的水平。在解剖和组织学上观察,Met干预后可提高睾丸重量、生精细胞的数量,精液分析结果表明精子密度、活力及正常形态率均较HFD组显著改善。
综上所述,Met可以从改善肥胖带来的糖脂代谢异常、性激素分泌紊乱、睾丸组织学破坏、机体及睾丸局部高炎症反应等多个层面提高肥胖大鼠睾丸生精功能,改善精子质量。这为Met用于治疗肥胖所致男性生育力下降提供基础理论依据,但具体的治疗指征、观察指标及疗效仍需后期大样本的临床观察。
| [1] | Cooper TG, Handelsman DJ. Falling sperm counts and global oestrogenic pollution: postscript[J]. Asian J Androl, 2013, 15(2): 208-211. DOI: 10.1038/aja.2013.17. |
| [2] | Bieniek JM, Kashanian JA, Deibert CM, et al. Influence of increasing body mass index on semen and reproductive hormonal parameters in a multi-institutional cohort of subfertile men[J]. Fertil Steril, 2016, 106(5): 1 070-1 075. DOI: 10.1016/j.fertnstert.2016.06.041. |
| [3] | Barth RJ. Insulin resistance, obesity and the metabolic syndrome[J]. S D Med, 2011: Spec No: 22-27. |
| [4] | Cunningham GR. Testosterone and metabolic syndrome[J]. Asian J Androl, 2015, 17(2): 192-196. DOI: 10.4103/1008-682X.148068. |
| [5] | Malin SK, Kashyap SR. Effects of metformin on weight loss: potential mechanisms[J]. Curr Opin Endocrinol Diabetes Obes, 2014, 21(5): 323-329. DOI: 10.1097/MED.0000000000000095. |
| [6] |
李阳雪, 郑爽, 韩亭亭, 等. 脂蛋白脂酶基因敲除小鼠糖脂代谢研究及其胰岛素抵抗的机制探索[J].
中华内分泌代谢杂志, 2015, 32(2): 143-147.
Li YX, Zheng S, Han TT, et al. Glucolipid metabolism of lipoprotein lipase heterozygous mice and the mechanism of insulin resistance[J]. Chinese Journal of Endocrinology and Metabolism, 2015, 32(2): 143-147. |
| [7] | Roumaud P, Martin LJ. Roles of leptin, adiponectin and resistin in the transcriptional regulation of steroidogenic genes contributing to decreased Leydig cells function in obesity[J]. Horm Mol Biol Clin Investig, 2015, 24(1): 25-45. |
 2018, Vol. 39
2018, Vol. 39


