离子通道是位于生物膜上的蛋白质孔道,在调节上皮的离子转运、液体运输、信号传导和肌肉收缩等生理过程中发挥重要的作用。宫腔微环境的稳态,如液体分泌、电解质和酸碱平衡,是保证哺乳动物生殖过程得以顺利进行的基本前提。近年的研究发现,一些离子通道在子宫内膜表达,并参与调节宫腔液体的分泌和着床过程中胚胎与子宫内膜之间的“对话”[1]。
钙激活氯离子通道(calcium-activated chloride channel,CaCCs)是一类受细胞内钙离子调节的氯离子通道,因其可参与许多生理过程而备受关注。2008年的一项研究首次发现CaCCs的分子基础为跨膜蛋白16A(transmembrane protein 16A,TMEM16A),也称作anoctamin 1(ANO1)[2]。TMEM16A广泛表达于多种上皮组织、平滑肌和感觉神经元等,参与调节上皮细胞的液体运输、腺体分泌、感觉神经传导、平滑肌的收缩及酸碱平衡等,并且在人胎盘组织、卵巢颗粒细胞、输卵管和附睾管平滑肌中均有表达,可能与卵泡发育、胚胎着床及妊娠的建立有关[3-6]。但是TMEM16A在子宫内膜中的表达及功能目前知之甚少。本研究通过免疫组织化学染色、实时荧光定量PCR和Western Blot检测了TMEM16A在增殖期和分泌期人子宫内膜中的表达情况,探讨TMEM16A和子宫内膜功能间的关系,从而进一步明确TMEM16A在生殖过程中的作用,为研究子宫内膜容受性、胚胎着床,以及防治着床失败提供一定的理论依据。
1 材料与方法 1.1 材料 1.1.1 试剂及溶液山羊抗人TMEM16A多克隆抗体(Santa Cruz,美国);链霉菌抗生物素蛋白-过氧化物酶连接法(SP法)试剂盒、二氨基联苯胺(DAB)显色剂(百奥斯生物,武汉);总RNA提取试剂、RNA逆转录试剂盒、荧光定量PCR检测试剂盒(Takara,日本);PCR引物(生工生物,上海);小鼠抗人GAPDH单克隆抗体(三箭生物,天津)。
1.1.2 研究对象收集2015年4月至2016年4月在武汉大学人民医院妇产科因子宫肌瘤行全子宫切除术,或因输卵管或男方因素行体外受精-胚胎移植(IVF-ET)患者的子宫内膜。要求患者年龄为25-45岁,且既往月经周期规律。排除的标准包括:任何可能存在的子宫内膜性疾病、基因或染色体异常、内分泌和代谢性疾病,以及3个月内口服避孕药或者任何可能影响月经周期的药物。根据月经周期时间分组如下:增殖早期(D5-D7)、增殖中期(D8-D10)、增殖晚期(D11-D14)、分泌早期(D15-D19)、分泌中期(D20-D24)及分泌晚期(D25-D28),每组各8例。部分内膜组织经4%多聚甲醛固定待行免疫组织化学染色;另一部分内膜组织经液氮速冻后保存于-80 ℃,待行实时荧光定量PCR和Western Blot检测。临床标本的收集经过武汉大学人民医院伦理委员会同意并签署知情同意书。
1.2 方法 1.2.1 免疫组织化学染色法检测4%多聚甲醛固定后的内膜组织经梯度乙醇脱水、二甲苯透明后浸蜡包埋,切片厚度5 μm。组织切片常规脱蜡至水,3%过氧化氢封闭内源性过氧化物酶后,用正常山羊血清阻断非特异性结合,加入一抗(山羊抗人TMEM16A多克隆抗体,1: 100稀释),4 ℃下孵育过夜。加入生物素标记的二抗,4 ℃下作用50 min。DAB显色,苏木素复染,乙醇脱水干燥后以二甲苯透明,中性树胶封片。以正常肝脏作为阳性对照,正常山羊血清代替一抗作为阴性对照。光学显微镜下观察,细胞内呈现棕黄色颗粒为阳性信号。
1.2.2 实时荧光定量PCR检测取出冻存组织在液氮中进行研磨,按照总RNA提取试剂说明抽提总RNA,RNA的含量及纯度通过紫外分光光度计测定。按照逆转录试剂盒说明合成cDNA,置于7500实时定量PCR仪(Applied Biosystems,美国)中进行PCR反应。TMEM16A及GAPDH引物序列如下:TMEM16A,上游引物5′-GGAAGCGGAAACAGATGCGACTCAACTA-3′,下游引物5′-TTTCTGGACTCTTTCTTCAGAGACTTCTCCAA-3′;GAPDH,上游引物5′-CCAGGGCTGCTTTTAACTCTGGTAAAGTGGATA -3′,下游引物5′-CATCGCCCCACTTGATTTTGGAGGGA-3′。Real-time PCR反应体系:1 μl cDNA逆转录产物,上下游引物各0.8 μl(10 μmol/L),设置3个复孔。反应参数:95 ℃预变性30 s,以95 ℃ 5 s,60 ℃ 34 s进行40个循环,每个循环末进行荧光检测,循环结束后测量熔解曲线。测定各样本TMEM16A和GAPDH的Ct值后,用2-△△Ct法分析mRNA相对表达量。
1.2.3 Western Blot检测冻存组织裂解后提取总蛋白,用BCA法测定蛋白浓度。每个样本取50 μg总蛋白,经10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离蛋白质后,湿式法电转至聚偏二氟乙烯(PVDF)膜。加入一抗(山羊抗人TMEM16A多克隆抗体,1: 500稀释;小鼠抗人GAPDH单克隆抗体,1: 1 000稀释)后,4 ℃孵育过夜。漂洗后,加入荧光标记的二抗,室温下孵育1 h,置于Odyssey近红外双色激光成像系统(LICOR,美国)中扫描并分析。
1.3 统计学分析应用SPSS 19.0软件进行统计学分析,计量资料以x±s表示,组间比较采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果 2.1 TMEM16A蛋白在人子宫内膜中的定位表达免疫组织化学染色结果显示TMEM16A蛋白在人子宫内膜增殖早、中、晚期偶有表达,分泌早期表达开始增多,分泌中、晚期表达最强。TMEM16A蛋白主要表达于子宫内膜腔上皮和腺上皮细胞,基质中表达较弱(图 1)。

|
图 1 TMEM16A蛋白在人子宫内膜中的定位表达(免疫组化×200) A:阳性对照,B:阴性对照,C:增殖早期,D:增殖中期,E:增殖晚期,F:分泌早期,G:分泌中期,H:分泌晚期;LE:腔上皮,GE:腺上皮,S:基质 |
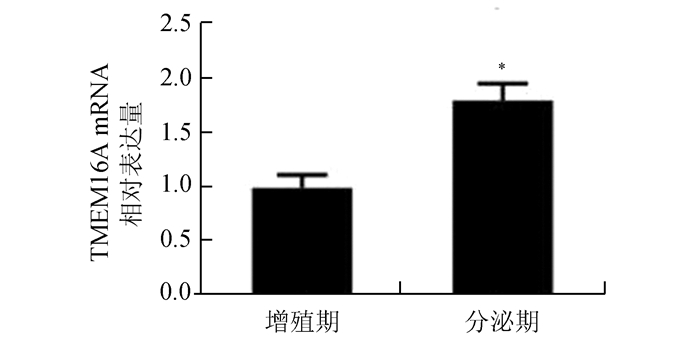
实时荧光定量PCR结果显示,在增殖期和分泌期的人子宫内膜中均有TMEM16A mRNA表达,且分泌期TMEM16A mRNA表达显著高于增殖期,分别为1.007±0.122和1.823±0.160,具有统计学差异(P<0.05)(图 2)。
|
图 2 TMEM16A mRNA在人子宫内膜中的表达情况 与增殖期相比,*P<0.05 |
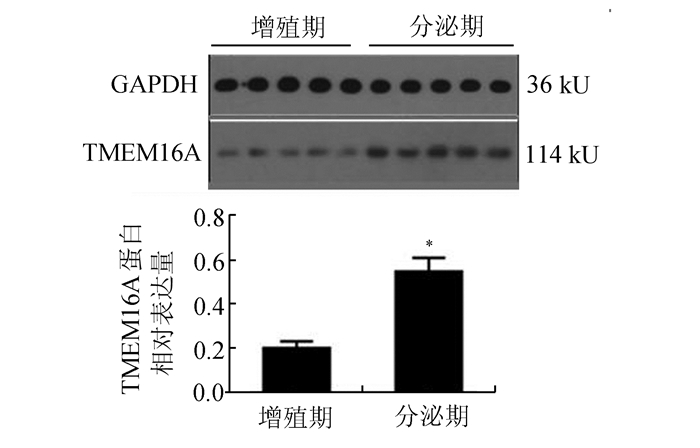
Western Blot结果显示,TMEM16A蛋白在人增殖期和分泌期子宫内膜中的相对表达水平分别为0.205±0.031和0.553±0.062,分泌期TMEM16A蛋白含量明显高于增殖期,差异具有统计学意义(P<0.05)(图 3)。
|
图 3 TMEM16A蛋白在人子宫内膜中的表达情况 与增殖期相比,*P<0.05 |
子宫内膜容受性的建立是在雌、孕激素及下游多种因子的共同作用下,不同类型的细胞之间通过旁分泌以及细胞间的信号传导相互影响,进而使子宫内膜具备接受胚胎植入的能力。但是由于伦理及技术的限制,子宫内膜容受性和/或胚胎着床的分子机制目前仍不完全清楚。
离子通道是由跨膜蛋白构建的孔道,可允许离子的通行,进而引发膜电位、离子浓度、pH值的变化,影响细胞内第二信使信号传导等,参与肌肉收缩、细胞体积调节、酸碱平衡、上皮的分泌和吸收等生理过程,并且与细胞的增殖、凋亡和侵袭行为有关。目前发现,子宫内膜或子宫内膜来源的细胞中存在超过14种离子通道,包括囊性纤维化跨膜电导调节因子、上皮钠离子通道和各类钙离子、钾离子通道。子宫内膜上皮层和基质层中的各类离子通道被认为与子宫内膜的容受性和胚胎着床密切相关[7, 8],相关机制可能为:参与调节子宫腔液体量、蜕膜化,以及着床相关基因的表达[9]。此外,研究证实离子通道表达和/或功能异常会损伤子宫内膜容受性,与着床失败有关[1]。
TMEM16A作为CaCCs的分子基础,既往研究在多种上皮组织、平滑肌和感觉神经元均检测到了TMEM16A的表达,其参与调节上皮细胞的液体运输、腺体分泌、感觉神经传导、平滑肌的收缩及酸碱平衡等。然而,TMEM16A在女性生殖系统的表达和功能目前知之甚少。报道指出,在输卵管和附睾管平滑肌中均有TMEM16A表达[3, 4]。既往的一项研究发现,TMEM16A作为印迹基因表达于人早期和足月妊娠的胎盘,这提示其可能在妊娠过程中具有重要作用[5]。
本研究检测了TMEM16A是否表达于人子宫内膜,及其在正常月经周期不同时期的表达变化。我们的免疫组织化学染色结果发现TMEM16A主要表达于分泌中晚期子宫内膜腔上皮和腺上皮细胞中,增殖期和分泌早期上皮未检出或偶有TMEM16A表达。上皮细胞中表达的TMEM16A可能与子宫内膜的功能有关。实时荧光定量PCR和Western Blot结果进一步证实了我们的猜测:与增殖期相比,分泌期子宫内膜TMEM16A mRNA和蛋白表达水平均显著增高。子宫内膜是一种特殊的组织,仅在有限的时期允许胚胎着床,这个时期子宫内膜容受性最高,为“种植窗口期”,在人类通常为正常月经周期的第20-24天,此时的子宫内膜即处于分泌中期。因此,分泌中期开始高表达的TMEM16A很可能与子宫内膜的容受性有关。既往研究发现TMEM16A与细胞黏附、增殖、分化等活动紧密相关。TMEM16A可通过激活丝裂原激活的蛋白激酶(MAPK)信号通路促进肿瘤发生和转移,还可诱导表皮生长因子受体(EGFR)的表达,从而激活蛋白激酶(AKT)和MAPK信号通路,参与肿瘤的发生发展[10]。我们推测,子宫内膜中的TMEM16A同样可通过调控细胞信号传导及相关因子的表达参与子宫内膜容受性的建立,进而影响胚胎着床。
卵巢激素在子宫内膜容受性建立过程中发挥关键作用。最近的研究表明,雌激素可上调三叉神经初级神经元TMEM16A的表达[11];动物实验结果显示,TMEM16A表达于小鼠卵巢颗粒细胞的质膜上,并与雌激素的合成有关,参与卵泡发育和排卵[6]。子宫内膜TMEM16A在月经周期的表达变化可能也受到卵巢雌孕激素的调控作用。此外,卵巢激素还与子宫腔内的液体量有关。子宫腔内包含以电解质和水为主要内容物的液体,其体积在整个月经周期受到卵巢激素的作用,宫腔液体量的减少被认为可限制胚胎的活动,而有利于胚胎的定位和黏附。研究表明,离子通道通过调节相关离子的转运,影响子宫内膜上皮细胞对水分的吸收或分泌,其功能或表达缺陷即会导致液体转运失衡,进而引发着床失败[12]。因此,卵巢激素可能通过调节TMEM16A的表达,改变子宫腔内的液体量,影响胚胎的活动。
综上所述,TMEM16A在人子宫内膜中的表达随着月经周期而发生变化,增殖期和分泌期的差异性表达提示其可能受卵巢雌孕激素的调节,参与子宫内膜容受性的建立,相关机制仍需进一步探讨。
| [1] | De CK, Van dEC, Hennes A, et al. The functional expression of transient receptor potential channels in the mouse endometrium[J]. Hum Reprod, 2017, 32(3): 615-630. |
| [2] | Schroeder BC, Cheng T, Jan YN, et al. Expression cloning of TMEM16A as a calcium-activated chloride channel subunit[J]. Cell, 2008, 134(6): 1 019-1 029. DOI: 10.1016/j.cell.2008.09.003. |
| [3] | Dixon RE, Hennig GW, Baker SA, et al. Electrical slow waves in the mouse oviduct are dependent upon a calcium activated chloride conductance encoded by Tmem16a[J]. Biol Reprod, 2012, 86(1): 1-7. |
| [4] | Gao DY, Zhang BL, Leung MC, et al. Coupling of TRPV6 and TMEM16A in epithelial principal cells of the rat epididymis[J]. J Gen Physiol, 2016, 148(2): 161-182. DOI: 10.1085/jgp.201611626. |
| [5] | Okae H, Hiura H, Nishida Y, et al. Re-investigation and RNA sequencing-based identification of genes with placenta-specific imprinted expression[J]. Hum Mol Genet, 2012, 21(3): 548-558. DOI: 10.1093/hmg/ddr488. |
| [6] | Sun M, Sui Y, Li L, et al. Anoctamin 1 calcium-activated chloride channel downregulates estrogen production in mouse ovarian granulosa cells[J]. Endocrinology, 2014, 155(8): 2 787-2 796. DOI: 10.1210/en.2013-2155. |
| [7] | De CK, Held K, Van BR, et al. Functional expression of transient receptor potential channels in human endometrial stromal cells during the luteal phase of the menstrual cycle[J]. Hum Reprod, 2015, 30(6): 1 421-1 436. DOI: 10.1093/humrep/dev068. |
| [8] | Schmidt S, Schneider S, Yang W, et al. TGFβ1 and SGK1-sensitive store-operated Ca2+ entry and Orai1 expression in endometrial Ishikawa cells[J]. Mol Hum Reprod, 2014, 20(2): 139-147. DOI: 10.1093/molehr/gat066. |
| [9] | Ruan YC, Chen H, Chan HC. Ion channels in the endometrium: regulation of endometrial receptivity and embryo implantation[J]. Hum Reprod Update, 2014, 20(4): 517-529. DOI: 10.1093/humupd/dmu006. |
| [10] | Han Y, Shewan AM, Thorn P. HCO3- transport through anoctamin / transmembrane protein ANO1 / TMEM16A in pancreatic acinar cells regulates luminal pH[J]. J Biol Chem, 2016, 291(39): 20 345-20 352. DOI: 10.1074/jbc.M116.750224. |
| [11] | Yamagata K, Sugimura M, Yoshida M, et al. Estrogens exacerbate nociceptive pain via up-regulation of TRPV1 and ANO1 in trigeminal primary neurons of female rats[J]. Endocrinology, 2016, 157(11): 4 309-4 317. DOI: 10.1210/en.2016-1218. |
| [12] | Shahzad H, Giribabu N, Karim K, et al. Combinatorial effects of quercetin and sex-steroids on fluid and electrolytes (Na+, Cl-, HCO3-) secretory mechanisms in the uterus of ovariectomised female Sprague-Dawley rats[J]. PLoS One, 2017, 12(3): e0172 765. DOI: 10.1371/journal.pone.0172765. |
 2018, Vol. 39
2018, Vol. 39


