2. 中山大学附属第六医院消化内科 广东 广州 510000;
3. 中山市人民医院 广东 中山 528400
2. Dept. of Gastroenterology, Sixth Affiliated Hospital of Sun Yat-sen University, Guangzhou 510000, China;
3. Zhongshan City People 's Hospital, Zhongshan 528400, Guangdong, China
炎症性肠病(inflammatory bowel disease, IBD)主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD),是一种肠道慢性炎症性疾病,病情反复,治疗困难,发病率呈上升趋势[1]。IBD的病因和发病机制尚不明确,认为与饮食、免疫、环境等相关[2-4]。近年来,肠道微生态在IBD发病机制中的作用受到重视。
大量的研究发现IBD患者存在肠道微生态异常,表现为肠道菌群多样性减少,厚壁菌门(Firmicute)以及其中对人体有益的菌群,如球形梭菌(C.coccoides)、柔嫩梭菌(C.leptum)和普拉梭菌(F.prausnitzii)等的数量减少;条件致病菌变形菌门(Proteobacteria)的细菌增多[5-7]。
尽管针对IBD患者肠道微生态的研究较多,但是比较活动期与缓解期IBD患者肠道菌群的研究较少,而且一些结论相互矛盾[8]。缓解期IBD患者肠道主要菌群的组成是否与活动期相同?疾病缓解后这些主要菌群能否恢复到健康状态?回答这些问题对理解肠道菌群在IBD发病中的作用具有重要意义。
本实验选取C.leptum亚群、C.coccoides亚群以及C.leptum亚群中具有代表性的F.prausnitzii,拟杆菌属(Bacteroides)中普通拟杆菌(B.vulgatus),普氏菌属(Prevotella),活泼瘤胃球菌(R.gnavus)及肠杆菌科(Enterobacteriaceae)中具有代表性的大肠杆菌(E.coli)这些目前被报道在肠道发挥重要作用的菌群或菌种,采用相对准确的实时定量PCR研究活动期与缓解期IBD患者粪便主要菌群的组成。
1 材料与方法 1.1 纳入对象此项研究经武汉大学中南医院伦理委员会批准,纳入的研究对象均签署知情同意。IBD的诊断采取2013年中华医学会消化病学分会炎症性肠病协作组制订的诊断标准[9]。UC的活动性采用Sutherland评分,溃疡性结肠炎活动指数 > 2为活动性UC(AUC),反之为缓解期UC(RUC);CD的活动性采用克罗恩病活动指数(Crohn’s disease activity index, CDA),评分 > 150为活动性CD(ACD),反之为缓解期CD(RCD)。仅仅为肛管CD、有短肠综合征、孕妇、目前有肠道感染、2个月内服用抗生素、益生菌类药物或酸奶的IBD患者被排除。我们也募集了3个月内无抗生素、益生菌或酸奶服用史,无消化道症状的健康人群作为对照(healthy controls, HC)。
1.2 方法 1.2.1 粪便标本收集及DNA提取收集研究对象粪便标本。标本收集时机:武汉大学中南医院住院诊断为IBD的病人,通过血常规、血清学等相关检查等排除肠道感染,在做肠镜灌肠前留取患者粪便。嘱其将粪便标本直接排入无菌培养皿中,封口膜密封,放入冰盒,立即转移至-80 ℃冰箱保存留。DNA提取使用QIAamp DNA粪便提取试剂盒,具体方法如下:挑取200 mg粪便,加入含有300 mg 0.1 mm硅珠的硬壁管中,置于冰上,加入1.5 ml ASL缓冲溶液涡旋,然后将硬壁管置入Fastprep-24核酸提取仪中,全速离心45 s 2次,95 ℃恒温水浴箱中水浴5 min。DNA提取方法依照QIAamp DNA试剂说明。提取的DNA置入-80 ℃冰箱保存备用。
1.2.2 实时定量PCR实时定量PCR采用iCycler real-time PCR仪(Bio-Rad, USA),方法如下:首先建立标准曲线,普通PCR扩增粪便主要菌群16S rDNA,验证引物的有效性及特异性;实时定量PCR反应体系为20 μl,含模板DNA 2 μl,SYBR-Green PCR 2×master mix 12.5 μl,ROX 0.4 μl,上游引物0.4 μl,下游引物0.4 μl,超纯水6.8 μl。95 ℃预变性10 min后,95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,40个循环;PCR反应终止后生成熔解曲线,从退火温度起至95 ℃,0.5 ℃/s,验证引物的特异性及目的片段,每组实验重复3次。根据标准曲线计算出总菌及各类菌群的拷贝数,然后计算各类菌群占总菌的百分比进行比较。目的引物由上海生物工程公司合成,引物序列见表 1。
| 表 1 实验使用引物特点 |
所有数据采用SPSS 17.0进行分析;在进行统计分析前,检验每组数据是否符合正态分布,根据数据分布情况采用单因素方差分析或Mann-Whitney检验对数据进行分析,对符合正态分布的数据,在进行统计分析时验证方差齐性。P<0.05表示差异有统计学意义。
2 结果 2.1 研究对象临床特征根据以上的纳入、排除标准,我们纳入了29例正常对照,60例AUC和20例RUC患者以及41例ACD和53例RCD患者。纳入对象的基本特征详见表 2。
| 表 2 粪便标本病人临床特点 |
健康对照、活动期UC、缓解期UC、活动期CD与缓解期CD的总菌数量见表 3。5组间的总菌数量比较见图 1。研究发现,5组间的粪便总菌数量差异无显著性。
| 表 3 粪便中主要细菌与总菌比率(x±s,%) |
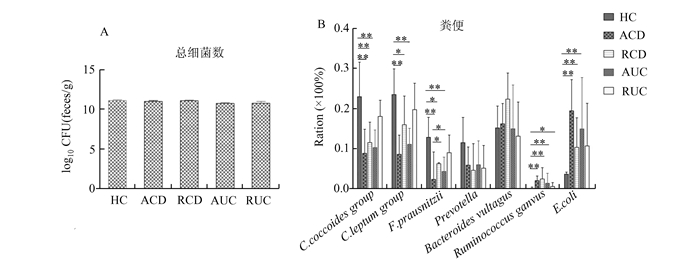
|
图 1 不同组间粪便总菌数及细菌亚群数量比较 A:各组之间总菌数差异无统计学意义;B:粪便主要菌群比较*P<0.05;**P<0.01 |
活动期CD、缓解期CD和活动期UC患者粪便中C. coccoides数量明显减少(HC vs ACD,P<0.01;HC vs RCD,P<0.05;HC vs AUC,P<0.01);缓解期UC患者粪便中C.coccoides的数量与HC组差异有统计学意义。厚壁菌门的另一个主要菌群C.leptum占HC组粪便总菌的23%,在ACD、RCD、AUC患者粪便中均明显减少(HC vs ACD,P<0.01;HC vs RCD,P<0.05;HC vs AUC,P<0.01),RUC患者粪便中有减少趋势。F.prausnitzii在ACD、RCD、AUC组明显减少(HC vs ACD,P<0.001;HC vs RCD,P<0.05;HC vs AUC,P<0.01),RUC组有减少趋势。
Prevotella及拟杆菌属中的B.vultagus为拟杆菌门中的主要细菌,在IBD患者粪便中与正常对照比较无统计学差异。具有黏液降解功能的瘤胃球菌属R.ganvus在ACD、RCD、AUC及RUC粪便中显著增多(HC vs ACD,P<0.01;HC vs RCD,P<0.01;HC vs AUC,P<0.01;HC vs RUC,P<0.05)。
条件致病菌E.coli在ACD、RCD和AUC组显著增多(HC vs ACD,P<0.01;HC vs RCD,P<0.05;HC vs AUC,P<0.01;HC vs RUC,P<0.05)。
2.4 活动期IBD与缓解期IBD各菌群数量我们也比较了活动期IBD与缓解期IBD各类菌群的数量变化。活动与缓解期UC相比,各组菌群的数量相似,差异无统计学意义。对CD而言,仅有F.Prausnitzii在ACD组显著减少,差异有统计学意义(ACD vs RCD,P<0.05),其它各类菌群数量相似。
3 讨论大量研究证实IBD患者粪便菌群的组成存在异常。早期采用荧光原位杂交(fluorescence in situ hybridization, FISH)、Q-PCR和PCR-变性梯度电泳凝胶(PCR-Denaturing Gradient Gel Electrophoresis,PCR-DEEG)等研究发现IBD患者E.coli、拟杆菌属和厌氧菌(anaerobes)增多,双歧杆菌(Bifidobacteria)、C.coccoides、Firmicutes多样性以及F.prausnitzii减少。采用454测序技术,研究也得出类似结果[14]。
采用Q-PCR,我们前期的研究发现F.prausnitzii在活动期UC和CD的粪便中减少,E.coli增加[5]。因为缓解期样本例数较少,未充分研究缓解期IBD患者粪便主要菌群的变化。该研究扩大样本,纳入的受试IBD个体在样本采集前,排除合并肠道感染,且2个月以内均未有接受过结肠清洗检查,3月内未服用抗生素及益生菌类药物,进一步比较IBD患者与正常对照组粪便主要菌群以及不同疾病状态粪便主要菌群的差异。我们的研究发现,活动期IBD患者和缓解期IBD患者粪便总细菌数量与健康对照比较无显著差异。这与Sokol等人[13]的研究结果部分相同,他们发现活动期CD及UC患者粪便的总细菌数量和健康对照无显著差异,但活动期IBD与缓解期的总菌数量存在差异。
在IBD患者粪便中以厚壁菌门中梭菌属C.coccoides和C.leptum及C.leptum中的主要代表细菌F.prausnitzii明显减少。C.leptum群和C.coccoides细菌是厚壁菌门中的主要菌群,包含多种产丁酸盐及异丁酸盐细菌,丁酸盐是结肠上皮细胞的主要能源物质,具有介导免疫调节和抗炎的特性[15]。产丁酸盐细菌在维持肠黏膜上皮的完整性方面具有重要作用,产丁酸盐细菌数量的减少或许在IBD的发病中具有不可或缺的作用。
研究发现在人分泌物中得到的细菌主要可以分为三型,它们分别是普氏菌属、拟杆菌属及瘤胃球菌,主要参与肠道营养物质的代谢,与各营养物质的分解相关。普通拟杆菌及瘤胃球菌属于黏液溶解性细菌。本实验中IBD患者粪便中B.Vulgatus及Prevotella含量与健康对照相比差异无明显差异,提示它们在IBD发病或肠炎的维持中不起主要作用。
E.coli是属于肠杆菌科重要细菌,在人肠道内占用重要地位,属于肠道共生菌,在正常状况下E.coli并不致病,几乎所有关于IBD患者肠道微生态的研究均发现Enterobacteriaceae中的E.coli在IBD患者中显著增加,特别是在CD肠黏膜中[16]。本实验中发现大肠杆菌在IBD病人粪便中明显高于HC,且活动期IBD增加更为明显,与我们的前期研究一致[5, 13],提示E.coli可能参与IBD的发生及维持。
本实验的另一个目的是比较活动期与缓解期IBD患者之间粪便主要菌群的差异,结果发现,除了F.prausnitzii在缓解期CD患者的粪便中显著高于活动期CD外,其它研究的主要菌群在活动期与缓解期IBD患者的粪便中均无显著差异。这提示这些主要菌群的数量与IBD的疾病状态无关,其原因值得进一步研究。
总之,我们的研究发现IBD患者粪便主要菌群和健康对照不同;除F.prausnitzii外,活动期与缓解期IBD粪便主要菌群组成无差异;益生菌C.coccoides、C. leptum和F.prausnitzii的减少以及条件致病菌E.coli的增加,提示它们可能参与IBD的发病及肠炎的维持。本研究未对IBD病人肠道细菌的种类和多样性进行研究,后期我们将对肠道菌群种类和多样性与IBD的发病发展进行相关研究。
| [1] | Shivashankar R, Tremaine WJ, Harmsen WS, et al. Incidence and prevalence of crohn's disease and ulcerative colitis in olmsted county, minnesota from 1970 through 2010[J]. Clin Gastroenterol Hepatol, 2016, S1542-3565(16): 31 055-31 052. |
| [2] | Buttó LF, Haller D. Dysbiosis in intestinal inflammation: Cause or consequence[J]. Int J Med Microbiol, 2016, 306(5): 302-309. DOI: 10.1016/j.ijmm.2016.02.010. |
| [3] | Park JH, Peyrin-Biroulet L, Eisenhut M, et al. IBD immunopathogenesis: A comprehensive review of inflammatory molecules[J]. Autoimmun Rev, 2017 Feb 14, pii: S1568-9972(17): 30053-8. |
| [4] | Dolan KT, Chang EB. Diet, gut microbes, and the pathogenesis of inflammatory bowel diseases[J]. Mol Nutr Food Res, 2017, 61(1): 1600129. DOI: 10.1002/mnfr.v61.1. |
| [5] | Wang W, Chen L, Zhou R, et al. Increased proportions of Bifidobacterium and the Lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease[J]. J Clin Microbiol, 2014, 52(2): 398-406. DOI: 10.1128/JCM.01500-13. |
| [6] | Vrakas S, Mountzouris KC, Michalopoulos G, et al. Intestinal bacteria composition and translocation of bacteria in inflammatory bowel disease[J]. PLoS One, 2017, 12(1): e0170034. DOI: 10.1371/journal.pone.0170034. |
| [7] | Kostic AD, Xavier RJ, Gevers D. The microbiome in inflammatory bowel diseases: current status and the future ahead[J]. Gastroenterology, 2014, 146(6): 1 489-1 499. DOI: 10.1053/j.gastro.2014.02.009. |
| [8] | De Cruz P, Prideaux L, Wagner J, et al. characterization of the gastrointestinal microbiota in health and inflammatory bowel disease[J]. Inflamm Bowel Dis, 2012, 18: 372-390. DOI: 10.1002/ibd.21751. |
| [9] |
中华医学会消化病学分会炎症性肠病学组. 我国炎症性肠病诊断与治疗的共识意见(2012年广州)[J].
内科理论与实践, 2013, 8: 61-75.
Chinese Society of Gastroenterology Committee of Inflammatory Bowel Disease. Opinions on the diagnosis and treatment of inflammatory bowel disease in China (Guangzhou, 2012)[J]. J Intern Med Concepts Pract, 2013, 8: 61-75. |
| [10] | Fraher MH, O'Toole PW, Quigley EM. Techniques used to characterize the gut microbiota: a guide for the clinician[J]. Nat Rev Gastroenterol Hepatol, 2012, 9(6): 312-322. DOI: 10.1038/nrgastro.2012.44. |
| [11] | Gevers D, Kugathasan S, Denson LA, et al. The treatment-naive microbiome in new-onset Crohn's disease[J]. Cell Host Microbe, 2014, 15(3): 382-392. DOI: 10.1016/j.chom.2014.02.005. |
| [12] | Robinson AM, Gondalia SV, Karpe AV, et al. Fecal Microbiota and Metabolome in a Mouse Model of Spontaneous Chronic Colitis: Relevance to Human Inflammatory Bowel Disease[J]. Inflamm Bowel Dis, 2016, 22(12): 2 767-2 787. DOI: 10.1097/MIB.0000000000000970. |
| [13] | Sokol H, Seksik P, Furet JP, et al. Low counts of Faecalibacterium prausnitzii in colitis microbiota[J]. Inflamm Bowel Dis, 2009, 15(8): 1 183-1 189. DOI: 10.1002/ibd.20903. |
| [14] | Chen L, Wang W, Zhou R, et al. Characteristics of fecal and mucosa-associated microbiota in Chinese patients with inflammatory bowel disease[J]. Medicine (Baltimore), 2014, 93(8): e51. DOI: 10.1097/MD.0000000000000051. |
| [15] | Harris HC, Edwards CA, Morrison DJ. Impact of glycosidic bond configuration on short chain fatty acid production from model fermentable carbohydrates by the Human Gut Microbiota[J]. Nutrients, 2017, 9(1): pii: E26. DOI: 10.3390/nu9010026. |
| [16] | Loh G, Blaut M. Role of commensal gut bacteria in inflammatory bowel diseases[J]. Gut Microbes, 2012, 3(6): 544-555. DOI: 10.4161/gmic.22156. |
 2017, Vol. 38
2017, Vol. 38

