2. 麦克马斯特大学健康科学学院医学系 加拿大 安大略 汉密尔顿 L8S4L8
2. Farncombe Family Digestive Health Research Institute, Dept. of Medicine, McMaster University, Hamilton, L8S4L8, Ontario, Canada
比沙可啶(Bisacodyl) 是一种接触性泻药,临床上主要用于急、慢性便秘的治疗。值得关注的是,大多数顽固型便秘患者在其他泻剂失效的情况下,仍对比沙可啶产生不同程度的反应,因此被作为此类患者的长期大剂量维持治疗药物。目前已知比沙可啶可直接作用于结肠黏膜,刺激其感觉神经末梢,产生副交感反射,引起反射性蠕动增强。且结肠测压显示,比沙可啶可促进儿童便秘患者结肠高振幅推进性收缩[1, 2]。但比沙可啶对结肠运动模式的影响及作用机制尚不是很清楚。另外,临床发现患者长期口服高剂量比沙可啶片极易引发恶心呕吐反应,耐受性差且影响上消化道功能,但部分患者经直肠给比沙可啶栓剂仍有不同程度刺激排便作用。因此,结合给药途径探讨比沙可啶对结肠运动模式的影响具有临床指导意义。本文拟研究体外比沙可啶经头端和远端结肠给药对全结肠运动模式的影响。
1 资料与方法 1.1 主要对象健康雄性Sprague Dawley大鼠19只,体重(180-300 g), 由武汉大学实验动物中心提供,动物统一常规饲养,按实验方案随机分为2组,比沙可啶组(实验组)11只和生理盐水组(对照组)8只。比沙可啶溶液由比沙可啶粉剂2 mg加入2 ml生理盐水中配置而成,并经超声波振荡器制成混悬液。该实验经武汉大学人民医院伦理委员会批准。
1.2 主要试剂比沙可啶粉剂购自美国Selleck公司,配置生理盐水、PBS及Krebs液所用的试剂均来自上海国药集团化学试剂有限公司。
1.3 方法 1.3.1 离体全结肠恒温浴槽试验健康大鼠禁食12 h后处死,分离全结肠,两端分别连接液体灌注管和流出管,置于含37 ℃固定通气(95%O2和5%CO2) 的Krebs液的恒温浴槽中。流出管液面距浴槽底部5 cm, 调整液面高度使结肠腔内压达最佳运动状态。
1.3.2 结肠基本运动模式和时空图结肠基本运动模式以改良时空图(加拿大Farncombe Family Digestive Health Research Institute提供) 形式呈现。浴槽正上方设置摄像头,以录像方式记录全结肠运动,结肠长径(Y轴) 上各点直径随时间(X轴) 的变化编码成不同灰度的影像[3](图 1,图 2):图像越白则结肠内径越大,越黑则内径越小,即黑白色分别代表收缩和舒张趋势。大鼠离体结肠基本运动模式包括长距离收缩(long distance contractons, LDCs)、节律性推进性运动复合波(rhythmic propulsive motor complexes, RPMCs)、头端收缩(proximal contractions)、微小波(ripples) 以及分节运动(segmentations)。前三者为推进性运动,后两者为非推进性运动。结肠运动参数分析包括频率(次/min)、相对振幅(经时空图Dynaic Profile插件分析)、传播长度(cm) 及传播时间(s)。

|
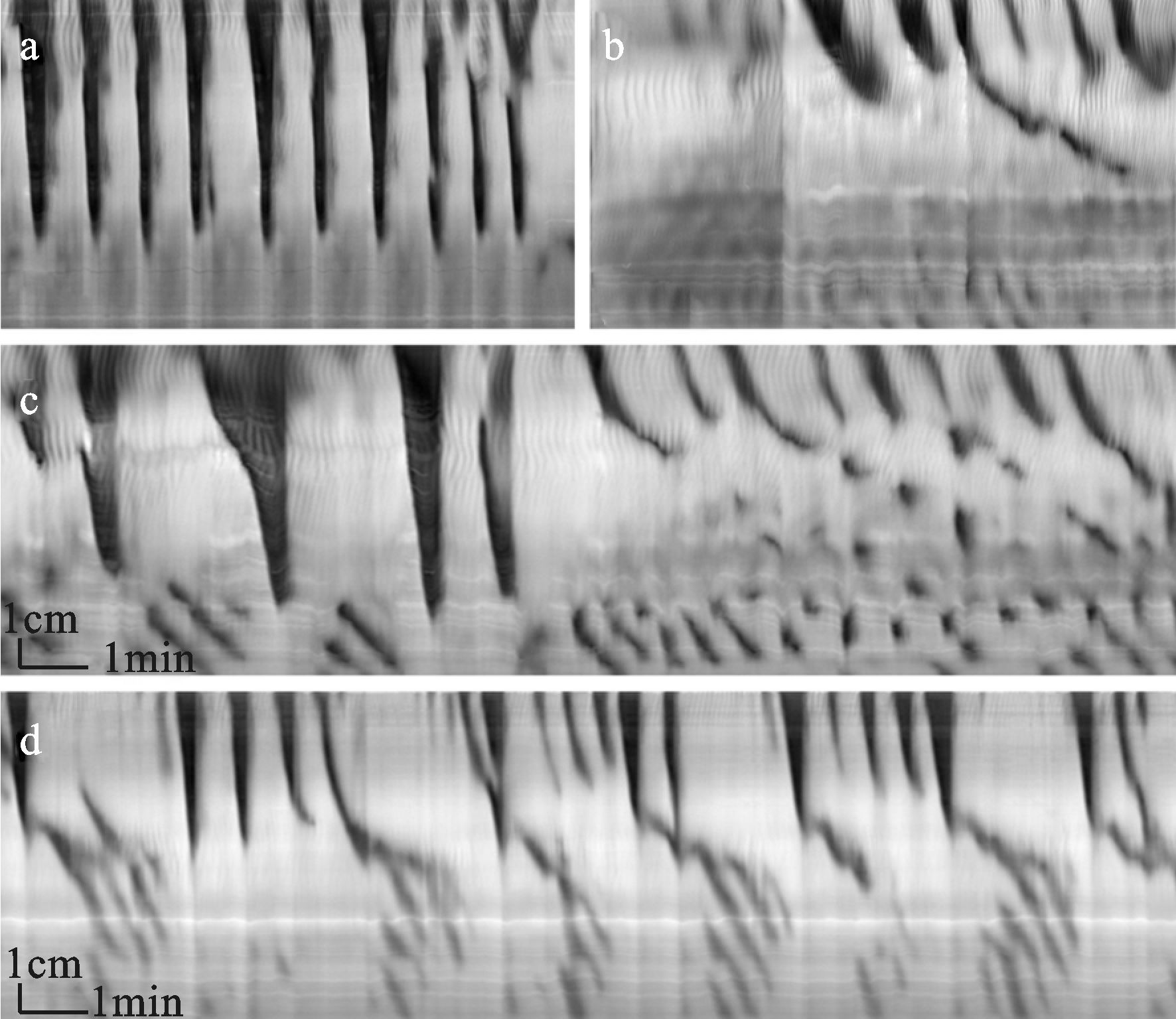
图 1 比沙可啶近端灌注给药引发结肠簇集性LDCs a.基础状态下稳定的节律性LDCs;b.比沙可啶近端灌注给药后引发的二个典型簇集性LDCs (见白色椭圆形标记) |
|
图 2 比沙可啶远端灌注给药诱发LDCs a.基础状态LDCs;b.Krebs液及PBS液洗脱后结肠运动模式,主要为头端收缩运动;c.结肠远端灌注比沙可啶后10 min复现规律性独立的LDCs;d.远端灌注比沙可啶后出现具有簇集倾向的LDCs伴随远端结肠RPMCs形成 |
PBS液灌注大鼠全结肠,待运动模式稳定约30 min后,经结肠近端缓慢(2 min) 注入比沙可啶混悬液(浓度1 mg/ml) 或生理盐水即0.9% NaCl 2 ml,同时减去流出端试管内液体2 ml,保持结肠腔内压力不变。观察30-40 min后灌注PBS液及槽内的Krebs液洗脱干预效果(约5 min),待运动模式稳定约15 min后,用上述同样的方法在结肠远端给药,观察运动模式变化。
1.3.4 统计学处理实验数据用SPSS 17.0软件及时空图相关软件分析,以均数±标准差(x±s) 表示, 组间比较采用成组t检验和非参数检验,P < 0.05为差异有统计学意义。
2 结果 2.1 近端灌注给药引发LDCs的结果 2.1.1比沙可啶近端灌注给药引发簇集性LDCs形成。LDCs通常连续3-8个为一簇;其频率为3簇/15 min (n=8/11)。典型簇集性LDCs见图 1;簇集性LDCs特征见表 1。
| 表 1 比沙可啶引发的簇集性LDCs的特征 |
引发独立存在的LDCs数量减少。比沙可啶和0.9% NaCl近端灌注给药与其基础状态相比较,均可引起独立存在的LDCs频率减少(P < 0.05),两者对LDCs运动的传播速度,推进距离和持续时间无明显影响(见表 2)。同时两者均可使结肠头端收缩运动增强(P < 0.05),而对其传播速度,推进距离和持续时间无明显影响(见表 3)。头端收缩运动通常和远端RPMCs并存。
| 表 2 近端灌注给药对LDCs的影响 |
| 表 3 近端灌注对头端收缩运动的影响 |
比沙可啶远端灌注给药可引发独立的LDCs (n=10/11), 见图 2,而0.9% NaCl远端灌注仅1例出现LDCs,且频率较低(见表 4);LDC终止后RPMCs出现于远端结肠;其可引发典型簇集性LDCs的(每簇连续3-6个) 有3例:其中2例频率为1簇/15 min,每簇连续3个LDCs,1例频率为3簇/15 min,每簇3-4个LDCs。
| 表 4 远端灌注给药对LDCs的影响 |
0.9% NaCl近端和远端灌注给药均可引发节律性LDCs转换成缓慢推进的节律性运动(近端给药n=5/8;远端给药n=6/8),这种运动的前面往往伴随有头端收缩运动,其形态与分解运动相似,见图 3。

|
图 3 0.9% NaCl腔内灌注引发缓慢推进的节律性运动 a.基础状态下稳定的LDCs运动;b. 0.9% NaCl近端给药后将LDCs转换为缓慢推进的节律性运动,起源于近端结肠的较强收缩,缓慢向远端推进,未见簇集性LDCs;c.Krebs液及PBS灌洗脱后,0.9% NaCl远端灌注引发缓慢推进性的节律性运动,未见独立的或簇集性LDCs |
本实验首次发现比沙可啶近端结肠灌注可使LDCs具有簇集倾向,远端灌注比沙可啶可复现规律性独立的LDCs,促进结肠传输;但比沙可啶对头端收缩运动及RPMCs无明显影响。
簇集性LDCs至少连续3个LDCs为一簇,最多连续8个为一簇,其频率每15 min至多有3簇,大多为2簇,每簇之间间隔1-7 min,大多间隔1-2 min, 平均(2.41±1.82) min, 其推进速度、持续时间与独立的LDCs相似。本课题组在家兔近端结肠实验中发现快速推进性收缩具有簇集倾向,簇集代表激发短暂增加,与收缩振幅增加及加速腔内液体流出有关,簇集LDCs与单独LDCs相比,更能加速结肠传输,快速推进性收缩可被TTX阻断,而簇集性快速推进性收缩通常在有TTX存在时出现,暗示控制簇集的起搏器可能是非神经源性的[4],据此我们推测簇集LDCs的簇集倾向可能是非神经源性的,但控制LDCs的起搏器主要是神经源性的[5, 6],说明比沙可啶引发簇集LDCs可能具有神经源性和肌源性两种作用机制。早期有关于人和豚鼠离体结肠肌条的实验中表明比沙可啶可致结肠痉挛样活动产生[7],人短时间口服比沙可啶部分出现阵发性腹部痉挛样疼痛,我们猜测比沙可啶引发LDCs簇集运动可能与此副作用有关。近端结肠给药及远端结肠给药均可诱发LDCs簇集,但前者比后者明显,这与口服给药比经直肠给药的副作用要多相一致。每簇结束后的终端伴随成群的RPMCs, 主要与辅助粪便清空与排出其他有关。比沙可啶近端结肠灌注可使独立LDCs的总平均频率减少,与比沙可啶经直肠给药比经口服治疗效果要好相符。0.9% NaCl近端结肠灌注具有同样的效果,原因可能是与其将LDCs转换成头端收缩运动及其收缩末端伴随的顺向缓慢推进的收缩波有关。
远端灌注比沙可啶后91%又复现规律性独立的LDCs,这与人结肠测压中发现比沙可啶可诱发高振幅推进性收缩(high amplitude propagated contractions, HAPCs) 相一致[2]。比沙可啶诱发的LDCs的基本特征与基础状态下的相似,前期研究表明LDCs是离体大鼠结肠的主要推进性运动模式,可将结肠内容物向肛侧推进,且可被神经阻滞剂TTX阻断[8],动物实验表明LDCs主要经由肠肌层神经丛相关的cajal间质细胞(ICC-MP) 介导产生[6, 9],人体实验表明比沙可啶可能通过肠肌间神经丛发挥作用[10],近期Giorgio等研究表示比沙可啶可作为结肠神经性损害的生物标记物之一[2],因此比沙可啶可能通过起搏ICC-MP发挥致泻作用,且神经源性机制起主要作用。前期研究表明一氧化氮合酶抑制剂可抑制LDCs, 提示了氮能神经元与此运动的相关性[8],Gaginella等实验表示氮能神经元可能参与了bisacodyl致泻机制[11],据此推测氮能神经元可能是比沙可啶的作用机制之一。
总之,比沙可啶可通过诱发簇集性LDCs和独立LDC促进结肠传输,推测神经源性机制占主要作用,经直肠给药和口服给药虽然诱发的运动模式不同,但均有促进传输的作用。比沙可啶长期用药对结肠运动模式的影响有待进一步研究。
| [1] | van den Berg MM, Hogan M, Caniano DA, et al. Colonic manometry as predictor of cecostomy success in children with defecation disorders[J]. J Pediatr Surg, 2006, 41(4): 730-736. DOI: 10.1016/j.jpedsurg.2005.12.018. |
| [2] | Giorgio V, Borrelli O, Smith VV, et al. High-resolution colonic manometry accurately predicts colonic neuromuscular pathological phenotype in pediatric slow transit constipation[J]. Neurogastroenterol Motil, 2013, 25(1): 70-78. DOI: 10.1111/nmo.2012.25.issue-1. |
| [3] | Huizinga JD, Martz S, Gil V, et al. Two independent networks of interstitial cells of cajal work cooperatively with the enteric nervous system to create colonic motor patterns[J]. Front Neurosci, 2011, 5: 93. |
| [4] | Chen JH, Yang Z, Yu Y, et al. Haustral boundary contractions in the proximal 3-taeniated rabbit colon[J]. Am J PhysiolGastrointest Liver Physiol, 2016, 310(3): G181-G192. |
| [5] |
张倩, 陈继红, 李孔玲, 等. 大鼠远段结肠体外运动模式的实验研究[J].
武汉大学学报:医学版, 2013, 34(5): 670-673.
Zhang Q, Chen JH, LI KL, et al. Neurogenic and myogenic motor patterns of distal colon in rats in vitro[J]. Med J Wuhan Univ, 2013, 34(5): 670-673. |
| [6] |
栗宏斐, 陈继红, 黄敏, 等. 不同状态下大鼠结肠长距离收缩运动的特征[J].
武汉大学学报:医学版, 2016, 37(2): 200-204.
LI HF, Chen JH, Huang M, et al. Characteristics of long distance contraction in rat colon in different conditons[J]. Med J Wuhan Univ, 2016, 37(2): 200-204. |
| [7] | Leng-Peschlow E. Effects of sennosides A+B andbisacodylon rat large intestine[J]. Pharmacology, 1989, 38(5): 310-318. DOI: 10.1159/000138551. |
| [8] | Chen JH, Zhang Q, Yu Y, et al. Neurogenic and myogenic properties of pan-colonic motor patterns and their spatiotemporal organization in rats[J]. PLoS One, 2013, 8(4): e60474. DOI: 10.1371/journal.pone.0060474. |
| [9] | Huizinga JD, Chen JH. Interstitial cells of Cajal:Update on basic and clinical science[J]. Curr Gastroenterol Rep, 2014, 16(1): 1-11. |
| [10] | Bassotti G, Chiarioni G, Germani U, et al. Endoluminalinstillation of bisacodyl in patients with severe (slow transit type) constipation is useful to test residual colonic propulsive activity[J]. Digestion, 1999, 60(1): 69-73. DOI: 10.1159/000007591. |
| [11] | Gaginella TS, Mascolo N, IzzoAA, et al. Nitric oxide as a mediator of bisacodyl and phenolphthalein laxative action: induction of nitric oxide synthase[J]. J Pharmacol Exp Ther, 1994, 270(3): 1. |
 2017, Vol. 38
2017, Vol. 38

 ,
,