2. 武汉大学中南医院 病理科 湖北 武汉 430071
2. Dept.of Pathology, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是一组具有异质性的侵袭性疾病。CHOP方案是其常用的标准化疗方案,但其化疗完全缓解(CR)率只有47%-67%,35%-40%的患者可以化疗治愈; 即使加入单克隆抗体美罗华的R-CHOP方案,其CR率也只有76%-86%[1]。对化疗达CR后失败的患者,肿瘤细胞将对多种药物耐药,影响其生存期。Ohsawa等[2]用免疫组化的方法研究未治疗的DLBCL细胞中包括P糖蛋白(P-gp)、多药耐药相关蛋白(MRP1)和肺耐药蛋白(LRP)等多药耐药(MDR)蛋白的表达与化疗疗效及预后的关系,其阳性率分别为37%、63%和68%,CR亚组的阳性率明显较低,而且LRP的表达与低生存率相关。DLBCL中MDR的表达是明确的,而且可能与化疗的疗效甚至预后有关。
Alizadeh[3]关于DLBCL的一项基因表达模式的研究发现,DLBCL存在生发中心B细胞样(germinal center B-cell, GCB)和非生发中心B细胞样(non-GCB)两亚型,其5年生存率分别为76%和16%。Rosenwald[4]及Hans[5]等的研究用CD10、Bcl-6、MUM-1将DLBCL区分为GCB和non-GCB亚型,而这两种亚型可类似于国际预后指标(IPI)来独立预测DLBCL的治疗结果。那么GCB和non-GCB亚型肿瘤细胞中MDR的表达是否有差异,此差异是不是这两种亚型预后差异的原因,本研究试图探讨上述问题。
1 资料与方法 1.1 标本收集2000年1月-2009年12月武汉大学中南医院病理诊断明确、临床资料、随访资料齐全的DLBCL 37例。采用免疫组化方法检测组织标本中CD10、Bcl-6、MUM-1的表达,将其分为GCB和non-GCB两种亚型。免疫组化检测P-gp、LRP、MRP1在每个组织标本中的表达,比较其在GCB和non-GCB两组中的表达差异。
1.2 试剂所用抗体包括CD10、Bcl-6、MUM-1、P-gp、LRP、MRP1购自福建迈新生物试剂公司。二氨基联苯胺(DAB)显色试剂盒购自武汉博士德生物工程有限公司。
1.3 免疫组织化学染色组织标本切成3 μm厚切片,常规脱蜡,梯度乙醇水化。微波抗原修复:修复液(0.01 mol/L枸橼酸缓冲液,pH 6.0)微波加热至沸腾后放入玻片,中低火维持10-15 min,自然冷却至室温。阻断内源性过氧化物酶活性:3%过氧化氢溶液室温孵育15 min。滴加一抗覆盖,4 ℃湿盒中孵育过夜。DAB显色。
1.4 结果判断CD10阳性产物定位于细胞膜,Bcl-6及MUM-1阳性产物定位于胞质和细胞核。P-gp染色阳性定位于细胞膜,LRP染色阳性定位于胞质和核膜,MRP1染色阳性定位于细胞核。染色结果判断标准参照Fromowitz方法在高倍镜下对核、膜、质着色反应作如下评分:①无着色为0,淡黄色为2,棕褐色为3; ②阳性范围: < 5%为0,5%-25%为1,26%-50%为2,51%-75%为3,>75%为4。两结果相加 < 2为阴性(-),2-3为弱阳性(+),4-5为中度阳性(

CD10阳性归为GCB组,CD10阴性、Bcl-6阴性归为non-GCB组,CD10阴性、Bcl-6阳性则根据MUM-1决定:MUM-1阳性归为non-GCB组,MUM-1阴性归为GCB组。
1.6 统计学处理采SPSS 17.0统计软件包对数据进行处理,采用卡方检验,P<0.05表示差异有统计学意义。
2 结果 2.1 一般特征患者中位年龄为57岁,年龄范围在21-82岁。具体结果见表 1。
| 表 1 37例初治DLBCL患者的临床资料 |
37例病理标本中,CD10表达阳性的有12例,阳性表达率为32.4%; Bcl-6表达阳性的有4例,阳性表达率为10.8%; MUM-1表达阳性的有13例,阳性表达率为35.1%,结果如表 2所示。根据前文所述分型方法,纳入GCB组的有17例,占45.9%;纳入non-GCB组的有20例,占54.1%。
| 表 2 CD10、Bcl-6、MUM-1的表达情况 |
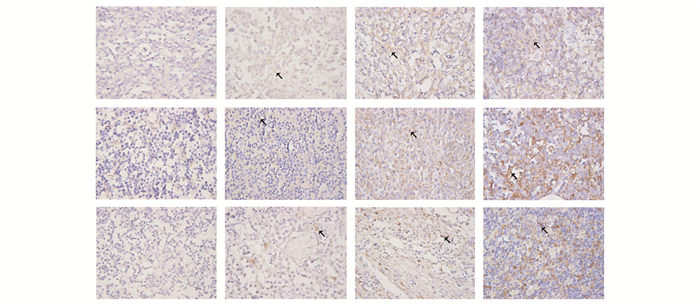
研究的3种多药耐药蛋白P-gp、LRP、MRP1的阳性表达例数分别为23例、35例、23例,阳性表达率分别为62.2%、94.6%、62.2%,其免疫组化结果见图 1。
|
图 1 P-gp、LRP、MRP1免疫组化染色图片(DAB×400)
从左至右:A (-) B (+) C ( |
通过卡方检验,发现GCB和non-GCB两组中P-gp、LRP、MRP1的表达并无统计学差异(P=1.0,P=0.49,P=1.0)。
3 讨论DLBCL是一种B细胞源性的中-高度侵袭性非霍奇金淋巴瘤,具有显著的异质性,体现在临床表现、组织学特征、免疫表型、遗传学特点、生物学行为的复杂多样,还体现在对治疗反应的不一致以及预后的差异[6]。根据免疫表型模式对DLBCL分型,探讨各亚型与预后之间的关系是近年来的研究热点,聚焦点主要是B细胞分化的相关抗原,如CD10、Bcl-6、MUM-1等,但各研究的分型方法以及结果并不一致,有待进一步的研究。
如Alizadeh[3]和Rosenwald[4]等的研究,采用基因芯片技术行DLBCL基因表达谱分析可阐明DLBCL的临床及分子异质性,Shipp等[7]也对CR和复发难治的DLBCL进行基因芯片检测,检测出了与预后相关的基因。但由于基因芯片成本昂贵,而且对标本要求严格,必须是新鲜的或者冰冻的标本,这限制了其在临床上的广泛运用。组织微阵列(tissue microarray,TMA)是能在一张切片上快速、经济而有效评价多份肿瘤样本的免疫组化染色的技术,其检测结果与cDNA微阵列类似,重要的是其操作简便,易于应用于临床。Hans等[5]对TMA技术和cDNA微阵列技术进行了比较,研究了两者对DLBCL分型的准确性。先用cDNA微阵列技术对152份标本检测分型,然后根据以往的研究结果用CD10、Bcl-6和MUM-1标记。CD10阳性归为GCB组,CD10阴性、Bcl-6阴性归为non-GCB组,CD10阴性、Bcl-6阳性则根据MUM-1决定:MUM-1阳性归为non-GCB组,MUM-1阴性归为GCB组。若将cDNA微阵列技术作为金标准,应用TMA技术检查,发现有30人被错分,但得出来的分型结果GCB型的预后明显好于非GCB型,与cDNA微阵列技术分型的结果保持一致。更重要的是,被错分的这30人中,有8人被错分为GCB型,但与其它GCB型患者5年总生存率相同; 另外22人被错分为非GCB型,但与其它非GCB型患者的预后一致。由此看出,相比cDNA微阵列技术,应用TMA技术进行免疫分型能更加准确地预测预后。分析原因,可能是因为免疫组化染色能在显微镜下更直观地辨别肿瘤细胞与正常细胞,而cDNA微阵列技术,除非进行显微解剖,否则存留在样本中的正常组织会影响对肿瘤组织的分析。在其他研究中把同时表达CD10和Bcl-6作为GCB型DLBCL的标志,亦得出GCB型预后较好的结论[5]。但Colomo等[8]试图用免疫组化的方法把DLBCL分型为CD10(+) GCB,CD10(-) GCB,post-GCB,却未显示预后方面的差别。或许几个有限的抗原标记还不能很好地区分由基因微阵列技术所显示的结果。
在Hans等的研究中,GCB亚型占42%,non-GCB亚型占58%。在本研究中,GCB亚型占45.9%,non-GCB亚型占54.1%,non-GCB亚型的病人占大多数。这与目前大多数关于DLBCL的两种亚型的研究是一致的。
MDR是指肿瘤细胞对一种药物产生耐药性后,对未接触过的、结构无关、机制各异的多种抗肿瘤药物也产生交叉耐药性。MDR是一种常见的化疗耐药,是肿瘤化疗失败及肿瘤复发的重要原因。根据肿瘤细胞耐药的发生特点,可分为原发性耐药及获得性耐药,前者是指肿瘤细胞在没有接触化疗药物前已经耐药; 后者则是由于化疗药物的刺激,使能够高度表达MDR1基因的肿瘤细胞得以优势生长或直接激活肿瘤细胞中的启动子,实现其过表达而产生的耐药。本课题采用的是未经治疗过的弥漫大B细胞淋巴瘤的标本,研究的是前者。
耐药的产生取决于三个方面:肿瘤细胞内作用部位的药物浓度、肿瘤细胞本身的量和质以及肿瘤细胞和药物间的相互作用[9]。MDR已得到深入的研究,其中有代表性的、机制明确的包括P-糖蛋白(P-gp)、多药耐药相关蛋白(MRP1)和肺耐药蛋白(LRP)。经过相关蛋白介导,通过减少细胞内细胞毒药物的堆积来发挥细胞耐药功能,包括:①细胞膜水平的药物摄入减少和外排增多,如由MDR1基因编码的P-gp的表达引起的耐药。②细胞器及细胞质水平药物作用靶点能力的丧失,如由多药耐药性相关蛋白MRP引起的耐药。③对化疗药物的胞吐作用,如肺耐药性相关蛋LRP引起的耐药。④其它如药物靶点在质和量上的改变, 凋亡机制的表达失常等。这些机制常同时存在,但以一种为主,且不同机制间常相互影响,关系复杂,与GCB和non-GCB预后差异不存在直接对应关系。
GCB和non-GCB预后差异的研究是目前的热点,但其根本原因目前仍在探索中,P-gp、LRP、MRP1这3种耐药蛋白在这两种亚型中的表达并无统计学差异,说明GCB和non-GCB预后差异与MDR无直接相关性,其具体机制有待进一步研究。
| [1] | Feugier P, Hoof AV, Sebban C, et al. Long-term results of the R-CHOP study in the treatment of elderly patients with diffuse large B-cell lymphoma: a study by the Group d`Etude des Lymphoma de I`Adulte[J]. J Clin Oncol, 2005, 23: 4117-4126. DOI: 10.1200/JCO.2005.09.131. |
| [2] | Ohsawa M, Ikura Y, Fukushima H, et al. Immunohistochemical expression of multidrug resistance protein as a predictor of poor response to chemotherapy and prognosis in patient with nodal diffuse large B-cell lymphoma[J]. Oncology, 2005, 68: 422-431. DOI: 10.1159/000086984. |
| [3] | Alizadeh AA, Eisen MB, Davis RE, et al. Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling[J]. Nature, 2000, 403: 503-511. DOI: 10.1038/35000501. |
| [4] | Rosenwald A, Wright G, Chan WC, et al. The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma[J]. N Engl J Med, 2002, 346: 1937-1947. DOI: 10.1056/NEJMoa012914. |
| [5] | Hans CP, Wisenburger DD, Greiner TC, et al. Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray[J]. Blood, 2004, 103(1): 275-282. DOI: 10.1182/blood-2003-05-1545. |
| [6] | Jafe ES, Harris NL, Stein H, et al. World Heahh Organization Classification of Tumors Pathology and Genetics: Tumors of Haematopoietic and Lymphoid Tissues[M]. Lyon: IARC Press, 2001: 171-174. |
| [7] | Shipp MA, Ross KN, Golub TR. Diffuse large B-cell lymphoma outcome prediction by gene-expression profiling and supervised machine learning[J]. Nat Med, 2002, 8: 68-74. DOI: 10.1038/nm0102-68. |
| [8] | Colomo L, GuilIerrno AL, Pefales M, et al. Clinical impact of the differentiation profile assessed by immunophenotyping in patients with diffuse large B-cell lymphoma[J]. Blood, 2003, 101(1): 78-84. DOI: 10.1182/blood-2002-04-1286. |
| [9] | Debenham PG, Kartner N, Siminovitch L, et al. DNA-mediated transfer of multiple drug resistance and plasma mem-brane glycoprotein expression[J]. Mol Cell Biol, 1992, 2: 881-889. |
 2016, Vol. 37
2016, Vol. 37

