2. 广东省深圳市南山区慢性病防治院 广东 深圳 518000
2. Shenzhen Nanshan Center for Chronic Disease Control, Shenzhen 518000, Guangdong, China
8周龄CYP1B1基因敲除(KO)小鼠(美国Frank Gonzalez博士赠送)3只,17-19 g;8周龄SPF级C57BL/6J野生型(WT)小鼠3只,17-19 g,分别作为骨髓移值小鼠的供体,提供CYP1B1基因敲除骨髓和野生型骨髓。10周龄SPF级C57BL/6J野生型(WT)小鼠20只,22-24 g[湖北省疾病预防控制中心提供,动物合格证号为42000600002003,动物房合格证号为SCXX (鄂)2008-0005],作为骨髓移植的受体进行辐射,随机分为WT组和KO组,每组10只。所有小鼠均按组别以每笼5只分笼喂养,自由饮水摄食。动物房控制温度(24±2)℃,相对湿度(45±15)%。
1.2 实验方法 1.2.1 骨髓移植断颈处死8周龄CYP1B1基因敲除小鼠及WT小鼠各3只,无菌条件下收集两组小鼠股骨及小腿骨。分离周围组织,将股骨两端软骨剪去,露出红色的骨髓腔。用1 ml无菌注射器吸取含2%胎牛血清的RPMI 1640液,轻轻插入骨髓腔冲出骨髓腔内的骨髓,吹打混匀后,用40目滤网过滤,用无血清RPMI 1640洗涤2次,计数调整细胞浓度为3.0×106/L备用。在放射线照射前5 d至移植后的4周内,受体小鼠均饮用加有新霉素(100 mg/L)和多黏菌素B (10 mg/L)的灭菌酸性蒸馏水(pH 2.6)[5]。采用60Co全身照射,总剂量8.25 Gy、0.33 Gy/min,共25 min。将20只10周龄雄性小鼠,照射后3 h内经尾静脉按照每只小鼠7.5×105个细胞分别输注CYP1B1基因敲除及WT组小鼠骨髓细胞。骨髓移植的成功以受体小鼠出现WT小鼠不具有而CYP1B1敲除所插入的NEO基因作为依据。
1.2.2 PCR实验EDTA抗凝管收集小鼠血液,3 000 r/min、10 min离心处理后,分离出有核细胞层。按照血液DNA提取试剂盒说明操作,提取血液中的基因组DNA,测DNA浓度后,-20 ℃保存备用。采用Primer 5.0软件设计后并在数据库中验证,最后有武汉擎科生物创新生物科技有限公司合成。
小鼠NEO基因序列引物(460 bp)设计:
上游:5′-TGAATGAACTGCAGGACGAG-3′;
下游:5′-CCACAGTCGATGAATCCAGA-3′;
小鼠CYP1B1基因序列引物(365 bp)设计:
上游:5′-CTGAGTTGGACCAGGTTGTGG-3′;
下游:5′-CATGGATTCTAAACGACTAGG-3′。
在0.5 ml的EP管中加入双蒸水(ddH2O),上、下游引物,2.5 mmol/L脱氧核苷三磷酸(deoxynucleosine triphosphate, dNTP),10倍稀释的缓冲液,DNA和Taq酶,总体积为20 μl。聚合酶链反应(polymerase chain reaction, PCR)条件:95 ℃预变性15 min,95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸60 s,38个循环。用2.5%琼脂糖凝胶电泳对PCR产物特异性进行检验。血液DNA提取试剂盒由北京索莱宝科技有限公司提供。
1.2.3 GVHD评分参见文献[6]。
1.2.4 统计学处理实验数据均以x±s进行表示。用SPSS 17.0软件进行统计学分析,采用t检验分析体重增长率和GVHD评分,以P<0.05为差异有统计学意义。
2 结果 2.1 骨髓移植后受体小鼠移植成功鉴定骨髓移植后取受体小鼠的血液样本提取DNA,用PCR实验检测到NEO基因,说明供体小鼠骨髓移植到受体小鼠体内后骨髓重建成功。我们同时也检测到KO组中血液DNA仍然有CYP1B1的表达,但明显少于WT组,说明8.25 Gy 60Co的照射剂量下受体小鼠仍然会有部分骨髓残留(图 1),我们重建的CYP1B1敲除骨髓移植模型可能会受到残留骨髓的影响,只能发挥部分的功能。

|
图 1 骨髓移植受体小鼠骨髓重建CYP1B1基因和NEO基因检测结果 |
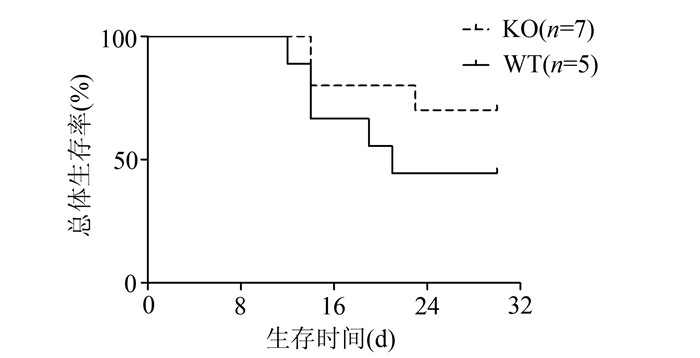
受体鼠采用总剂量8.25 Gy的60Co放射线全身照射后,3 h内经尾静脉输注CYP1B1基因敲除和WT骨髓细胞,4周后WT组小鼠存活率为50%(n=5),KO组小鼠存活率为70%(n=7)。由图 2生存分析可知,KO组小鼠骨髓移植后平均生存时间为(26.10±2.34) d,优于WT组骨髓移植平均生存时间(18.70±1.62) d,KO组小鼠生存时间延长,P<0.05;由于死亡小鼠的体重降幅显著,我们在做两组小鼠体重分析时,剔除了死亡小鼠的体重数据(图 3)。骨髓移植后,KO组与WT组小鼠均于移植后7 d内开始出现体重下降,表现出对辐射的反应,KO组小鼠7 d后恢复初始体重,之后表现持续增长的趋势,而WT组小鼠体重波动大,22 d左右才恢复至初始体重,且KO组小鼠体重增长率始终高于WT组小鼠,P<0.05,见表 1。提示CYP1B1敲除在骨髓移植小鼠生存时间和体重恢复上有一定的保护作用。
|
图 2 骨髓移植后两组小鼠生存情况比较 |

|
图 3 两组小鼠骨髓移植后体重增加率比较情况 与WT组比较,*P<0.05 |
| 表 1 骨髓移植前及4周后两组小鼠体重的变化 |
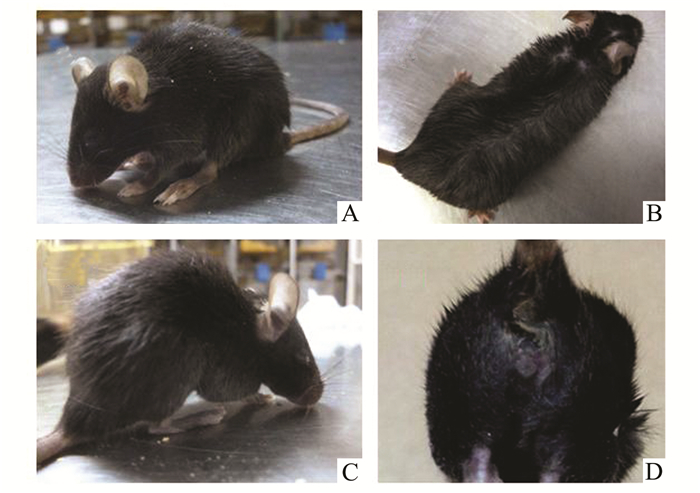
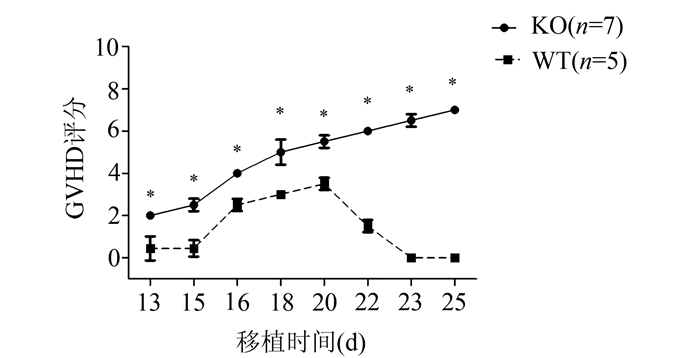
图 4为骨髓移植小鼠典型的GVHD症状,小鼠表现出怠倦、少动、毛发紊乱、竖毛、弓背、肛门红肿、腹泻等症状。根据Cooke[6]的GVHD临床表现评分细则,定期对两组小鼠进行GVHD临床评分(如图 5),13 d后开始两组小鼠出现程度不一的GVHD表现。GVHD评分WT组始终高于KO组,13 d评分KO组(0.44±0.57)低于WT组(2.0±0.00),P<0.05,15 d评分KO组(0.44±0.39)低于WT组(2.50±0.30),P<0.05,16 d评分KO组(2.5±0.29)低于WT组(4.0±0.00),P<0.05,18 d评分KO组(3.0±0.00)低于WT组(5.0±0.60),P<0.05,20 d评分KO组(3.5±0.29)低于WT组(5.5±0.71),P<0.05。且KO组小鼠4周内GVHD反应有显著减轻的趋势,WT小鼠的GVHD反应4周内依然呈现加剧趋势,提示KO鼠呈现GVHD时间短、反应轻的现象。
|
图 4 出现GVHD症状的小鼠照片 A:小鼠表现嗜睡、少动;B:小鼠表现皮毛紊乱、竖毛;C:小鼠表现弓背;D:小鼠表现肛门红肿、腹泻 |
|
图 5 两组小鼠骨髓移植后GVHD评分对比 与WT组比较,*P<0.05 |
异基因造血干细胞移植(Allo-HSCT)是目前可以治愈恶性血液肿瘤的有效手段,它通过输注正常供者的造血干细胞到患者体内,重建患者的造血和免疫功能。而移植物抗宿主病(GVHD)是allo-HSCT后的主要并发症及死亡原因,如何防治GVHD随之成为all-HSCT的热点问题之一。本实验室前期的研究结果显示,CYP1B1对小鼠的脂肪形成及胰岛素抵抗具有显著影响,并且我们在巨噬细胞功能实验中,也验证了CYP1B1敲除对巨噬细胞的迁移能力及吞噬功能是有显著影响的。基于此结论上,我们在动物实验中重建骨髓移植CYP1B1敲除小鼠模型并大胆假设,CYP1B1在骨髓巨噬细胞的异基因移植中具有一定的作用。在建立KO小鼠异基因骨髓移植模型的过程中,我们观察两组小鼠生存情况和GVHD表现的区别,来观察CYP1B1在这其中所起到的作用。本实验根据相关文献及本实验室前期经验,给予受体WT小鼠总剂量8.25 Gy 60Co辐照后,回输供鼠CYP1B1基因敲除和WT骨髓细胞以重建KO和WT小鼠,KO组小鼠体重恢复情况显著优于WT组小鼠,并且波动情况较WT组比较轻。我们重点观察了Cooke[6]等的移植动物GVHD的临床标准,同时也对皮下、肝脏、肠找到出血点证实小鼠GVHD的发生。在两组小鼠GVHD评分中可以看到,KO组小鼠的GVHD评分较WT组小鼠相比较低,表现出GVHD时间短、反应轻的现象。在生存时间上,KO表现出显著性的延长趋势。提示CYP1B1敲除在在小鼠骨髓移植中有延长小鼠平均生存时间、增加小鼠体重、改善GVHD的作用。由于国内对于此相关研究甚少,并且均不深入,后续为了验证我们的结果是否具有偶然性,我们在雄鼠模型中重复了3次,雌鼠模型中重复了2次,存活率均呈现出KO组小鼠高于WT组,生存情况也较WT组有明显改善。
综上,我们认为CYP1B1敲除在小鼠骨髓移植中有延长平均生存时间、增加小鼠体重、改善GVHD的作用,但关于CYP1B1敲除发挥此作用的时效性以及其机制仍待我们下一步的深入研究。
| [1] | Wagner JE, Thompson JS, Carter SL, et al. Effect of graft-versus-host diseaseprophylaxis on 3-year disease-free survival in recipients of unrelated donor bone marrow (T-cell Depletion Trial):a multi-centre, randomised Phase Ⅱ-Ⅲ trial[J]. Lancet, 2005, 366(9 487): 733-741. |
| [2] | Messina C, Farad M, de Fazio V, et al. Prevention and treatment of acute GVHD[J]. Bone Marrow Transplant, 2008, 41(Suppl 2): S65-S70. |
| [3] | Tang Y, Scheef EA, Wang S, et al. CYP1B1 expression promotes the proangiogenic phenotype of endothelium through decreased intracellular oxidative stress and thrombospondin-2 expression[J]. Blood, 2008, 113(3): 744-754. |
| [4] | Liu XC, Huang TT, Li L, et al. CYP1B1 deficiency ameliorates obesity and glucose intolerance induced by high fat diet in adult C57BL/6J mice[J]. Am J Transl Res, 2015, 7(4): 761-771. |
| [5] | Ward JM, Nikolov NP, Tschetter JR, et al. Progressive glomerulonephritis and histiocytic sarcoma associated with macrophage functional defects in CYP1B1-deficient mice[J]. Toxicol Pathol, 2004, 32(6): 710-718. DOI: 10.1080/01926230490885706. |
| [6] | Cooke KR, Kobzik L, Martin TR, et al. An Experimental Model of Idiopathic Pneumonia Syndrome After Bone Marrow Transplantation:Ⅰ. The Roles of Minor H Antigens and Endotoxin[J]. Blood, 1996, 88(8): 3 230-3 239. |
 2016, Vol. 37
2016, Vol. 37

