心肌缺氧缺血损伤是心肌梗死或心脏手术中不可避免的损伤因素,涉及多种分子机制及信号通路,其中,高迁移率族蛋白1(high mobility group protein,HMGB1) 被发现与心肌缺氧损伤密切相关[1]。HMGB1是一种染色体结合蛋白,已被证实参与维持核小体的稳定,基因的传递,细胞分化、炎症反应、免疫等多种生理病理过程[2]。HMGB1可由坏死细胞被动释放至胞外,也可由免疫细胞主动分泌放至胞外,引起相应的病理反应[3]。
一氧化碳(carbon monoxide,CO)常被认为是一种有毒气体,它极易与体内血红蛋白结合形成碳氧血红蛋白,导致机体缺氧。事实上,CO也是人体内正常的气体信使。它是由体内血红素加氧酶催化血红素而生成,在生理状况下承担着重要作用,被称为内源性CO,近10年研究表明,促进内源性CO生成或给予外源性CO在多个损伤模型中都具有抗凋亡、抗炎、抗氧化等保护作用[4],而一定量的CO同样已被证实能减少心脏缺氧缺血损伤[5]。研究证明CO可能通过多种分子机制减少细胞缺氧损伤,包括诱导趋化因子CXCL12表达,抑制线粒体膜的通透性等[6, 7],但具体机制尚未完全阐明。由此,本研究通过一氧化碳释放分子2(carbon monoxide-releasing molecule 2, CORM-2) 缓慢释放CO,拟在心肌细胞缺氧模型的水平上,探讨CORM-2对缺氧心肌细胞内HMGB1分布和表达变化影响以及对心肌细胞的保护作用,以期为CO的临床运用提供一定的理论依据。
1 材料与方法 1.1 材料与试剂H9C2心肌细胞株(中国科学院上海生命科学研究所细胞资源中心);CORM-2(美国Sigma-Aldrich公司),DMEM高糖培养基(美国Gibco公司);DMEM无糖培养基(美国Gibco公司), 胎牛血清(杭州四季青生物工程有限公司);细胞核浆分离试剂盒(碧云天生物技术研究所),Annexin V-FITC凋亡检测试剂盒(美国eBioscience公司);抗HMGB1抗体(美国Abcam公司);抗Caspase-3抗体(美国Cell Signaling Technologies公司);抗β-actin抗体(美国Genetex公司)、CCK-8试剂盒(日本DOJINDO公司),其余试剂均为分析纯。
1.2 心肌细胞培养及分组大鼠H9C2心肌细胞常规接种在含10%胎牛血清,100 g/L青霉素、100 g/L链霉素的DMEM高糖培养液中,置于37 ℃,5%CO2孵箱内培养。每48 h换液1次,当培养瓶中的细胞密度达80%-90%时,用0.25%胰酶消化接种于96孔板、6孔板或60 mm培养皿中。当每孔细胞密度达80%-90%时,可进入实验。选取生长密度相似,生长状况良好的对数期心肌细胞进行随机分组:① 正常组(H9C2):未经缺氧处理,置于37 ℃,5%CO2孵箱内培养;② 缺氧组(Hypoxia+H9C2):将常规培养基置换为无糖无血清DMEM培养基,置于缺氧培养箱行缺氧处理;③ CORM-2组(CORM-2+ Hypoxia+H9C2):CORM-2即配即用,使用时溶于二甲基亚砜(DMSO)中,配成浓度为0.1 μmol/L溶液,在实验前1 h加入培养基后放入5%CO2孵箱内行预处理,1 h后置换无糖无血清DEME培养基行缺氧处理;④ ICORM-2组(ICORM-2+Hypoxia+ H9C2):失活CO释放分子2(iCORM-2) 为CORM-2溶于二甲基亚砜(DMSO)室温放置24 h待CO分解释放完全后制成,溶液浓度为0.1 μmol/L,在实验前1 h加入培养基后放入5%CO2孵箱内行预处理,1 h后置换无糖无血清DMEM培养基行缺氧处理。
1.3 建立心肌细胞缺氧模型将无糖无血清DMEM培养基在缺氧培养箱(37 ℃,94% N2, 5% CO2、1%O2)平衡4 h,将平衡后的无糖无血清培养基置换培养皿内的常规培养基,CORM-2组及ICROM-2组分别加入相应浓度的CORM-2和iCORM-2溶液,预处理1 h后均放入缺氧培养箱进行缺氧处理12 h。正常组在含血清的DMEM高糖培养基,37 ℃、5% CO2的孵箱内培养12 h。
1.4 细胞活性测定将H9C2细胞接种于96孔板,每组设置5个副孔,按上述实验方法进行实验后,每孔加10 μl CCK-8试剂,轻摇,37 ℃孵育2 h,用酶标仪(λ=450 nm)记录各孔的吸光度(OD)。去除最大值与最小值,取4孔OD值的平均数,按公式计算细胞存活率,细胞存活率(%)=(处理组OD-空白组OD)/(对照组OD-空白组OD)×100%,重复3次。
1.5 流式细胞术检测细胞凋亡情况根据Annexin V-FITC/PI凋亡检测试剂盒所提供的方法,行流式细胞检测。
1.6 免疫荧光检测H9C2细胞经实验处理后,用4%多聚甲醛固定20 min,0.25% Triton破膜处理10 min,5% BSA封闭1 h, 一抗4 ℃孵育过夜, 第2天二抗孵育2 h, DAPI染核8 min, 封片。在荧光显微镜下观察HMGB1的荧光表达, 取10个视野。
1.7 WesternBlot法检测胞浆胞核HMGB1及凋亡相关蛋白的表达情况① 总蛋白样本提取:使用常规蛋白提取方法提取总蛋白;② 胞浆胞核蛋白提取:根据核浆蛋白分离试剂盒说明书分别提取细胞浆蛋白;③ 采用BCA法测定蛋白含量并制作标准曲线,按常规Western Blot法完成操作,采用美国LICOR公司Odyssey双色红外激光成像系统扫描,Odyssey软件测定灰度值并进行分析, 相同实验重复3次。
1.8 统计学方法采用SPSS 22.0软件对实验数据进行统计学分析,计量数据以均数±标准差(x±s)表示,实验数据除荧光形态图为定性资料外,均为定量资料,两组间比较采用t检验,校验水准α= 0.05;多组间比较,数据符合正态分布,方差齐性检验符合方差整齐的假设,行单因素方差分析及LSD检验,P< 0.05表示差异有统计学意义。
2 结果 2.1 CORM-2预处理提高H9C2细胞缺氧引起的细胞活性分别应用不同浓度CORM-2溶液预处理H9C2心肌细胞1 h后行缺氧处理12 h,缺氧细胞活力[(34.7±4.9)%]较正常组[(100±5.9)%]明显减低(P<0.05),60 μmol/L CORM-2较缺氧组提高细胞活性(P<0.05)(表 1),所以接下来的实验过程中CORM-2浓度均为60 μmol/L。
| 表 1 不同浓度CORM-2预处理对缺氧H9C2细胞活性影响(x±s) |
正常细胞中HMGB1大部分在细胞核中,而H9C2经12 h缺氧后,HMGB1部分迁移释放至细胞浆,CORM-2预处理的细胞可减少HMGB1的迁移释放,ICORM-2组HMGB1细胞浆释放量与缺氧组未见明显变化(图 1)。
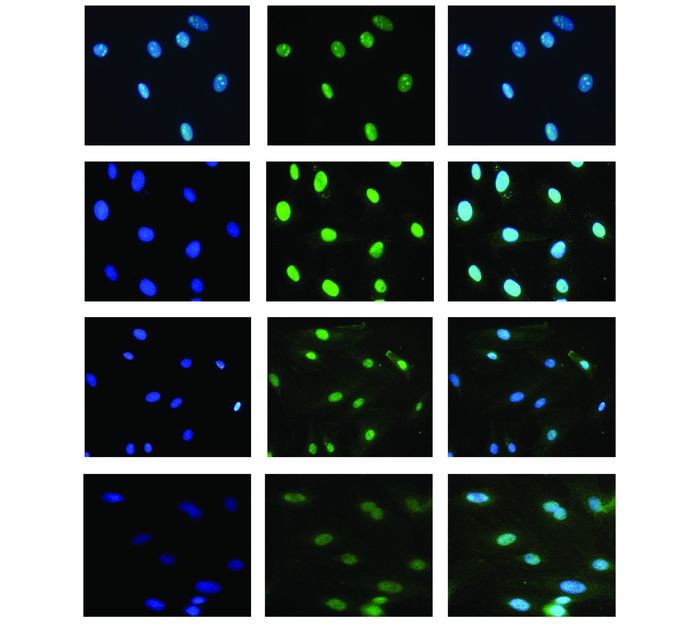
|
图 1 HMGB1核浆分布情况(×200) |
H9C2经过12 h缺氧后,细胞凋亡率明显上升。而使用CORM-2预处理的细胞能明显减少凋亡,使细胞凋亡率从(27.4 ±4.2)%降低到(14.1±1.9)%(P<0.05),使用ICORM-2预处理的细胞并不能明显减少细胞凋亡(图 2,表 2)。
|
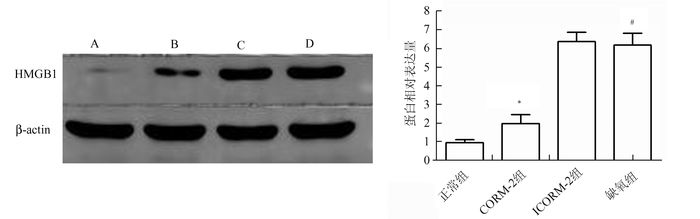
图 2 CORM-2预处理对胞浆HMGB1的影响 A:正常组;B:CORM-2组;C:ICORM-2组;D:缺氧组与正常组比较,#P<0.05;与缺氧组比较,*P<0.05 |
| 表 2 CORM-2预处理对缺氧细胞凋亡的影响(x±s) |
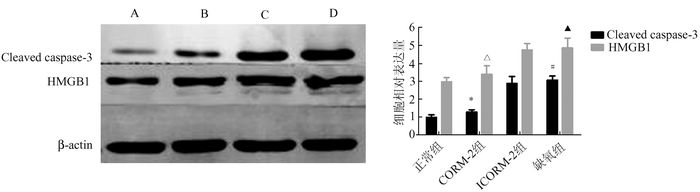
Western Blot检测H9C2 HMGB1细胞浆迁移释放情况,结果表明,与正常对照组比较,HMGB1在缺氧心肌细胞胞浆内迁移释放明显增多(P<0.05),使用CORM-2预处理后则明显减少(P<0.05)。Western Blot同时检测H9C2总蛋白内的HMGB1及Cleaved Caspase-3表达水平,发现HMGB1及Cleaved Caspase-3表达在缺氧组明显升高,而CORM-2组蛋白表达较缺氧组降低(P<0.05)。ICORM-2组与缺氧组在胞浆HMGB1迁移释放及总HMGB1和Cleaved Caspase-3表达上无明显差异。
|
图 3 CORM-2预处理对细胞HMGB1及Cleaved caspase-3影响
A:正常组;B:CORM-2组; C:ICORM-2组;D:缺氧组 Cleaved caspase-3:与正常比较,#P<0.05, 与缺氧组比较,*P<0.05 HMGB1:与正常组比较,▲P<0.05, 与缺氧组比较,△P<0.05 |
心肌缺氧损伤是心肌梗塞及心脏手术过程中不可避免的损伤,而HMGB1与心肌缺氧损伤密切相关,损伤心肌能释放HMGB1,释放后的HMGB1与其相关受体结合:① 与晚期糖基化终产物受体(receptor of advanced glycation end products,RAGE)结合,激活细胞核表面的NF-κB信号转录因子活化细胞,促进IL-6及TNF-α等炎症因子的释放;② 与Toll样受体(Toll-1ike receptors,TLRs)结合,通过MyD88通路或Toll白细胞介素受体相关调节因子通路(非MyD88通路),最终通过激活NF-κB通路及p38信号通路介导炎症反应或引起干扰素β及干扰素诱导基因的生成[3, 8, 9]。
在离体心脏的研究表明,心脏在CO处理后提高了缺氧耐受性,能够增加基础冠状动脉血流和减轻冠脉痉挛程度,改善心脏收缩,减少室性心律失常的发生率[10]。使用CORM-2预处理的离体心脏经缺血再灌注处理,结果提示缺血后心肌损伤标志物肌酸激酶(CK)和乳酸脱氢酶(LDH)水平显著降低。此外,CORM-2处理显著提高冠脉流量参数,减少梗死面积[11, 12]。
本实验以HMGB1为切入点,研究CORM-2预处理对心肌细胞缺氧后HMGB1表达的影响,结果发现,CORM-2组心肌细胞活性明显提高,凋亡减少,Western Blot检测也发现HMGB1总含量及细胞浆分布量减少,相关凋亡指标也较缺氧组减低,这说明CORM-2能够明显减轻细胞损伤,而这极有可能是通过影响HMGB1分布和表达引起的。而ICORM-2组结果与缺氧组结果无明显差异。
综上所述,CORM-2能够影响缺氧心肌细胞内HMGB1的分布及释放,减小细胞凋亡,期望在将来的研究过程中,能在细胞及动物模型上进一步研究HMGB1所介导的信号通路, 以期更好地理解HMGB1在心肌细胞缺氧过程中所发挥的作用。
| [1] | Zhang T, Yang S, Du J. Protective effects of berberine on isoproterenol-induced acute myocardial ischemia in rats through regulating HMGB1-TLR4 axis[J]. Evid Based Complement Alternat Med, 2014, 2014: 849783. |
| [2] | Kang R, Chen R, Zhang Q, et al. HMGB1 in health and disease[J]. Mol Aspects Med, 2014, 40: 1-116. DOI: 10.1016/j.mam.2014.05.001. |
| [3] | Tsung A, Tohme S, Billiar TR. High-mobility group box-1 in sterile inflammation[J]. J Intern Med, 2014, 276(5): 425-443. DOI: 10.1111/joim.2014.276.issue-5. |
| [4] | Ghosh S, Gal J, Marczin N. Carbon monoxide: Endogenous mediator, potential diagnostic and therapeutic target[J]. Annals of Medicine, 2010, 42(1): 1-12. DOI: 10.3109/07853890903482877. |
| [5] | Zhu X, Zuo L. Characterization of oxygen radical formation mechanism at early cardiac ischemia[J]. Cell Death Dis, 2013, 4: e787. DOI: 10.1038/cddis.2013.313. |
| [6] | Queiroga CSF, Almeida AS, Martel C, et al. Glutathionylation of adenine nucleotide translocase induced by carbon monoxide prevents mitochondrial membrane permeabilization and apoptosis[J]. The Journal of Biological Chemistry, 2010, 285(22): 17077-17088. DOI: 10.1074/jbc.M109.065052. |
| [7] | Kondo-Nakamura M, Shintani-Ishida K, Uemura K, et al. Brief exposure to carbon monoxide preconditions cardiomyogenic cells against apoptosis in ischemia-reperfusion[J]. Biochem Biophys Res Commun, 2010, 393(3): 449-454. DOI: 10.1016/j.bbrc.2010.02.017. |
| [8] | Ha T, Liu L, Kelley J, et al. Toll-like receptors: new players in myocardial ischemia/reperfusion injury[J]. Antioxid Redox Signal, 2011, 15(7): 1875-1893. DOI: 10.1089/ars.2010.3723. |
| [9] | Herzog C, Lorenz A, Gillmann HJ, et al. Thrombomodulin's lectin-like domain reduces myocardial damage by interfering with HMGB1-mediated TLR2 signalling[J]. Cardiovasc Res, 2014, 101(3): 400-410. DOI: 10.1093/cvr/cvt275. |
| [10] | Lin HH, Chen YH, Chiang MT, et al. Activator protein-2α mediates carbon monoxide-induced stromal cell-derived factor-1α expression and vascularization in ischemic heart[J]. Arteriosclerosis, Thrombosis, and Vascular Biology, 2013, 33(4): 785. DOI: 10.1161/ATVBAHA.112.301143. |
| [11] | Soni H, Patel P, Rath AC, et al. Cardioprotective effect with carbon monoxide releasing molecule-2 (CORM-2) in isolated perfused rat heart: Role of coronary endothelium and underlying mechanism[J]. Vascul Pharmacol, 2010, 53(1-2): 68-76. DOI: 10.1016/j.vph.2010.04.002. |
| [12] | Soni HM, Jain MR, Mehta AA. Mechanism(s) Involved in Carbon Monoxide-releasing Molecule-2-mediated Cardioprotection During Ischaemia-reperfusion Injury in Isolated Rat Heart[J]. Indian Journal of Pharmaceutical Sciences, 2012, 74(4): 281-291. DOI: 10.4103/0250-474X.107047. |
 2017, Vol. 38
2017, Vol. 38

 ,
,