湿性老年性黄斑变性(wet age-related macular degeneration, wet-AMD)是起源于黄斑区脉络膜的异常新生血管伴发视网膜色素上皮层(retinal pigment epithelial,RPE)下或视网膜下出血、渗出、积液,最终导致光感受器受损、视力丧失的年龄相关致盲的视网膜变性疾病[1]。荧光素眼底血管造影(FFA)能显示视网膜血管形态并发现其通透性的改变,是诊断包括AMD等眼底血管疾病的金标准[2]。但FFA为有创检查,必须注射造影剂,可导致部分患者出现恶心、呕吐、过敏等不良反应[3],临床应用受到一定的限制。
光相干断层扫描血管成像技术(optical coherence tomography angiography,OCTA)是一项无创、高分辨率的检查技术,利用运动粒子散射产生的OCT信号相位的改变,将血流与静态组织区分开[4, 5]。与传统FFA相比,无需静脉注射造影剂即能对视网膜、脉络膜毛细血管进行清晰成像。其中新近出现的分频幅去相关血管成像技术(split-spectrum amplitude-decorrelation angiography,SSADA)可将同一位置反复扫描的OCT全频幅图像分成数段窄谱频带,各频带图像分别进行B扫描的去相关计算,从而自动将其分成浅层、深层视网膜毛细血管、外层视网膜、脉络膜毛细血管四个层面,实现不同层次观察眼底毛细血管的形态[5]。该技术能使活体人类眼部的黄斑及视乳头血管清晰成像并已被广泛应用于临床工作中[5-7]。
我们将这一OCTA技术应用于wet-AMD患者的诊断及随访观察,现将研究结果报道如下。
1 对象与方法 1.1 研究对象将2015年1-6月来我院眼科中心就诊的28例wet-AMD患者28眼纳入研究,包括初发或复发脉络膜新生血管(CNV)患者。患者年龄为54-82(68.19±8.41) 岁。
1.2 纳入与排除标准纳入标准:年龄≥50岁,FFA检查发现中心凹下或中心凹旁新生血管性渗漏,OCT检查发现视网膜下、视网膜内或RPE下高反射信号或积液。排除标准:合并糖尿病视网膜病变、视网膜静脉阻塞、葡萄膜炎、青光眼、角膜病、严重白内障等眼病患者,其他眼病所致的CNV患者,最佳矫正视力(BCVA) < 20/200、屈光不正度数大于6.0 D、固视较差影响OCTA清晰成像者[8, 9]。本研究遵守赫尔辛基宣言,取得患者知情同意后进行。
1.3 检查方法所有患者均在入选及每次随访时接受全面的眼科检查,包括糖尿病视网膜病变早期治疗研究(ETDRS)视力表测定BCVA、裂隙灯检查前节、非接触式眼压计测量眼压、直接眼底镜检查眼底,并行眼底彩色照相、FFA、黄斑OCT、OCTA检查。眼底彩色照相、FFA、黄斑OCT检查分别采用日本
KOWA nonmyd α-D免散瞳眼底照相机、德国海德堡共焦激光眼底造影仪(HRA-2)、美国RTVue-XR Optovue进行。OCTA检查时,所有患眼均由同一位技术人员采用angio retina 3×3 mm或6×6 mm模式扫描3次,选取图像质量最高的一次保存资料进行分析。采用自动分层模式进行分析,当有视网膜上皮脱离(PED)或视网膜下液等遮挡导致不能分辨外层视网膜界限时,人工手动调整参考线。
1.4 治疗与随访所有患者均接受玻璃体腔注射抗血管内皮生长因子(VEGF)药物治疗。治疗后每月随访一次,每次随访时均进行糖尿病视网膜病变早期治疗研究(ETDRS)视力表视力、眼压、裂隙灯、眼底镜、黄斑OCT、OCTA检查,随访3-6个月,末次随访时复查FFA。
1.5 统计学分析对比治疗前及末次随访时FFA渗漏情况、黄斑OCT及OCTA病灶大小,分析OCTA用于评估wet-AMD治疗前后的图像特征,并与FFA及OCT图像进行对比分析。
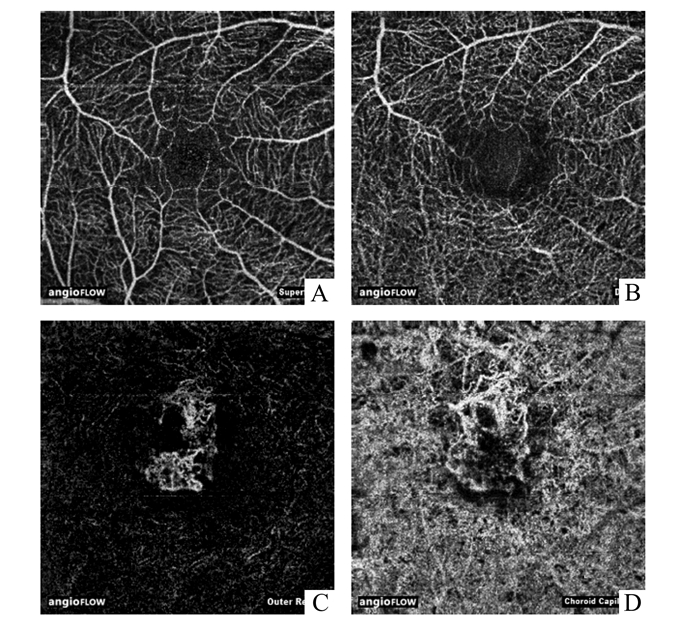
2 结果所有患眼在治疗前行FFA检查均发现中心凹或中心凹旁新生血管性渗漏。OCT平扫,28眼均发现中心凹下或中心凹旁异常高信号团块,13眼伴有视网膜下或RPE下积液。OCTA扫描结果显示浅层、深层视网膜毛细血管均未见明显异常,28眼外层视网膜、脉络膜毛细血管层均发现异常血流信号,其中9眼观察到结构清晰的新生血管(如图 1),5例在脉络膜毛细血管层发现新生血管病灶主干血管异常增粗(如图 2)。
|
图 1 典型病例OCTA分层图 A-B:浅层及深层视网膜毛细血管层未见明显异常; C:外层视网膜可见异常血流信号; D:脉络膜毛细血管层可见清晰的新生血管结构 |

|
图 2 脉络膜毛细血管图层 脉络膜毛细血管层可见CNV病灶主干血管异常增粗,毛细血管分支较少,病灶周边血管吻合(白三角所示) |
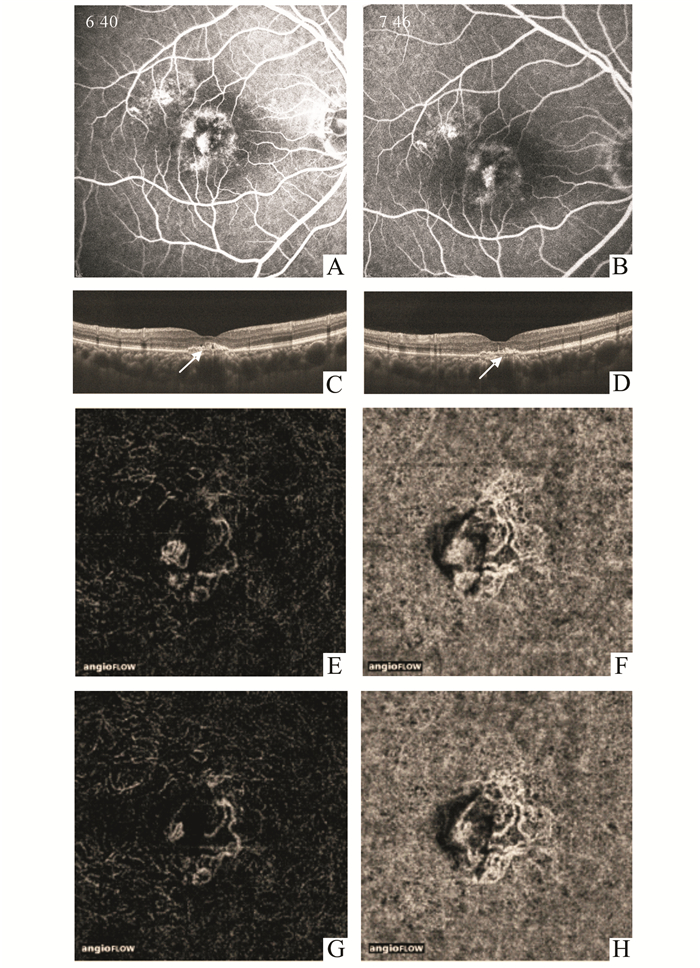
抗VEGF治疗后,每月随访一次,随访3-6个月。至末次随访时,对比分析治疗前后FFA、OCT、OCTA图像,FFA发现11眼渗漏减轻,17眼渗漏无明显变化;OCT平扫发现12眼病灶变小,16眼病灶稳定。OCTA扫描发现,15眼异常血流信号面积缩小,13眼稳定(结果见表 1)。典型病例可见FFA显示病灶渗漏减轻,OCT平扫可见黄斑中心凹下病灶缩小,OCTA示异常血流信号降低(如图 3)。
| 表 1 治疗前后FFA、OCT、OCTA对比 |
|
图 3 治疗前后对比 A与B分别为抗VEGF治疗前后FFA对比图,显示治疗后新生血管性渗漏减轻; C与D分别为抗VEGF治疗前后OCT平扫图,显示治疗后黄斑中心凹下高反射信号团块缩小(白箭头所指); E与F、G与H分别为抗VEGF治疗前后OCTA显示外层视网膜、脉络膜毛细血管成像,显示异常新生血管血流面积减小、信号减弱 |
正常人眼的解剖结构中,视网膜由视网膜血管及脉络膜血管两套血管系统分别供血,视网膜循环位于内界膜(ILM)及外丛状层(OPL)之间,而脉络膜循环位于Bruch’s膜以下。FFA及吲哚青绿血管造影(ICGA)能够直观动态地反映染料在视网膜及脉络膜血管中的转运及渗漏情况。特别是近年来结合一些创新理念而产生的如广角造影等检查技术,扩展了血管造影技术在眼底疾病中的应用[10]。这些技术虽然很大程度帮助了眼底疾病的诊断,但其均需要静脉注射造影剂,为有创检查。注射造影剂导致恶心、呕吐、休克等不良反应的发生,在肾脏、心脑血管疾病、妊娠哺乳期患者中的应用受到限制。且部分患者FFA检查中由于造影剂的渗漏明显,并不能使新生血管直接显影,只能通过积液、渗漏、水肿等表现来间接推断新生血管的存在可能[11]。
与传统的FFA相比,OCTA无需注射造影剂即可对视网膜、脉络膜毛细血管分别进行冠状面成像。正常情况下ILM到OPL之间的视网膜毛细血管又可分为浅层和深层,有研究使用OCT血管成像观察发现[12]浅层、深层视网膜毛细血管分别位于神经纤维和神经节细胞层、外丛状层,均以黄斑中心凹无血管区(FAZ)为中心,均匀、协调如蜘蛛网状相互连接,浅层分布稀疏,深层更为密集,浅层与深层之间由垂直血管连接。本研究中,28例患眼浅层或深层视网膜毛细血管以FAZ为中心、均匀协调地分布,证明CNV病灶未累及该层视网膜血管。
正常外层视网膜(OPL到Bruch’s膜之间)为无血管区[7]。本研究中28眼均在外层视网膜层发现异常血流信号,其中9眼在该层面可观察到清晰的新生血管形态。不仅进一步明确了CNV的诊断,且在患者随访观察中,我们可根据新生血管面积的大小及形态的变化来对患者病情进行更为准确的评估。
目前的OCTA只能对Bruch’s膜以下10 μm的脉络膜毛细血管进行成像,大血管伪影的干扰使其对更深层次的脉络膜大血管成像需要额外使用逆反射成像技术进行清晰显像[7]。本研究中,28眼均可观察到脉络膜毛细血管的紊乱,证明CNV病灶累及该层。Spaide等[13]对14例老年黄斑变性患者17只眼进行横断面研究,利用OCTA观察其抗VEGF治疗后CNV的形态。结果显示多次行抗VEGF治疗的患者,即使是较小的CNV,其病灶血管直径也较大,有时CNV主干血管直径可与视网膜大血管等大。该研究还发现,CNV血管不同于正常视网膜毛细血管,病灶内较少有分支毛细血管。本研究也发现类似的现象。5眼可见CNV病灶主干血管异常增粗,相比于正常视网膜毛细血管,CNV病灶毛细血管分支较少,其中部分CNV病灶周边血管相互吻合。进一步追查病史,发现5眼均为既往多次行抗VEGF治疗后复发的患者。其形成原因有待进一步研究,多次抗VEGF治疗可能与之相关,抗VEGF治疗后,CNV病灶周围游离的VEGF浓度急剧下降,导致依赖VEGF浓度生长、缺乏周细胞覆盖的新生侧支毛细血管消退。CNV病灶主干血管之间缺乏进行物质交换的侧支毛细血管,导致主干血管代偿反应而增粗。抗VEGF药效逐渐消退后,VEGF浓度回升,新生毛细血管再次生长。再次进行抗VEGF治疗,上述反应周而复始进行,CNV主干血管代偿反应而逐渐增粗,病灶周边血管逐渐代偿延伸,进而相互吻合[13]。
FFA与OCT对治疗前后荧光渗漏及病灶大小的评估,结果显示两者一致性好。而OCT与OCTA在进行结果比较时,后者能在OCT平扫未见明显变化时,探测到血流信号的减弱或增强。由此说明,wet-AMD患者在抗VEGF治疗后的早期,OCTA用于评估CNV活动性敏感性高,可在FFA及普通OCT平扫未见明显改变时根据血流信号的改变,从而在早期发现CNV病灶的消退或复发,评估治疗效果。且由于该检查快速、无创,可在抗VEGF治疗后的任何时间进行,帮助我们动态地了解病情,更好地把握治疗时机,产生更好的治疗效果。
OCTA的优势在于无需注射造影剂即可对视网膜、脉络膜毛细血管进行分层成像,即将安装定量软件后能进行血流速度、CNV面积及盘周血流指数等的量化计算[7],在眼科疾病的诊断及随访中意义重大。但其同时也存在局限性。其一,FFA能够动态显示染料荧光素在眼部血管中的充盈时间、渗漏情况等,对血管、视网膜屏障功能的判断优于OCTA[10]。其二,OCTA Angio模式获取一次图像约需3 s,对于视力较差无法看到视标、固视不好的患者,很难获取清晰的图像。其三,OCTA对于黄斑区视网膜及脉络膜毛细血管细节的显影较好,但其对视网膜最大的扫描范围仅为8 mm×8 mm[12],对于周边视网膜血管状况的评估不如目前的广角造影。未来技术发展可能会进一步克服这些局限性,使这项技术更加完美。
| [1] | Ferris FL, Fine SL, Hyman L. Age-related macular degeneration and blindness due to neovascular maculopathy[J]. Archives of Ophthalmology, 1984, 102(11): 1640-1642. DOI: 10.1001/archopht.1984.01040031330019. |
| [2] | Malamos P, Sacu S, Georgopoulos M, et al. Correlation of high-definition optical coherence tomography and fluorescein angiography imaging in neovascular macular degeneration[J]. Investigative Ophthalmology & Visual Science, 2009, 50(10): 4926-4933. |
| [3] | Trindade-Porto C, Alonso-Llamazares A, Robledo T, et al. Fluorescein-induced adverse reaction[J]. Allergy, 1999, 54(11): 1230. |
| [4] | Wang XJ, Milner TE, Nelson JS. Characterization of fluid flow velocity by optical Doppler tomography[J]. Optics Letters, 1995, 20(11): 1337-1339. DOI: 10.1364/OL.20.001337. |
| [5] | Jia Y, Tan O, Tokayer J, et al. Split-spectrum amplitude-decorrelation angiography with optical coherence tomography[J]. Optics Express, 2012, 20(4): 4710-4725. DOI: 10.1364/OE.20.004710. |
| [6] |
王林妮, 李志清, 李筱荣, 等. 光相干断层扫描血管成像技术及其在眼底相关疾病中的应用[J].
中华眼底病杂志, 2015, 31(5): 495-497.
Wang LN, Li ZQ, Li XR. Optical coherence tomography angiography and its application in fundus -related diseases[J]. Chinese Journal of Ocular Fundus Diseases, 2015, 31(5): 495-497. |
| [7] | Jia Y, Bailey ST, Hwang TS, et al. Quantitative optical coherence tomography angiography of vascular abnormalities in the living human eye[J]. PNAS USA, 2015, 112(18): 2395-2402. DOI: 10.1073/pnas.1500185112. |
| [8] | Jia Y, Bailey ST, Wilson DJ, et al. Quantitative optical coherence tomography angiography of choroidal neovascularization in age-related macular degeneration[J]. Ophthalmology, 2014, 121(7): 1435-1444. DOI: 10.1016/j.ophtha.2014.01.034. |
| [9] | Li X, Xu G, Wang Y, et al. Safety and efficacy of conbercept in neovascular age-related macular degeneration: results from a 12-month randomized phase 2 study: AURORA study[J]. Ophthalmology, 2014, 121(9): 1740-1747. DOI: 10.1016/j.ophtha.2014.03.026. |
| [10] | Nagiel A, Sadda SR, Sarraf D. A promising future for optical coherence tomography angiography[J]. JAMA Ophthalmology, 2015, 133(6): 629-630. DOI: 10.1001/jamaophthalmol.2015.0668. |
| [11] | Stanga PE, Lim JI, Hamilton P. Indocyanine green angiography in chorioretinal diseases: indications and interpretation: an evidence-based update[J]. Ophthalmology, 2003, 110(1): 15-21. DOI: 10.1016/S0161-6420(02)01563-4. |
| [12] | Savastano MC, Lumbroso B, Rispoli M. In vivo characterization of retinal vascularization morphology using optical coherence tomography angiography[J]. Retina, 2015, 35(11): 2196-1203. DOI: 10.1097/IAE.0000000000000635. |
| [13] | Spaide RF. Optical coherence tomography angiography signs of vascular abnormalization with antiangiogenic therapy for choroidal neovascularization[J]. American Journal of Ophthalmology, 2015, 160(1): 6-16. DOI: 10.1016/j.ajo.2015.04.012. |
 2017, Vol. 38
2017, Vol. 38

 ,
,